解题方法
1 . 下图是元素周期表的一部分。按要求填写下列空白:
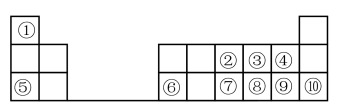
(1)元素⑦在周期表中的位置可表示为_______ 。
(2)④、⑧、⑨的简单离子半径的大小顺序为_______ (填离子符号)。
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(5)⑤的最高价氧化物对应的水化物的电子式为_______ ;⑧的氢化物的结构式为_______
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱

(1)元素⑦在周期表中的位置可表示为
(2)④、⑧、⑨的简单离子半径的大小顺序为
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(5)⑤的最高价氧化物对应的水化物的电子式为
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
2022-12-21更新
|
351次组卷
|
2卷引用:海南省北京师范大学海口附属学校2020-2021学年高一下学期月考化学试题
名校
解题方法
2 . 北京市施行的《北京市小规模食品生产经营管理规定》中明确规定:小规模食品生产经营者不得购进、存放、使用亚硝酸盐等易滥用的食品添加剂。
(1)根据物质组成上分类,亚硝酸钠(NaNO2)属于___________ (填序号)
A.钠盐 B.硝酸盐 C.氧化物
写出其电离方程式为___________ 。
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a.NaNO2+H2SO4=HNO2+NaHSO4
b.2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
①上述两个反应中,属于氧化还原反应的是___________ (填“a”或“b”)。
②其中的氧化还原反应的氧化剂是___________ (填化学式),用双线桥法表示该氧化还原反应中电子转移情况:___________ 。
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是___________ 。
A.亚硝酸钠是还原剂 B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠;如果溶液无变化,则可以证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为2NaNO2+2X+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O(已配平),其中X是___________ (填化学式),该反应的离子方程式为___________ 。
③含NaNO2的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠生成一种无毒气体,写出该反应的离子方程式___________ 。
(1)根据物质组成上分类,亚硝酸钠(NaNO2)属于
A.钠盐 B.硝酸盐 C.氧化物
写出其电离方程式为
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a.NaNO2+H2SO4=HNO2+NaHSO4
b.2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
①上述两个反应中,属于氧化还原反应的是
②其中的氧化还原反应的氧化剂是
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是
A.亚硝酸钠是还原剂 B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠;如果溶液无变化,则可以证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为2NaNO2+2X+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O(已配平),其中X是
③含NaNO2的废水必须经处理后才能排放,可用铵盐来处理亚硝酸钠生成一种无毒气体,写出该反应的离子方程式
您最近一年使用:0次
3 . 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请回答下列问题
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是___________ ;写出镓的氯化物和氨水反应的化学方程式___________ 。铍、铝二者的单质、化合物均具有相似的化学性质,写出BeCl2溶液与Na2BeO2的水溶液混合的化学方程式___________ 。
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
(3)在稀 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为___________ (用化学式表示)。
(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为___________ 。
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
(1)31号元素镓(Ga)与铝同族。镓(Ga)在周期表的位置是
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
| A.青铜、不锈钢、硬铝都是合金 |
| B.铜表面易形成致密的氧化膜 |
| C.铜与O2反应生成黑色的CuO |
| D.CuSO4·5H2O是一种混合物,加热后变为白色固体 |
 溶液中加入适量
溶液中加入适量 溶液至
溶液至 恰好完全沉淀,此时铝元素的存在形式主要为
恰好完全沉淀,此时铝元素的存在形式主要为(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所涉及的反应的离子方程式为
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加KSCN溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.该同学的实验方案是否合理?
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)将 溶液蒸干再灼烧,最后得到的主要固体物质是
溶液蒸干再灼烧,最后得到的主要固体物质是_______ (写化学式)。
(2)已知草酸是二元弱酸,常温下测得0.1mol/L的 的pH为4.8,则此
的pH为4.8,则此 溶液中
溶液中
_______  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是____________________________ (请用反应的离子方程式表示)。
(4) 、
、 两种温度下
两种温度下 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。

①
______  (填“>”“<”或“=”),
(填“>”“<”或“=”), 温度时
温度时
_______ 。
②根据 温度时
温度时 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是_______ (填标号)。
A.加入 固体可由a点变为b点
固体可由a点变为b点
B. 温度下,在
温度下,在 曲线上方区域(不含曲线)的任意一点时,均有
曲线上方区域(不含曲线)的任意一点时,均有 沉淀生成
沉淀生成
C.蒸发溶剂可能由d点变为 曲线上a、b之间(不含a、b)的某一点
曲线上a、b之间(不含a、b)的某一点
D.升温可由b点变为d点
③ 温度时,现有0.2mol的
温度时,现有0.2mol的 沉淀,每次用1L饱和
沉淀,每次用1L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理_______ 次。[提示: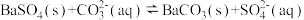 ,
,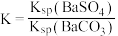 ,
,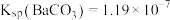 ]
]
(5)已知: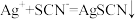 (白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
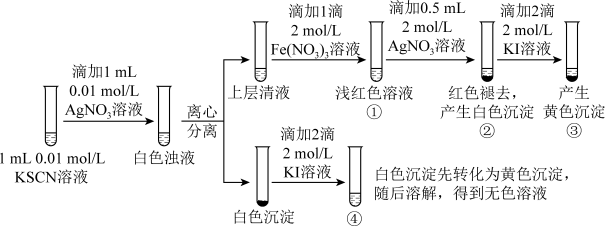
下列说法中不正确的是__________
①中现象能说明 与
与 生成的白色浊液中存在沉淀溶解平衡
生成的白色浊液中存在沉淀溶解平衡
②中现象产生的原因是发生了反应: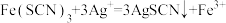
③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
④中黄色沉淀溶解的原因可能是AgI与KI溶液中的 进一步发生了反应
进一步发生了反应
(1)将
 溶液蒸干再灼烧,最后得到的主要固体物质是
溶液蒸干再灼烧,最后得到的主要固体物质是(2)已知草酸是二元弱酸,常温下测得0.1mol/L的
 的pH为4.8,则此
的pH为4.8,则此 溶液中
溶液中
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是
(4)
 、
、 两种温度下
两种温度下 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
①

 (填“>”“<”或“=”),
(填“>”“<”或“=”), 温度时
温度时
②根据
 温度时
温度时 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是A.加入
 固体可由a点变为b点
固体可由a点变为b点B.
 温度下,在
温度下,在 曲线上方区域(不含曲线)的任意一点时,均有
曲线上方区域(不含曲线)的任意一点时,均有 沉淀生成
沉淀生成C.蒸发溶剂可能由d点变为
 曲线上a、b之间(不含a、b)的某一点
曲线上a、b之间(不含a、b)的某一点D.升温可由b点变为d点
③
 温度时,现有0.2mol的
温度时,现有0.2mol的 沉淀,每次用1L饱和
沉淀,每次用1L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理 ,
,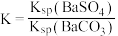 ,
,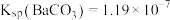 ]
](5)已知:
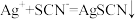 (白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
下列说法中不正确的是
①中现象能说明
 与
与 生成的白色浊液中存在沉淀溶解平衡
生成的白色浊液中存在沉淀溶解平衡②中现象产生的原因是发生了反应:
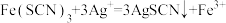
③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
④中黄色沉淀溶解的原因可能是AgI与KI溶液中的
 进一步发生了反应
进一步发生了反应
您最近一年使用:0次
名校
5 . 在人类社会的发展进程中,金属起着重要的作用。请回答下列问题:
(1)金属元素的原子结构决定了金属元素的性质、在自然界中的存在形式及冶炼方法。金属的冶炼一般有下列方法:
a.焦炭法 b.水煤气(氢气和一氧化碳)法 c.活泼金属置换法 d.电解法
请从上述四种方法中选择相应的字母填入表中空格:
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
(3)铁及其化合物在生产生活中具有广泛应用。一定条件下,铁及其化合物之间发生相互的转化。
①在给定条件下,下列选项所示的物质间转化均能实现的是___________ 。
A.Fe2O3(s)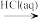 FeCl3(aq)
FeCl3(aq) Fe(s)
Fe(s)
B.FeS2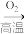 SO2
SO2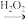 H2SO3
H2SO3
C.Fe2O3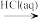 FeCl3(aq)
FeCl3(aq) 无水FeCl3
无水FeCl3
D.Fe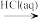 FeCl2(aq)
FeCl2(aq)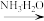 Fe(OH)2
Fe(OH)2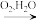 Fe(OH)3
Fe(OH)3
②NaFeO2可完全水解成Fe(OH)3,水解反应的离子方程式:___________ 。
(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理___________ (填“合理”或“不合理”)。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是___________ ,反应的离子方程式为___________ 。
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是___________ (填化学式)。该同学的实验方案是否合理?___________ (填“合理”或“不合理”)。理由:___________ 。
(1)金属元素的原子结构决定了金属元素的性质、在自然界中的存在形式及冶炼方法。金属的冶炼一般有下列方法:
a.焦炭法 b.水煤气(氢气和一氧化碳)法 c.活泼金属置换法 d.电解法
请从上述四种方法中选择相应的字母填入表中空格:
| 高炉炼铁 | 湿法炼铜 | 铝热法炼铁 |
(2)人类最早使用的金属材料的主要成分是铜。下列有关铜元素的说法中,不正确的是___________(填字母)
| A.青铜、不锈钢、硬铝都是合金 |
| B.铜表面易形成致密的氧化膜 |
| C.铜与O2反应生成黑色的CuO |
| D.CuSO4·5H2O是一种混合物,加热后变为白色固体 |
①在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe2O3(s)
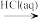 FeCl3(aq)
FeCl3(aq) Fe(s)
Fe(s)B.FeS2
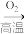 SO2
SO2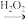 H2SO3
H2SO3C.Fe2O3
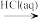 FeCl3(aq)
FeCl3(aq) 无水FeCl3
无水FeCl3D.Fe
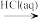 FeCl2(aq)
FeCl2(aq)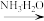 Fe(OH)2
Fe(OH)2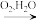 Fe(OH)3
Fe(OH)3②NaFeO2可完全水解成Fe(OH)3,水解反应的离子方程式:
(4)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1460 |
| 沸点/℃ | 2467 | 2980 | 2750 |
①该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
③另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是
您最近一年使用:0次
解题方法
6 . 已知:反应aA(g)+bB(g)⇌cC(g),某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
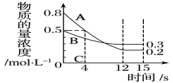
(1)经测定前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为_______
(2)若上述反应分别在甲、乙、丙三个温度体积相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3mol·L-1·s-1;乙:v(B)=0.12mol·L-1·s-1;丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ (用甲、乙、丙表示)。
(3)0~4s内,A的平均反应速率为_______ 。
(4)下列说法可以证明aA(g)+bB(g)⇌cC(g)已达平衡状态的是_______
A.单位时间内生成nmolA的同时消耗nmolB
B.混合气体的密度不再改变
C.反应速率v(A)=v(B)=v(C)
D.C的物质的浓度不再改变

(1)经测定前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为
(2)若上述反应分别在甲、乙、丙三个温度体积相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3mol·L-1·s-1;乙:v(B)=0.12mol·L-1·s-1;丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)0~4s内,A的平均反应速率为
(4)下列说法可以证明aA(g)+bB(g)⇌cC(g)已达平衡状态的是
A.单位时间内生成nmolA的同时消耗nmolB
B.混合气体的密度不再改变
C.反应速率v(A)=v(B)=v(C)
D.C的物质的浓度不再改变
您最近一年使用:0次
7 . 糖尿病是由于人体内胰岛素紊乱导致的代谢紊化综合征,以高血糖为主要标志,长期摄入高热量食品和缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是___________ (填序号)。
A.葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子中含有6个水分子
B.葡萄糖与果糖互为同分异构体
C.糖尿病患者尿糖较高,可用新制的氢氧化铜来检测患者尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇(结构简式为CH2 OH(CHOH)3CH2OH)是一种甜味剂,糖尿病患者食用后不会导致血糖升高。若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有___________ 种(不考虑立体异构)。
(3)糖尿病患者不可饮酒,酒精在肝脏内可转化成有机物A,对A进行检测的实验结果如下:
①通过实验测得A的相对分子质量为60;
②A由C、H、O三种元素组成,分子中只存在两种不同化学环境的氢原子,且这两种氢原子的个数比为1:3;
③A可与酒精在一定条件下生成有芳香气味的物质。
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入___________ 溶液,发现有气泡冒出;写出A与乙醇反应的化学方程式:___________ 。
(4)糖尿病患者宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质,下列说法正确的是___________ (填序号)。
A.蛋白质遇碘单质会变蓝
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含促进纤维素水解的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质遇浓硝酸变黄,称为蛋白质的显色反应
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是
A.葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子中含有6个水分子
B.葡萄糖与果糖互为同分异构体
C.糖尿病患者尿糖较高,可用新制的氢氧化铜来检测患者尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)木糖醇(结构简式为CH2 OH(CHOH)3CH2OH)是一种甜味剂,糖尿病患者食用后不会导致血糖升高。若用氯原子取代木糖醇分子中碳原子上的氢原子,得到的一氯代物有
(3)糖尿病患者不可饮酒,酒精在肝脏内可转化成有机物A,对A进行检测的实验结果如下:
①通过实验测得A的相对分子质量为60;
②A由C、H、O三种元素组成,分子中只存在两种不同化学环境的氢原子,且这两种氢原子的个数比为1:3;
③A可与酒精在一定条件下生成有芳香气味的物质。
请设计实验证明A与碳酸的酸性强弱:向A溶液中加入
(4)糖尿病患者宜多吃蔬菜和豆类食品,豆类食品中富有蛋白质,下列说法正确的是
A.蛋白质遇碘单质会变蓝
B.蛋白质可以通过烧焦时的特殊气味鉴别
C.人体内不含促进纤维素水解的酶,不能消化纤维素,因此蔬菜中的纤维素对人体没有用处
D.部分蛋白质遇浓硝酸变黄,称为蛋白质的显色反应
您最近一年使用:0次
名校
8 . (1)实验室用过量的锌和一定体积的盐酸制取氢气,如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,你认为可行的是__ (填字母)。
A.CH3COONa溶液 B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
(2)下列说法可以证明H2(g)+I2(g) ⇌ 2HI(g)已达平衡状态的是__ 。
A.单位时间内生成nmolH2的同时,生成nmolHI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)= v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
A.CH3COONa溶液 B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
(2)下列说法可以证明H2(g)+I2(g) ⇌ 2HI(g)已达平衡状态的是
A.单位时间内生成nmolH2的同时,生成nmolHI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=
 v(HI)
v(HI)E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
您最近一年使用:0次
解题方法
9 . 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中不溶解。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢的反应一段时间。
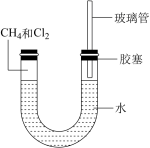
(1)下列关于甲烷结构的说法中正确的是___________ 。
a.甲烷的分子式是CH4,5个原子共面
b.甲烷中的任意三个原子都不共面
c.甲烷分子的空间构型属于正四面体结构
(2)1molCH4与氯气发生取代反应,待反应完全后,测得四种产物的物质的量相等,则消耗氯气的物质的量是___________
a.1mol b.2.5mol c.4mol d.5mol
(3)下列事实能证明甲烷分子是正四面体结构的是___________ 。
a.CH3Cl只代表一种物质
b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质
d.CCl4只代表一种物质
(4)烃分子中的碳原子与氢原子结合的方式是___________ 。
a.通过1个共价键
b.通过2个共价键
c.形成4对共用电子对
d.通过离子键和共价键

(1)下列关于甲烷结构的说法中正确的是
a.甲烷的分子式是CH4,5个原子共面
b.甲烷中的任意三个原子都不共面
c.甲烷分子的空间构型属于正四面体结构
(2)1molCH4与氯气发生取代反应,待反应完全后,测得四种产物的物质的量相等,则消耗氯气的物质的量是
a.1mol b.2.5mol c.4mol d.5mol
(3)下列事实能证明甲烷分子是正四面体结构的是
a.CH3Cl只代表一种物质
b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质
d.CCl4只代表一种物质
(4)烃分子中的碳原子与氢原子结合的方式是
a.通过1个共价键
b.通过2个共价键
c.形成4对共用电子对
d.通过离子键和共价键
您最近一年使用:0次
10 . 阅读短文,回答问题。
世界卫生组织(WHO)和中国卫健委公认二氧化氯( )为新时代绿色消毒剂,其特点是无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播餐饮用具可用
)为新时代绿色消毒剂,其特点是无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播餐饮用具可用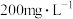 的
的 溶液浸泡游泳池水可按
溶液浸泡游泳池水可按 的
的 进行消毒。常温下,
进行消毒。常温下, 气体与
气体与 具有相似的颜色与气味,在水中的溶解度是
具有相似的颜色与气味,在水中的溶解度是 的5~8倍。
的5~8倍。 是强氧化剂,不与冷水反应,遇热水则分解成HClO、
是强氧化剂,不与冷水反应,遇热水则分解成HClO、 和
和 。研究表明,
。研究表明, 在浓度低于
在浓度低于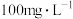 时不会对人体产生任何的影响。我国卫健委提出,逐步用
时不会对人体产生任何的影响。我国卫健委提出,逐步用 替代
替代 进行饮用水消毒。相信在不久的将来,
进行饮用水消毒。相信在不久的将来, 将广泛应用到杀菌消毒领域。
将广泛应用到杀菌消毒领域。
(1)请依据以上短文,下列说法不正确的是___________ 。
A.可以用等浓度的 溶液对餐饮用具和游泳池进行消毒
溶液对餐饮用具和游泳池进行消毒
B. 是有刺激性气味的气体
是有刺激性气味的气体
C. 杀菌力强、属于广谱高效消毒剂
杀菌力强、属于广谱高效消毒剂
D.配制 的水溶液时,应选用热水较为适宜
的水溶液时,应选用热水较为适宜
E.未来 在生产生活中更广泛的使用,是我国发展绿色消毒剂的方向。
在生产生活中更广泛的使用,是我国发展绿色消毒剂的方向。
(2)某同学推测 能与
能与 溶液反应,你认为他的推测是否合理
溶液反应,你认为他的推测是否合理___________ (填“合理”或“不合理”),用简要的文字说明理由___________ 。
(3)制备的反应原理为: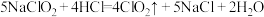 。
。
①按物质分类,上述反应中各物质未涉及的类别是___________ (填序号)。
A.酸 B.碱 C.盐 D.非金属氧化物 E.金属氧化物
②请用单线桥标出此反应的电子转移方向和数目:__________
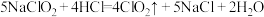
③ 的还原产物是
的还原产物是___________ ;检验反应后的溶液中含有 的常用试剂是
的常用试剂是___________ 。
④上述反应中___________ (填“能”或“不能”)用稀硫酸代替盐酸,说明理由__________
(4)请设计简易方案证明 具有永久漂白性
具有永久漂白性___________ 。
(5)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的 所需
所需 的质量与指定含氯消毒剂的质量之比,常用百分数表示。则
的质量与指定含氯消毒剂的质量之比,常用百分数表示。则 的有效氯含量是
的有效氯含量是___________ 。
世界卫生组织(WHO)和中国卫健委公认二氧化氯(
 )为新时代绿色消毒剂,其特点是无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播餐饮用具可用
)为新时代绿色消毒剂,其特点是无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播餐饮用具可用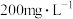 的
的 溶液浸泡游泳池水可按
溶液浸泡游泳池水可按 的
的 进行消毒。常温下,
进行消毒。常温下, 气体与
气体与 具有相似的颜色与气味,在水中的溶解度是
具有相似的颜色与气味,在水中的溶解度是 的5~8倍。
的5~8倍。 是强氧化剂,不与冷水反应,遇热水则分解成HClO、
是强氧化剂,不与冷水反应,遇热水则分解成HClO、 和
和 。研究表明,
。研究表明, 在浓度低于
在浓度低于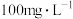 时不会对人体产生任何的影响。我国卫健委提出,逐步用
时不会对人体产生任何的影响。我国卫健委提出,逐步用 替代
替代 进行饮用水消毒。相信在不久的将来,
进行饮用水消毒。相信在不久的将来, 将广泛应用到杀菌消毒领域。
将广泛应用到杀菌消毒领域。(1)请依据以上短文,下列说法不正确的是
A.可以用等浓度的
 溶液对餐饮用具和游泳池进行消毒
溶液对餐饮用具和游泳池进行消毒B.
 是有刺激性气味的气体
是有刺激性气味的气体C.
 杀菌力强、属于广谱高效消毒剂
杀菌力强、属于广谱高效消毒剂D.配制
 的水溶液时,应选用热水较为适宜
的水溶液时,应选用热水较为适宜E.未来
 在生产生活中更广泛的使用,是我国发展绿色消毒剂的方向。
在生产生活中更广泛的使用,是我国发展绿色消毒剂的方向。(2)某同学推测
 能与
能与 溶液反应,你认为他的推测是否合理
溶液反应,你认为他的推测是否合理(3)制备的反应原理为:
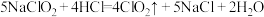 。
。①按物质分类,上述反应中各物质未涉及的类别是
A.酸 B.碱 C.盐 D.非金属氧化物 E.金属氧化物
②请用单线桥标出此反应的电子转移方向和数目:
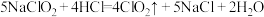
③
 的还原产物是
的还原产物是 的常用试剂是
的常用试剂是④上述反应中
(4)请设计简易方案证明
 具有永久漂白性
具有永久漂白性(5)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的
 所需
所需 的质量与指定含氯消毒剂的质量之比,常用百分数表示。则
的质量与指定含氯消毒剂的质量之比,常用百分数表示。则 的有效氯含量是
的有效氯含量是
您最近一年使用:0次



