名校
解题方法
1 . I.室温时,向100mL 0.1 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
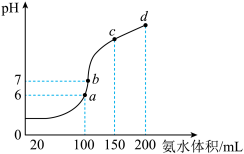
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是______________ ;
(2)在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________ ;
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):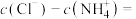
_______________ ;
(4)25℃时,同浓度的下列溶液:①HCl;② ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是_________________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下, 的
的 ,
, 的
的 ,该温度下
,该温度下______________ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(6)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到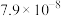 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为___________________ mol/L[已知: ,此时
,此时______________ (填“符合”或“不符合”)《生活饮用水卫生标准》。
 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是
(2)在b点,溶液中各离子浓度由大到小的排列顺序是
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):
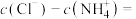
(4)25℃时,同浓度的下列溶液:①HCl;②
 ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下,
 的
的 ,
, 的
的 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(6)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到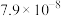 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为 ,此时
,此时
您最近一年使用:0次
名校
2 . 某课外小组设计如图1所示装置为电源对粗铜(含有Cu,少量Fe、Zn、Ag、Au等)进行精炼。(已知:装置I中发生的副反应为Fe电极直接与 溶液反应)
溶液反应)
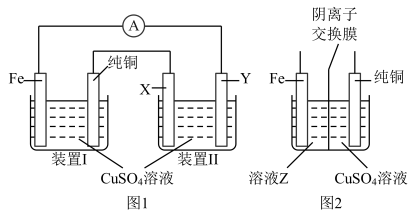
(1)装置I中Fe电极上发生反应的电极反应式为_______ 。
(2)当反应一段时间后,经测量发现,Fe电极质量减少0.80 g,纯铜电极质量增重0.96 g,则实际经过电流表的电子的物质的量为_______ mol,装置I的能量转化率为_______ 。(已知:装置I中 足量)
足量)
(3)有同学提议,为避免副反应的发生,应将装置I改为如图2所示装置,则溶液Z中溶质的化学式为_______ 。
(4)装置II中X电极材料的名称为_______ ,Y电极上的电极反应式为_______ ,一段时间后,装置II溶液中阳离子主要为 和
和_______ 。
 溶液反应)
溶液反应)
(1)装置I中Fe电极上发生反应的电极反应式为
(2)当反应一段时间后,经测量发现,Fe电极质量减少0.80 g,纯铜电极质量增重0.96 g,则实际经过电流表的电子的物质的量为
 足量)
足量)(3)有同学提议,为避免副反应的发生,应将装置I改为如图2所示装置,则溶液Z中溶质的化学式为
(4)装置II中X电极材料的名称为
 和
和
您最近一年使用:0次
2023-01-11更新
|
70次组卷
|
2卷引用:甘肃省庆阳市2022-2023学年高二上学期期末考试化学试题
名校
3 . 氨是重要的化工原料,已知 在纯氧中燃烧的能量变化如图。
在纯氧中燃烧的能量变化如图。
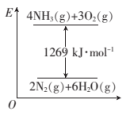
(1)已知:
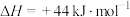 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为_______ 。
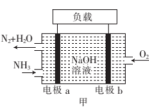
(2) 的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为
的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为_______ (填“正极”或“负极”);电极a上的电极反应为_______ 。当共消耗1.568 L(标准状况)气体时,通过负载的电子的物质的量为_______ mol。
(3)一种肼( )燃料电池的工作原理如图乙所示。
)燃料电池的工作原理如图乙所示。
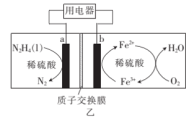
①a极的电极反应式为_______ ;电池中 的离子方程式为
的离子方程式为_______ 。
②若利用该电池给铅酸蓄电池充电,当消耗3.2 g 时,
时, 电极质量
电极质量_______ (填“增加”或“减少”)_______ g。
 在纯氧中燃烧的能量变化如图。
在纯氧中燃烧的能量变化如图。
(1)已知:

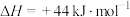 ,则
,则 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)
 的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为
的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极b为
(3)一种肼(
 )燃料电池的工作原理如图乙所示。
)燃料电池的工作原理如图乙所示。
①a极的电极反应式为
 的离子方程式为
的离子方程式为②若利用该电池给铅酸蓄电池充电,当消耗3.2 g
 时,
时, 电极质量
电极质量
您最近一年使用:0次
2023-01-11更新
|
364次组卷
|
2卷引用:甘肃省庆阳市2022-2023学年高二上学期期末考试化学试题
解题方法
4 . 下列物质中:①醋酸溶液 ②氨水 ③熔融的NaOH ④稀盐酸 ⑤ 固体⑥
固体⑥ 固体 ⑦
固体 ⑦ 溶液 ⑧
溶液 ⑧ 固体
固体
(1)上述物质中属于强电解质的是_______ (填序号)。
(2)写出⑥分别在水溶液和熔融状态下的电离方程式:水溶液中:_______ ;熔融状态下:_______ 。
(3)25℃时,将⑤的溶液和⑥的溶液等浓度、等体积混合,混合溶液中:
_______ (填“>”、“<”或“=”) 。25℃时,将
。25℃时,将
 ②加入
②加入
 ④中,当
④中,当 时,混合溶液中离子浓度大小顺序为
时,混合溶液中离子浓度大小顺序为_______ (填离子符号)。
(4)25℃时, 的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:
的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:_______ 。(填标号,下同)
(5)25℃时,将等pH、V L的②和③的溶液分别稀释至2V L,则稀释后溶液的pH大小关系为_______ 。
 固体⑥
固体⑥ 固体 ⑦
固体 ⑦ 溶液 ⑧
溶液 ⑧ 固体
固体(1)上述物质中属于强电解质的是
(2)写出⑥分别在水溶液和熔融状态下的电离方程式:水溶液中:
(3)25℃时,将⑤的溶液和⑥的溶液等浓度、等体积混合,混合溶液中:

 。25℃时,将
。25℃时,将
 ②加入
②加入
 ④中,当
④中,当 时,混合溶液中离子浓度大小顺序为
时,混合溶液中离子浓度大小顺序为(4)25℃时,
 的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:
的⑤的溶液、⑥的溶液、③的溶液和⑦四种溶液的pH由大到小的排列顺序:(5)25℃时,将等pH、V L的②和③的溶液分别稀释至2V L,则稀释后溶液的pH大小关系为
您最近一年使用:0次
5 . 氧化剂和还原剂在生产生活中应用非常广泛。
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝石(KNO3)、木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,氧化剂是_______ ,还原剂是_______ ,氧化产物是_______ ,还原产物是_______ 。
(2)水是生命之源,在常温常压下为无色无味液体,作为一种化学物质,水也会参与很多化学反应,如:
①2Na+2H2O=2NaOH+H2↑
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2H2O=2H2↑+O2↑
以上反应中,H2O只作氧化剂的是_______ ;H2O只作还原剂的是_______ ;H2O既作氧化剂,又作还原剂的是_______ ;H2O既不作氧化剂,又不作还原剂的是_______ 。
(3)高锰酸钾和浓盐酸可以发生如下反应制备氯气(Cl2):2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①已知KMnO4和MnCl2皆属于可溶盐,写出该反应的离子方程式_______ ;
②抄写化学方程式,用单线桥法标出电子转移的方向和数目_______ ;
③其中,氧化剂和还原剂的个数比为_______ 。
④在酸性溶液中,氧化性:KMnO4_______ Cl2(填大于或小于)。
(4)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2的化学方程式:_______ 。
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝石(KNO3)、木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,氧化剂是
(2)水是生命之源,在常温常压下为无色无味液体,作为一种化学物质,水也会参与很多化学反应,如:
①2Na+2H2O=2NaOH+H2↑
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2H2O=2H2↑+O2↑
以上反应中,H2O只作氧化剂的是
(3)高锰酸钾和浓盐酸可以发生如下反应制备氯气(Cl2):2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①已知KMnO4和MnCl2皆属于可溶盐,写出该反应的离子方程式
②抄写化学方程式,用单线桥法标出电子转移的方向和数目
③其中,氧化剂和还原剂的个数比为
④在酸性溶液中,氧化性:KMnO4
(4)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2的化学方程式:
您最近一年使用:0次
名校
6 . 氨是最基本的化工原料之一。德国化学家哈伯因研究合成氨反应获1918年诺贝尔化学奖。今天,人类依旧和哈伯当年一样在工业上用 和
和 合成氨,反应如下:
合成氨,反应如下:


(1)从如图可知,合成氨反应的压强越大, 的产率越大,但一般选择10MPa到30MPa,原因是
的产率越大,但一般选择10MPa到30MPa,原因是__________ 。
(2)合成氨反应是放热反应,理论上分析,温度越低越有利于反应正向进行,而一般采用的温度为__________ ,原因是__________ 。
(3)合成氨选用的催化剂是__________ 。为防止催化剂中毒,要采取的措施是__________ 。
 和
和 合成氨,反应如下:
合成氨,反应如下:


(1)从如图可知,合成氨反应的压强越大,
 的产率越大,但一般选择10MPa到30MPa,原因是
的产率越大,但一般选择10MPa到30MPa,原因是(2)合成氨反应是放热反应,理论上分析,温度越低越有利于反应正向进行,而一般采用的温度为
(3)合成氨选用的催化剂是
您最近一年使用:0次
名校
7 . 将下述氧化还原反应配平。
(1)_________

(2)_________

(1)

(2)

您最近一年使用:0次
名校
8 . 依据信息要求填空
(1) 是一种酸性氧化物,可用过量
是一种酸性氧化物,可用过量 溶液吸收含
溶液吸收含 的尾气,该反应的离子方程式:
的尾气,该反应的离子方程式:_______
(2)复方氢氧化铝片主要用于缓解人体胃酸(主要成分是盐酸)过多,相关反应的离子方程式_______ 。
(3)向碳酸钠溶液中滴加少量盐酸的离子方程式:_______ 。
(4)少量 与过量
与过量 反应的离子方程式:
反应的离子方程式:_______ 。
(5)用双线桥法表示反应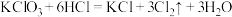 的电子转移情况:
的电子转移情况:_______ 。
(1)
 是一种酸性氧化物,可用过量
是一种酸性氧化物,可用过量 溶液吸收含
溶液吸收含 的尾气,该反应的离子方程式:
的尾气,该反应的离子方程式:(2)复方氢氧化铝片主要用于缓解人体胃酸(主要成分是盐酸)过多,相关反应的离子方程式
(3)向碳酸钠溶液中滴加少量盐酸的离子方程式:
(4)少量
 与过量
与过量 反应的离子方程式:
反应的离子方程式:(5)用双线桥法表示反应
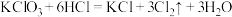 的电子转移情况:
的电子转移情况:
您最近一年使用:0次
名校
解题方法
9 . 钠、氯及其化合物有如下转化关系,请按要求填空:

(1)Na2O2常用于呼吸面具中,有关反应的化学方程式为_______ ,_______ 。
(2)实验探究次氯酸的分解规律:用数字传感器测量光照条件下装有氯水的容器中氧气浓度的变化、氯水的pH变化以及氯离子浓度的变化测量数据如图所示。

实验室用二氧化锰制备氯气时发生反应的化学方程式为_______ ;该反应中氧化剂与还原剂的物质的量之比为_______ 。依据数据,光照时氯水的pH变化及氯离子浓度变化的原因是_______ (用化学方程式表示)。
(3)工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O 2NaOH+Cl2↑+H2↑。用双线桥表示出电子转移的方向和数目
2NaOH+Cl2↑+H2↑。用双线桥表示出电子转移的方向和数目_______ ,电解饱和食盐水消耗117 g NaCl时,理论上可得到氯气的体积是_______ L(标准状况)。

(1)Na2O2常用于呼吸面具中,有关反应的化学方程式为
(2)实验探究次氯酸的分解规律:用数字传感器测量光照条件下装有氯水的容器中氧气浓度的变化、氯水的pH变化以及氯离子浓度的变化测量数据如图所示。

实验室用二氧化锰制备氯气时发生反应的化学方程式为
(3)工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O
 2NaOH+Cl2↑+H2↑。用双线桥表示出电子转移的方向和数目
2NaOH+Cl2↑+H2↑。用双线桥表示出电子转移的方向和数目
您最近一年使用:0次
10 . 回答下列问题:
(1)已知,常温下几种物质的电离常数如下:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=3.0×10-8。少量二氧化碳通入到次氯酸钠中的化学方程式_________ 。
(2)室温下,pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/LHCl,应加_________ mL。(体积变化忽略不计)
(3)现有常温下0.1mol·L-1NH4Cl溶液。
①你认为该溶液呈_________ 性,原因是(用离子方程式表示):_________ 。
②该溶液中离子浓度大小顺序为:_________ 。
(4)直接加热CuCl2溶液得不到纯净的无水CuCl2固体,原因是:_________ (用化学方程式表示),因此CuCl2·2H2O晶体得到纯净的无水的合理方法是_________ 。
(1)已知,常温下几种物质的电离常数如下:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=3.0×10-8。少量二氧化碳通入到次氯酸钠中的化学方程式
(2)室温下,pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/LHCl,应加
(3)现有常温下0.1mol·L-1NH4Cl溶液。
①你认为该溶液呈
②该溶液中离子浓度大小顺序为:
(4)直接加热CuCl2溶液得不到纯净的无水CuCl2固体,原因是:
您最近一年使用:0次



