1 . 有效除去大气中的 和氮氧化物,是打赢蓝天保卫战的重中之重。
和氮氧化物,是打赢蓝天保卫战的重中之重。
某温度下, 气体在一体积固定的密闭容器中发生如下反应:
气体在一体积固定的密闭容器中发生如下反应: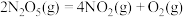 (慢反应)
(慢反应)  ,
,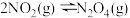 (快反应)
(快反应)  ,体系的总压强
,体系的总压强 和
和 随时间的变化如图所示:
随时间的变化如图所示:

(1)图中表示 压强变化的曲线是
压强变化的曲线是________ (填“甲”或“乙”)。
(2)已知 分解的反应速率
分解的反应速率 ,
, 时,
时,
________  ,
,
________ 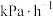 (结果保留两位小数,下同)。
(结果保留两位小数,下同)。
(3)该温度下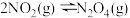 反应的平衡常数
反应的平衡常数
________  (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
 和氮氧化物,是打赢蓝天保卫战的重中之重。
和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,
 气体在一体积固定的密闭容器中发生如下反应:
气体在一体积固定的密闭容器中发生如下反应: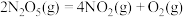 (慢反应)
(慢反应)  ,
,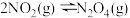 (快反应)
(快反应)  ,体系的总压强
,体系的总压强 和
和 随时间的变化如图所示:
随时间的变化如图所示:
(1)图中表示
 压强变化的曲线是
压强变化的曲线是(2)已知
 分解的反应速率
分解的反应速率 ,
, 时,
时,
 ,
,
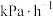 (结果保留两位小数,下同)。
(结果保留两位小数,下同)。(3)该温度下
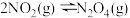 反应的平衡常数
反应的平衡常数
 (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
您最近一年使用:0次
2023-02-14更新
|
565次组卷
|
4卷引用:2020届福建高三化学总复习——-压强平衡常数辅助练习
2020届福建高三化学总复习——-压强平衡常数辅助练习专题5.3 化学计算(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专项特训3 多平衡体系的综合分析(已下线)03 常考题空3 分压平衡常数(Kp)计算 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
2 . (1) 标准状况下,3.4 g NH3的分子数为:___________ ;质子数约为:____ ;它与_____ L H2S含有相同数目的氢原子。
(2)同温压下,体积比为3:2的O2与O3,其质量之比为___________ ;密度之比为_________ 。
(3) 已知32 g X与40 g Y恰好完全反应,生成m g Q和9 g H,在相同条件下16 g X和足量Y混合0.25 mol Q和若干摩的H,则物质Q的摩尔质量应为________ 。
(4)取100 mL 1 mol/L和300 mL 0.5 mol/L MgCl2溶液配成混合溶液(假设混合后溶液体积等于混合前两种溶液之和),则混合溶液中Cl-浓度为______ mol/L。
(5)如图所示,一密闭容器被无摩擦、可滑动的两隔板A、B分成甲、乙两室。标准状况下,在乙充入8.4 g N2,甲室充入8.8 g H2和O2的混合气体。

①甲室中原子个数为_________ , 甲室中H2与O2的质量比为_________ 。
②维持温度不变,将隔板A固定在“3”处,将隔板B固定在“5”处,此时甲、乙两室中气体的压强比P (甲):P (乙) =_____________ 。
③用电火花处理甲室中的气体使其充分反应,反应后恢复至标准状况。甲室与乙室此时的体积比为_____ 。
(2)同温压下,体积比为3:2的O2与O3,其质量之比为
(3) 已知32 g X与40 g Y恰好完全反应,生成m g Q和9 g H,在相同条件下16 g X和足量Y混合0.25 mol Q和若干摩的H,则物质Q的摩尔质量应为
(4)取100 mL 1 mol/L和300 mL 0.5 mol/L MgCl2溶液配成混合溶液(假设混合后溶液体积等于混合前两种溶液之和),则混合溶液中Cl-浓度为
(5)如图所示,一密闭容器被无摩擦、可滑动的两隔板A、B分成甲、乙两室。标准状况下,在乙充入8.4 g N2,甲室充入8.8 g H2和O2的混合气体。

①甲室中原子个数为
②维持温度不变,将隔板A固定在“3”处,将隔板B固定在“5”处,此时甲、乙两室中气体的压强比P (甲):P (乙) =
③用电火花处理甲室中的气体使其充分反应,反应后恢复至标准状况。甲室与乙室此时的体积比为
您最近一年使用:0次
名校
解题方法
3 . 向50mLbmol/L的AlCl3溶液中加入50mLamol/L的NaOH溶液。
(1)当a、b关系不同时,反应所生成沉淀的质量不同。填写下表:___
(2)若b=1mol/L时,要生成沉淀3.12g,则a值等于多少___ ?
(1)当a、b关系不同时,反应所生成沉淀的质量不同。填写下表:
| a与b的关系 | 生成沉淀的质量(g) |
(2)若b=1mol/L时,要生成沉淀3.12g,则a值等于多少
您最近一年使用:0次
名校
4 . 2份50mL同样的NaOH的溶液,分别向其中逐渐通入一定量的CO2,得到甲和乙 两种溶液,在甲和乙溶液中分别逐渐加入1mol/LHCl的盐酸溶液,产生的二氧化碳气体(标准状况)与所加入盐酸的体积之间的关系如图所示的关系。

请回答下列问题:
(1)甲溶液中的溶质是____ ,其物质的量的比值是____ 。
(2)乙溶液中的溶质是____ ,其物质的量的比值是____ 。

请回答下列问题:
(1)甲溶液中的溶质是
(2)乙溶液中的溶质是
您最近一年使用:0次
5 . (1)6.4gM和17.0gN恰好完全反应,生成0.4molX和12.2gY,则X的摩尔质量为:___ 。
(2)实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
①至少需要质量分数为90.0%的锌粒多少克?___
②生成的氯化锌的物质的量是多少?___
(2)实验室需要制备22.4L(标准状况)H2,现用质量分数为90.0%的锌粒与足量的稀盐酸反应(假设杂质不与稀盐酸反应),问:(要求写出计算过程)
①至少需要质量分数为90.0%的锌粒多少克?
②生成的氯化锌的物质的量是多少?
您最近一年使用:0次
名校
解题方法
6 . (1)已知①H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
②CH4 (g)+ O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:___ 。
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=___ kJ·mol-1。
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。

回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为___ (保留两位有效数字)。
②X轴上a点的数值比b点__ (填“大”或“小”);图中,Y轴表示__ (填“温度”或“压强”),判断的理由是__ 。
 O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1②CH4 (g)+
 O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1
O2(g)=CO (g)+2H2O(g) ΔH=-564.3kJ·mol-1则CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:
(2)根据键能数据计算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 ΔH=
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(3)氢气是合成氨反应的重要原料。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟合成氨的工业化生产:N2(g)+3H2(g)
 2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
2NH3(g) △H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示。
回答下列问题:
①平衡时,M点NH3的体积分数为10%,则N2的物质的量为
②X轴上a点的数值比b点
您最近一年使用:0次
10-11高二下·福建漳州·期中
7 . 某有机物在气态时,其密度是相同条件下氢气的38倍,若将它完全燃烧,只生成水蒸气和二氧化碳,且二者的体积比为(同温同压下)4:3,另取该有机化合物3.8g,充分燃烧后将其产物全部通过干燥的碱石灰,碱石灰增重10.2g,再取同质量的该有机物与足量的金属钠反应,可生成标况下的氢气1.12L。
求:(1)该有机物的分子式________ 。
(2)该有机物属于哪一类有机物,写出可能的结构简式________ 。
求:(1)该有机物的分子式
(2)该有机物属于哪一类有机物,写出可能的结构简式
您最近一年使用:0次
名校
8 . 如图所示,一密闭容器被无摩擦、可滑动的两隔板A、B分成甲、乙两室。标准状况下,在乙室充入8.4g N2,甲室充入8.8g H2和O2的混合气体。
(1)甲室中H2与O2的质量比为_____________ ,甲室中原子个数约为 ____________ 个。
(2)维持温度不变,将隔板A固定在“3”处,将隔板B固定在“5”处,此时甲、乙两室中气体的压强比P(甲):P(乙)=______________ 。
(3)用电火花处理甲室中的气体使其充分反应,反应后恢复至标准状况。甲室与乙室此时的体积比为_____ 。
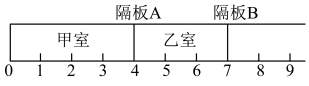
(1)甲室中H2与O2的质量比为
(2)维持温度不变,将隔板A固定在“3”处,将隔板B固定在“5”处,此时甲、乙两室中气体的压强比P(甲):P(乙)=
(3)用电火花处理甲室中的气体使其充分反应,反应后恢复至标准状况。甲室与乙室此时的体积比为
您最近一年使用:0次
2018-12-14更新
|
725次组卷
|
4卷引用:福建省晋江市季延中学2018-2019学年高一上学期期中考试化学试题
名校
解题方法
9 . 按要求回答有关问题:
(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为
COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______ %,反应平衡常数K=________ 。
(2)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为2.0mol·L−1,溶液中的c(OH−)=_________________ mol·L−1。将SO2通入该氨水中,当c(OH−)降至1.0×10−7mol·L−1时,溶液中的c( )/c(
)/c( )=
)=___________________ 。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5mol·L−1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5mol·L−1)时,溶液中c(Ag+)为_______ mol·L−1,此时溶液中c(CrO )等于
)等于__________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为
COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为(2)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。若氨水的浓度为2.0mol·L−1,溶液中的c(OH−)=
 )/c(
)/c( )=
)=(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5mol·L−1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5mol·L−1)时,溶液中c(Ag+)为 )等于
)等于
您最近一年使用:0次
名校
10 . 将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g) 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时SO3的浓度______ ;
(2)该温度下的平衡常数______ ;
(3)平衡时SO2的转化率______ 。
 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:(1)平衡时SO3的浓度
(2)该温度下的平衡常数
(3)平衡时SO2的转化率
您最近一年使用:0次
2017-12-12更新
|
266次组卷
|
3卷引用:2014-2015学年福建省晋江市季延中学高二下学期期中考试化学试卷



