名校
解题方法
1 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:


该反应一般认为通过如下步骤来实现:
反应①

反应②
回答下列问题:
(1)
___________ 
(2)有利于提高 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有___________ (填编号)。
A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大 和
和 的初始投料比
的初始投料比
(3)二氧化碳加氢制甲醇的总反应按 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强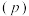 变化如图所示。
变化如图所示。
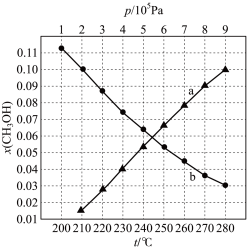
①图中对应在 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是___________ (填“ ”或“
”或“ ”)。判断理由是
”)。判断理由是___________ 。
② 时,反应条件可能为
时,反应条件可能为___________ 或___________ 。
③ 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程___________ 。


该反应一般认为通过如下步骤来实现:
反应①


反应②

回答下列问题:
(1)


(2)有利于提高
 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有A.升高温度 B.降低温度 C.增大压强
D.降低压强 E.使用催化剂 F.增大
 和
和 的初始投料比
的初始投料比(3)二氧化碳加氢制甲醇的总反应按
 投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
投料,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在 下的
下的 随温度
随温度 变化,在
变化,在 下的
下的 随压强
随压强 变化如图所示。
变化如图所示。
①图中对应在
 下的
下的 随温度
随温度 变化的等压过程的曲线是
变化的等压过程的曲线是 ”或“
”或“ ”)。判断理由是
”)。判断理由是②
 时,反应条件可能为
时,反应条件可能为③
 时,计算
时,计算 的平衡转化率,写出计算过程
的平衡转化率,写出计算过程
您最近一年使用:0次
名校
解题方法
2 . 运用氧化还原反应和离子反应知识回答下列问题:
Ⅰ.将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。
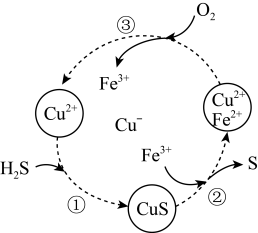
(1)写出过程②和过程中③发生反应的离子方程式:
i.过程②___________ 。
ii.过程③___________ 。
iii.整个转化过程中可以循环使用的离子是___________ 。
Ⅱ.新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温反应得到的。
(2)将纳米材料氧缺位铁酸盐分散在蒸馏水中,所形成的分散系属于___________ 。
(3)MFe2O4中Fe元素的化合价为___________ 。
(4)在酸性条件下,Fe2O 容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O
容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O 、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O
、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O 转化为Fe2+的离子方程式
转化为Fe2+的离子方程式___________ 。
(5)已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O(反应前后H元素化合价未发生变化),请用单线桥法标出电子转移的方向和数目___________ 。
Ⅰ.将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。

(1)写出过程②和过程中③发生反应的离子方程式:
i.过程②
ii.过程③
iii.整个转化过程中可以循环使用的离子是
Ⅱ.新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温反应得到的。
(2)将纳米材料氧缺位铁酸盐分散在蒸馏水中,所形成的分散系属于
(3)MFe2O4中Fe元素的化合价为
(4)在酸性条件下,Fe2O
 容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O
容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O 、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O
、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O 转化为Fe2+的离子方程式
转化为Fe2+的离子方程式(5)已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O(反应前后H元素化合价未发生变化),请用单线桥法标出电子转移的方向和数目
您最近一年使用:0次
名校
3 . 完成下列问题
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为_______ 。
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=_______ ,若温度不变,0.005 mol·L-1的H2SO4溶液中,由水电离出的c(H+)=_______ 。
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=_______ ;此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va:Vb=_______ 。
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为_______ 。
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO )约为
)约为_______ 。
(1)常温下,某溶液由水电离出的c(H+)=10-12 mol·L-1,则该溶液的pH为
(2)某温度下,纯水中c(H+)=5.0×10-7 mol·L-1,则该温度下的KW=
(3)某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=13,请回答下列问题:该温度下水的Kw=
(4)25℃时,将0.1mol·L-1 NaOH溶液与0.06mol·L-1的H2SO4溶液等体积混合,(忽略混合后体积的变化),求所得溶液的pH为
(5)将pH=5的H2SO4稀释1000倍后,c(H+):c(SO
 )约为
)约为
您最近一年使用:0次
2023-03-04更新
|
600次组卷
|
2卷引用:广东省湛江市第二十一中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
4 . 回答下列问题
(1)在25℃,101kpa下,1g甲醇( )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________ 。
(2)已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸气反应的热化学方程式:___________ 。
(3)已知:
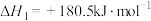

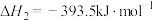
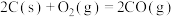
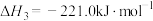
若某反应的平衡常数表达式为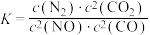 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式___________ 。
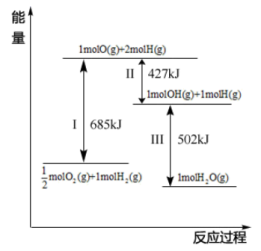
(4)根据图示信息写出热化学方程式:___________ 。
(5)已知:C(s)、CO(g)和 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为

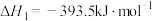


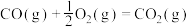
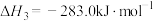
请你根据以上数据,写出C(s)与水蒸气反应生成CO和 的热化学方程式:
的热化学方程式:___________ 。
(1)在25℃,101kpa下,1g甲醇(
 )燃烧生成
)燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(2)已知几种化学键的键能数据如表所示:
| 化学键 | N—H |  | Br—Br | H—Br |
键能/ | 391 | 946 | 194 | 366 |
(3)已知:

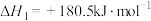

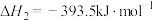
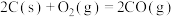
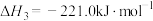
若某反应的平衡常数表达式为
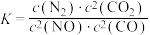 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(4)根据图示信息写出热化学方程式:

(5)已知:C(s)、CO(g)和
 完全燃烧的热化学方程式分别为
完全燃烧的热化学方程式分别为
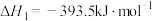


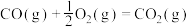
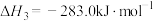
请你根据以上数据,写出C(s)与水蒸气反应生成CO和
 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解题方法
5 . 苯甲酸作为食品如香肠、蕃茄酱、芥末、其他调味剂,和黄油及其许多其他产品的防腐剂被广泛使用。苯甲酸能抑制霉菌、酵母和其他一些细菌的繁殖。苯甲酸对人体无害,其通过代谢为马尿酸被排出体外,因而不会在体内积累。越橘、野生黄莓等含有较多的苯甲酸。当pH低于5时,苯甲酸具有防腐效果。
(1)写出苯甲酸在水中的质子转移反应方程式_______ 。
(2)已知苯甲酸的Ka= 6.31 ×10-5。当苯甲酸的浓度c为0.012 mol·L-1时,计算该溶液的pH=_______ 。
(3)分别确定pH=4.00和pH=6.00的水果汁中苯甲酸离子与苯甲酸浓度的比值_______ 、_______ 。
(4)当pH=_______ 时苯甲酸溶液具有最佳的缓冲能力。
(5)将25 mL、浓度为0.0150 mol·L-1的苯甲酸溶液加到浓度为0.0120 mol·L-1的17 mL氢氧化钠溶液中,计算该混合溶液的pH=_______ 。
(1)写出苯甲酸在水中的质子转移反应方程式
(2)已知苯甲酸的Ka= 6.31 ×10-5。当苯甲酸的浓度c为0.012 mol·L-1时,计算该溶液的pH=
(3)分别确定pH=4.00和pH=6.00的水果汁中苯甲酸离子与苯甲酸浓度的比值
(4)当pH=
(5)将25 mL、浓度为0.0150 mol·L-1的苯甲酸溶液加到浓度为0.0120 mol·L-1的17 mL氢氧化钠溶液中,计算该混合溶液的pH=
您最近一年使用:0次
名校
解题方法
6 . 一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为_____ ,x=____ ;
②若反应经2min达到平衡,平衡时C的浓度____ 0.8 mol·L-1(填“>”、“=”或“<”);
③若平衡混合物中C的体积分数为25%,则A的转化率是_____ ;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件____ (可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数______ 25%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_____ molA气体和_____ molB气
 xC(g)。请填写下列空白:
xC(g)。请填写下列空白:(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为
②若反应经2min达到平衡,平衡时C的浓度
③若平衡混合物中C的体积分数为25%,则A的转化率是
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件
(2)若维持容器压强不变。
①达到平衡时C的体积分数
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入
您最近一年使用:0次
名校
解题方法
7 . 氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。
温度为T1时,在三个容积均为1L的密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
(1)温度为T1时, =
=__ ;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m__ n(填“>”、“<“或“=”)。
(2)若容器Ⅱ中达到平衡时 =1,则NO的转化率为
=1,则NO的转化率为__ 。
(3)容器Ⅲ中起始时v正__ v逆(填“>”、“<”或“=”),理由是__ 。
(4)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是__ ;当 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的__ 。

温度为T1时,在三个容积均为1L的密闭容器中发生反应:2NO(g)+O2(g)
 2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:| 容器编号 | 物质的起始浓度/mol·L−1 | 物质的平衡浓度/mol·L−1 | ||
| c(NO) | c(O2) | c(NO2) | c(O2) | |
| Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
| Ⅱ | 0.5 | x | 0.3 | |
| Ⅲ | 0.3 | 0.25 | 0.2 | |
 =
=(2)若容器Ⅱ中达到平衡时
 =1,则NO的转化率为
=1,则NO的转化率为(3)容器Ⅲ中起始时v正
(4)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随
 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
您最近一年使用:0次
2020-11-09更新
|
318次组卷
|
2卷引用:广东华侨中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
8 . (1)某气态氧化物的化学式为RO2,在标准状况下,1.6g该氧化物的体积为560mL,则R的摩尔质量为_________ 。
(2)已知CO、SO2的混合气体质量共20.8g,标准状况下体积为8.96L,则可推知该混合气体的平均相对分子质量为__________ 。
(3)标准状况下9.03×1023个CH4所占的体积为________ ;与________ 个NH3含有相同数目的氢原子。
(4)与112gN2H4所含有分子数相同的氧气的体积(标准状况)是_________ L。
(5)质量比为85:28的NH3、CO所含质子数之比为_________ 。
(6)配制100ml 1mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g/ml,质量分数为98%)的体积为_____ mL.
(7)某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是_____________ 。
(8)在27g某二价金属的氯化物中含有0.4mol,此氯化物的摩尔质量为_____ 。
(2)已知CO、SO2的混合气体质量共20.8g,标准状况下体积为8.96L,则可推知该混合气体的平均相对分子质量为
(3)标准状况下9.03×1023个CH4所占的体积为
(4)与112gN2H4所含有分子数相同的氧气的体积(标准状况)是
(5)质量比为85:28的NH3、CO所含质子数之比为
(6)配制100ml 1mol/L的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g/ml,质量分数为98%)的体积为
(7)某常见气体在标准状况下的密度为1.25g/L,若该气体的分子式为A2型,则其名称是
(8)在27g某二价金属的氯化物中含有0.4mol,此氯化物的摩尔质量为
您最近一年使用:0次
11-12高三上·湖北襄阳·期中
名校
解题方法
9 . 取等物质的量浓度的 溶液两份A和B,每份10mL,分别向A、B中通入不等量的
溶液两份A和B,每份10mL,分别向A、B中通入不等量的 ,再继续向两溶液中逐滴加入
,再继续向两溶液中逐滴加入 的盐酸,标准状况下产生的
的盐酸,标准状况下产生的 气体体积与所加的盐酸溶液体积之的关系如下图所示,试回答下列问题:
气体体积与所加的盐酸溶液体积之的关系如下图所示,试回答下列问题:
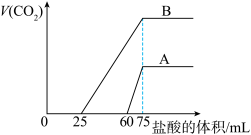
(1)原 溶液的物质的量浓度为
溶液的物质的量浓度为________ 
(2)曲线A表明,原 溶液中通入
溶液中通入 后,所得溶液中的溶质为(写化学式)
后,所得溶液中的溶质为(写化学式)________ ;其物质的量之比为________ ;
(3)曲线B表明,原 溶液中通入
溶液中通入 后,所得溶液加盐酸后产生
后,所得溶液加盐酸后产生 气体体积(标准状况)的最大值为
气体体积(标准状况)的最大值为________ mL。
 溶液两份A和B,每份10mL,分别向A、B中通入不等量的
溶液两份A和B,每份10mL,分别向A、B中通入不等量的 ,再继续向两溶液中逐滴加入
,再继续向两溶液中逐滴加入 的盐酸,标准状况下产生的
的盐酸,标准状况下产生的 气体体积与所加的盐酸溶液体积之的关系如下图所示,试回答下列问题:
气体体积与所加的盐酸溶液体积之的关系如下图所示,试回答下列问题:
(1)原
 溶液的物质的量浓度为
溶液的物质的量浓度为
(2)曲线A表明,原
 溶液中通入
溶液中通入 后,所得溶液中的溶质为(写化学式)
后,所得溶液中的溶质为(写化学式)(3)曲线B表明,原
 溶液中通入
溶液中通入 后,所得溶液加盐酸后产生
后,所得溶液加盐酸后产生 气体体积(标准状况)的最大值为
气体体积(标准状况)的最大值为
您最近一年使用:0次
2020-02-27更新
|
399次组卷
|
10卷引用:2015-2016学年广东省汕头金山中学高一上期末化学试卷
2015-2016学年广东省汕头金山中学高一上期末化学试卷(已下线)2012届湖北省襄阳市四校高三上学期期中联考化学试卷2016届山东省乳山市第一中学高三上学期10月月考化学试卷2016-2017学年江西省南昌二中高一上第二次考试化学卷黑龙江省齐齐哈尔市第八中学2019届高三9月月考化学试题湖北省武汉市汉阳一中2018-2019学年高一上学期12月月考化学试题江西省新余市分宜中学2020届高三上学期第一次段考化学试题(已下线)【新东方】2020-44(已下线)专题3.1 金属钠及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》天津市耀华中学2021-2022学年高一上学期期中考试化学试题
解题方法
10 . 将5.1g镁铝合金溶于600mL0.5mol·L-1H2SO4溶液中,完全溶解后再加入1.0mol·L-1的NaOH溶液,得到沉淀的质量为13.6g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入__ mLNaOH溶液时,可使溶解在硫酸中的Mg 和Al
和Al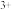 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)___
(1)当加入
 和Al
和Al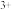 恰好完全沉淀。
恰好完全沉淀。(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
您最近一年使用:0次



