名校
1 . 完成下列问题。
(1)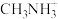 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角___________ (填“大”或“小”)。
(2)正硝酸钠( )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。
① 阴离子的空间构型为
阴离子的空间构型为___________ ,其中心原子杂化方式为___________ 。
②写出一种与 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子___________ (填化学式)。
(3)①一个Cu2O晶胞(见图)中,Cu原子的数目为___________ 。
②Cu2O晶胞参数为anm,摩尔质量为M,求Cu2O的密度___________ g/cm3(只列出计算表达式)
(1)
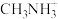 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角(2)正硝酸钠(
 )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。①
 阴离子的空间构型为
阴离子的空间构型为②写出一种与
 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子(3)①一个Cu2O晶胞(见图)中,Cu原子的数目为
②Cu2O晶胞参数为anm,摩尔质量为M,求Cu2O的密度
您最近一年使用:0次
名校
2 . 按要求回答下列各题:
(1)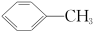 的一溴代物有
的一溴代物有___________ 种。
(2)茅苍术醇(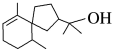 )的分子式为
)的分子式为_________ ,所含官能团名称为_________ 。
(3)用系统命名法命名物质 :
:___________ ;
(4)环癸五烯分子结构可表示为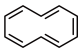 。环癸五烯具有的性质有
。环癸五烯具有的性质有___________ 。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(5)写出 的一种同分异构体的结构简式:
的一种同分异构体的结构简式:___________ 。
(6)某物质只含 、
、 、
、 三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)___________ 。
②下列物质中,与该物质互为同分异构体的是___________ (填字母)。
A. B.
B.
C.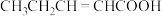 D.
D.
③该分子中共平面的原子个数最多为___________ 个(已知羧基的四个原子可以共平面)。
④该物质与 反应的化学方程式为
反应的化学方程式为___________ 。
(1)
 的一溴代物有
的一溴代物有(2)茅苍术醇(
 )的分子式为
)的分子式为(3)用系统命名法命名物质
 :
:(4)环癸五烯分子结构可表示为
 。环癸五烯具有的性质有
。环癸五烯具有的性质有a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(5)写出
 的一种同分异构体的结构简式:
的一种同分异构体的结构简式:(6)某物质只含
 、
、 、
、 三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)
②下列物质中,与该物质互为同分异构体的是
A.
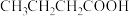 B.
B.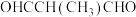
C.
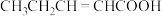 D.
D.
③该分子中共平面的原子个数最多为
④该物质与
 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
名校
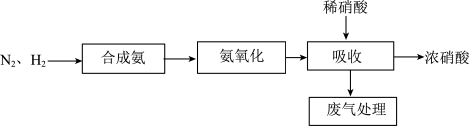
3 . 下图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。 分子的结构式为
分子的结构式为_______________ 。
(2)吸收装置中,发生的反应为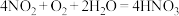 ,若用
,若用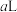
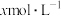 的稀硝酸作为吸收液,反应后得到
的稀硝酸作为吸收液,反应后得到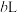
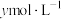 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为_______  。
。
(3)实验室常用 溶液吸收
溶液吸收 (
( 和
和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: ;
; (已知
(已知 不能与
不能与 溶液反应,不考虑
溶液反应,不考虑 与
与 的转化)。
的转化)。
①若 能被
能被 溶液完全吸收,则
溶液完全吸收,则 的取值范围为
的取值范围为_______________ 。
②若
 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为_________  (标准状况下)。
(标准状况下)。
(4) 催化还原氯氧化物技术(
催化还原氯氧化物技术( )是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的
)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为_______________ 。
 分子的结构式为
分子的结构式为(2)吸收装置中,发生的反应为
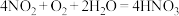 ,若用
,若用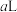
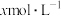 的稀硝酸作为吸收液,反应后得到
的稀硝酸作为吸收液,反应后得到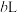
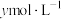 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为 。
。(3)实验室常用
 溶液吸收
溶液吸收 (
( 和
和 的混合气体),反应的化学方程式如下:
的混合气体),反应的化学方程式如下: ;
; (已知
(已知 不能与
不能与 溶液反应,不考虑
溶液反应,不考虑 与
与 的转化)。
的转化)。①若
 能被
能被 溶液完全吸收,则
溶液完全吸收,则 的取值范围为
的取值范围为②若

 恰好完全反应,则被吸收的
恰好完全反应,则被吸收的 的体积为
的体积为 (标准状况下)。
(标准状况下)。(4)
 催化还原氯氧化物技术(
催化还原氯氧化物技术( )是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的
)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示。若催化剂表面参与反应的 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为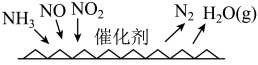
您最近一年使用:0次
4 . 以软锰矿浆(含 及少量
及少量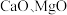 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿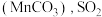 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 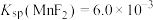 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入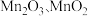 等,其原因是
等,其原因是_______ 。
 及少量
及少量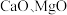 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是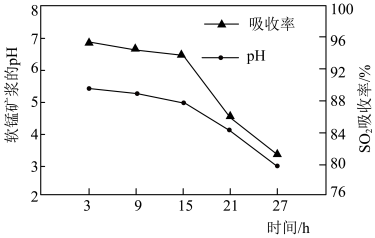
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 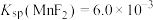 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为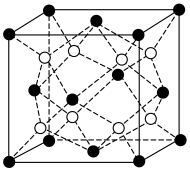
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入 等,其原因是
等,其原因是
您最近一年使用:0次
2024-05-25更新
|
313次组卷
|
2卷引用:福建省泉州中远学校2024届高三下学期5月模拟化学试题
5 . 酚酞是常见酸碱指示剂,某学习小组用苯酚等原料制取酚酞并探究变色原理,制取酚酞的合成路线如下图:
(1)A的名称为________ ,酚酞中含有官能团的名称为________ 。
(2)条件I可用的试剂为________ 。
(3)熔点:
________  (选填“>”“<”或“=”)
(选填“>”“<”或“=”)
(4)B→C的化学方程式为________ ,反应类型为________ 。
(5)写出符合下列条件的B的同分异构体的结构简式:________ (任写一种)。
①遇 溶液显紫色 ②能发生银镜反应 ③核磁共振氢谱有4组峰
溶液显紫色 ②能发生银镜反应 ③核磁共振氢谱有4组峰
(6)C→酚酞的反应机理: 的原因为
的原因为________ ,F中带正电荷碳原子的杂化轨道类型为________ 。
(7)酚酞在一定pH溶液中生成阴离子 ,该离子的结构简式为
,该离子的结构简式为________ 。

(1)A的名称为
(2)条件I可用的试剂为
(3)熔点:

 (选填“>”“<”或“=”)
(选填“>”“<”或“=”)(4)B→C的化学方程式为
(5)写出符合下列条件的B的同分异构体的结构简式:
①遇
 溶液显紫色 ②能发生银镜反应 ③核磁共振氢谱有4组峰
溶液显紫色 ②能发生银镜反应 ③核磁共振氢谱有4组峰(6)C→酚酞的反应机理:
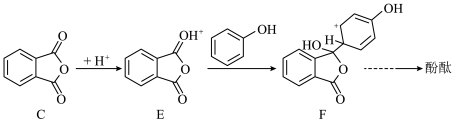
 的原因为
的原因为(7)酚酞在一定pH溶液中生成阴离子
 ,该离子的结构简式为
,该离子的结构简式为
您最近一年使用:0次
名校
解题方法
6 .  在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
(2)写出生成 的化学方程式为
的化学方程式为___________ ,该反应类型为___________ 。
(3) 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、 )反应,包括以下几步:
)反应,包括以下几步:
Ⅰ.链引发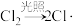
Ⅱ.链传递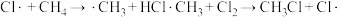 …
…
Ⅲ.链终止 …
…
①写出由 生成
生成 过程中链传递的方程式:
过程中链传递的方程式: 、
、___________ 。
②已知:25℃、101kPa时, 中
中 键和HCl中
键和HCl中 键的键能分别是4439 kJ⋅mol-1和431 kJ⋅mol-1。则反应
键的键能分别是4439 kJ⋅mol-1和431 kJ⋅mol-1。则反应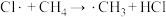 完全反应
完全反应___________ (填“放出”或“吸收”)热量。
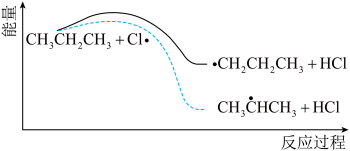
(4)丙烷氯代反应中链传递的一步反应能量变化如图。 中
中 键能比
键能比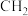 中
中 键能
键能___________ (填“大”或“小”)。
 在光照条件下与
在光照条件下与 反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
| A.反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生 |
B.将该装置放在黑暗处, 与 与 也能反应 也能反应 |
| C.该实验可得到五种产物 |
D. 和 和 完全反应后试管内液面上升,液体充满试管 完全反应后试管内液面上升,液体充满试管 |
(2)写出生成
 的化学方程式为
的化学方程式为(3)
 氯代的机理为自由基(带有单电子的原子或原子团,如
氯代的机理为自由基(带有单电子的原子或原子团,如 、
、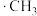 )反应,包括以下几步:
)反应,包括以下几步:Ⅰ.链引发
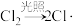
Ⅱ.链传递
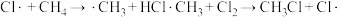 …
…Ⅲ.链终止
 …
…①写出由
 生成
生成 过程中链传递的方程式:
过程中链传递的方程式: 、
、②已知:25℃、101kPa时,
 中
中 键和HCl中
键和HCl中 键的键能分别是4439 kJ⋅mol-1和431 kJ⋅mol-1。则反应
键的键能分别是4439 kJ⋅mol-1和431 kJ⋅mol-1。则反应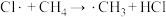 完全反应
完全反应(4)丙烷氯代反应中链传递的一步反应能量变化如图。
 中
中 键能比
键能比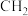 中
中 键能
键能
您最近一年使用:0次
名校
7 . 铜及其化合物在生产生活有广泛应用,铜在化合物中的常见化合价有+1、+2.已知 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
(1)工业上可用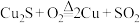 反应制取粗铜,该反应中
反应制取粗铜,该反应中___________ 元素被还原。不考虑杂质的反应,理论上生成1mol的 电子转移的数目为
电子转移的数目为___________
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为___________ 。温度控制在50~60℃的原因除了加快反应速率外,还有___________ 。在 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:___________ 。
(3)现向Cu、 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为___________ 。若将上述混合物用足量的 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为___________ g。若上述混合物中含0.2mol Cu,将该混合物与稀硫酸充分反应,消耗 的物质的量为
的物质的量为___________ mol。
 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。(1)工业上可用
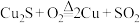 反应制取粗铜,该反应中
反应制取粗铜,该反应中 电子转移的数目为
电子转移的数目为(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入
 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:(3)现向Cu、
 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为 的物质的量为
的物质的量为
您最近一年使用:0次
名校
8 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。
(2) 易溶于水,标准状况下,用充满
易溶于水,标准状况下,用充满 的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为___________  。
。
(3)氨气燃烧的化学方程式为___________ 。
(4) 是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的
是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的___________ 性。
(5)“吸收塔”尾部会有含NO、 等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。
纯碱溶液与 反应的原理为
反应的原理为
___________ 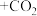 (请填写完成化学方程式,已配平)。
(请填写完成化学方程式,已配平)。
②氨转化法。
已知7mol氨恰好能将含NO和 共6mol的混合气体完全转化为
共6mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为___________ ,若用通式 表示氮氧化物,则每摩尔氨可将
表示氮氧化物,则每摩尔氨可将___________ mol的 转化为
转化为 。
。
(6)工业上可采用碱液吸收和氨还原处理含 尾气,其中用碱液吸收的化学方程式为
尾气,其中用碱液吸收的化学方程式为 ,
, 。根据上述原理,下列气体中被过量NaOH溶液吸收后有气体剩余的是___________。
。根据上述原理,下列气体中被过量NaOH溶液吸收后有气体剩余的是___________。
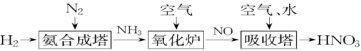
 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。A.工业合成 需要在高温、高压、催化剂下进行 需要在高温、高压、催化剂下进行 |
B. 可用来生产碳铵和尿素等化肥 可用来生产碳铵和尿素等化肥 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 |
D. 受热易分解,须置于冷暗处保存 受热易分解,须置于冷暗处保存 |
 易溶于水,标准状况下,用充满
易溶于水,标准状况下,用充满 的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为 。
。(3)氨气燃烧的化学方程式为
(4)
 是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的
是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的(5)“吸收塔”尾部会有含NO、
 等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:①纯碱溶液吸收法。
纯碱溶液与
 反应的原理为
反应的原理为
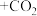 (请填写完成化学方程式,已配平)。
(请填写完成化学方程式,已配平)。②氨转化法。
已知7mol氨恰好能将含NO和
 共6mol的混合气体完全转化为
共6mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为 表示氮氧化物,则每摩尔氨可将
表示氮氧化物,则每摩尔氨可将 转化为
转化为 。
。(6)工业上可采用碱液吸收和氨还原处理含
 尾气,其中用碱液吸收的化学方程式为
尾气,其中用碱液吸收的化学方程式为 ,
, 。根据上述原理,下列气体中被过量NaOH溶液吸收后有气体剩余的是___________。
。根据上述原理,下列气体中被过量NaOH溶液吸收后有气体剩余的是___________。A.1mol  和4mol 和4mol  | B.1mol NO和4mol  |
C.1mol  和7mol NO 和7mol NO | D.4mol NO和4mol  |
您最近一年使用:0次
名校
9 . 按要求填空:
(1)用系统命名法命名: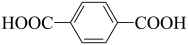 的苯环上的碳原子的杂化方式为
的苯环上的碳原子的杂化方式为___________ ,羧基上碳原子的杂化方式为___________ ,最多有___________ 个原子共平面。
(3)正硝酸钠( )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。
① 阴离子的空间构型为
阴离子的空间构型为___________ ,其中心原子杂化方式为___________ 。
②写出一种与 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子___________ (填化学式)。
(4) 的电子式为
的电子式为___________ ; 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角_________ (填“大”或“小”),理由是_____________ 。
(5)若硝酸的结构表示为 ,已知硝酸与水分子可形成一水合二硝酸结晶水合物(
,已知硝酸与水分子可形成一水合二硝酸结晶水合物(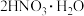 ),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式
),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______ (氢键用“…”表示)。
(6)已知NaCl和MgO的晶体结构相似,熔点较高的是____________________ (填化学式),原因是______________________ 。
(1)用系统命名法命名:
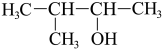

 的苯环上的碳原子的杂化方式为
的苯环上的碳原子的杂化方式为(3)正硝酸钠(
 )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。①
 阴离子的空间构型为
阴离子的空间构型为②写出一种与
 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子(4)
 的电子式为
的电子式为 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角(5)若硝酸的结构表示为
 ,已知硝酸与水分子可形成一水合二硝酸结晶水合物(
,已知硝酸与水分子可形成一水合二硝酸结晶水合物(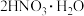 ),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式
),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式(6)已知NaCl和MgO的晶体结构相似,熔点较高的是
您最近一年使用:0次
名校
解题方法
10 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题。

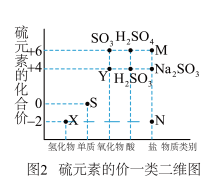
(1)图1中与图2中M、N对应的物质分别是___________ 、___________ 。(各写一个)
(2)写出物质X的电子式___________ 。
(3)SO2的排放是造成酸雨的主要因素,同时SO2在生活中也有多种用途。请回答下列问题:
①从环境保护的角度看,人们通常把pH<5.6的降水称为酸雨。已知pH=-lgc(H+)。经测定某次雨水中只含硫酸。且浓度为5×10-5mol/L,这次降雨___________ (填“是”或“不是”)酸雨。
②石灰石——石膏(CaSO4·2H2O)法是处理含SO2烟气脱硫的常见方法,该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂与烟气充分混合并接触氧化。最终生成石膏。写出该过程发生反应的化学方程式___________ 。
③在酸酒时人工添加SO2有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理___________ 。
④发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总SO2小于250mg/L,若在室温下。每升溶液中最多通入___________ mLSO2.(室温下Vm=24L/mol)
(4)向BaCl2溶液中通入SO2至饱和,此过程看不到现象,再向溶液中加入一种物质。溶液变浑浊。加入的这种物质不可能是___________。


(1)图1中与图2中M、N对应的物质分别是
(2)写出物质X的电子式
(3)SO2的排放是造成酸雨的主要因素,同时SO2在生活中也有多种用途。请回答下列问题:
①从环境保护的角度看,人们通常把pH<5.6的降水称为酸雨。已知pH=-lgc(H+)。经测定某次雨水中只含硫酸。且浓度为5×10-5mol/L,这次降雨
②石灰石——石膏(CaSO4·2H2O)法是处理含SO2烟气脱硫的常见方法,该工艺原理是,将石灰石粉末加水制成浆液作为吸收剂与烟气充分混合并接触氧化。最终生成石膏。写出该过程发生反应的化学方程式
③在酸酒时人工添加SO2有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理
④发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总SO2小于250mg/L,若在室温下。每升溶液中最多通入
(4)向BaCl2溶液中通入SO2至饱和,此过程看不到现象,再向溶液中加入一种物质。溶液变浑浊。加入的这种物质不可能是___________。
| A.Cl2 | B.NH3 | C.CO2 | D.H2S |
您最近一年使用:0次



