名校
解题方法
1 . 完成下列问题:
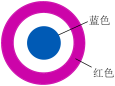
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生___________ 腐蚀,边缘区的电极反应式为___________ 。
(2)区分晶体和非晶体最可靠的方法是___________ 。
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为___________ 。
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是___________ (填“正极”或“负极”),该电池的负极的电极反应式为___________

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为___________ 。
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
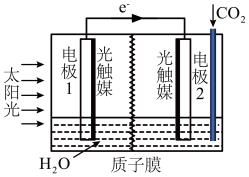
①电极2的电极反应式是___________ 。
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化___________ g。
(学法题)书写电极反应式时应注意哪些问题___________ 。
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生

(2)区分晶体和非晶体最可靠的方法是
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化
(学法题)书写电极反应式时应注意哪些问题
您最近一年使用:0次
名校
解题方法
2 . 现有常温下浓度均为1 mol∙L−1的下列四种溶液:① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④NaOH溶液、⑤
溶液、④NaOH溶液、⑤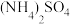 溶液。
溶液。
(1)这5种溶液pH由大到小的顺序是_______ ,其中由水电离的 浓度最小的是
浓度最小的是_______ 。 填序号
填序号
(2)②中各离子浓度由大到小的顺序是_______ , 的水解平衡常数Kh=
的水解平衡常数Kh=_____ 。(已知碳酸的电离常数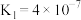 、
、 )
)
(3)向③中通入少量氨气,此时 的值
的值_____  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积_____ ④的体积(填“>” “<” 或“=”)。
(5)一定量的稀 溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是______ (填字母)。
A.加 固体 B.加
固体 B.加 固体 C.加
固体 C.加 溶液
溶液
D.加氨水 E.加 溶液
溶液
(6)常温下,向 溶液中加入
溶液中加入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ ,若将所得悬浊液的pH调整为4,则溶液中 的溶液为
的溶液为______ mol∙L−1 (已知常温下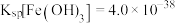 )。
)。
 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④NaOH溶液、⑤
溶液、④NaOH溶液、⑤ 溶液。
溶液。(1)这5种溶液pH由大到小的顺序是
 浓度最小的是
浓度最小的是 填序号
填序号
(2)②中各离子浓度由大到小的顺序是
 的水解平衡常数Kh=
的水解平衡常数Kh=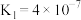 、
、 )
)(3)向③中通入少量氨气,此时
 的值
的值 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积
(5)一定量的稀
 溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是A.加
 固体 B.加
固体 B.加 固体 C.加
固体 C.加 溶液
溶液 D.加氨水 E.加
 溶液
溶液(6)常温下,向
 溶液中加入
溶液中加入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为 的溶液为
的溶液为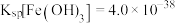 )。
)。
您最近一年使用:0次
解题方法
3 . 现代生活离不开方便实用的化学电源。各种各样的化学电源都是依据原电池的原理制造的。回答下列问题:
(1)锂离子电池具有质量小、体积小、储存和输出能量大等特点。一种锂离子电池负极材料为嵌锂石墨,正极材料为 (钴酸锂),电解质溶液为
(钴酸锂),电解质溶液为 (六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为
(六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为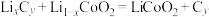 。
。
①放电时,负极反应式为______ 。 由
由______ 极向______ 极迁移(填“正”或“负”)。
②充电时,电池的______ (填“正”或“负”)极应与电源的正极相连,充电时该极的电极反应式为____________ 。
(2)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,DMFC的工作原理如图所示。
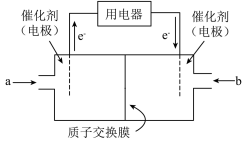
①通入a物质一侧的电极反应式为____________ 。
②通入11.2 L(折算为标准状况下)甲醇蒸气,测得电路中转移1.8 mol电子,则甲醇的利用率为______ 。
(3)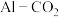 电池工作原理如图所示,利用该电池能有效地将
电池工作原理如图所示,利用该电池能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝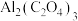 。
。
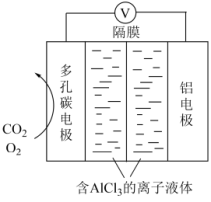
①电池的总反应式为____________ 。
②电池的正极反应式: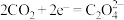 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 是催化剂,催化过程可表示为:
是催化剂,催化过程可表示为:
ⅰ.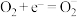 ⅱ.……
ⅱ.……
写出反应ⅱ的离子方程式:____________ 。
(1)锂离子电池具有质量小、体积小、储存和输出能量大等特点。一种锂离子电池负极材料为嵌锂石墨,正极材料为
 (钴酸锂),电解质溶液为
(钴酸锂),电解质溶液为 (六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为
(六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为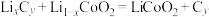 。
。①放电时,负极反应式为
 由
由②充电时,电池的
(2)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,DMFC的工作原理如图所示。

①通入a物质一侧的电极反应式为
②通入11.2 L(折算为标准状况下)甲醇蒸气,测得电路中转移1.8 mol电子,则甲醇的利用率为
(3)
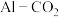 电池工作原理如图所示,利用该电池能有效地将
电池工作原理如图所示,利用该电池能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝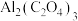 。
。
①电池的总反应式为
②电池的正极反应式:
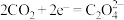 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 是催化剂,催化过程可表示为:
是催化剂,催化过程可表示为:ⅰ.
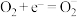 ⅱ.……
ⅱ.……写出反应ⅱ的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 完成下列问题。
(1)已知:①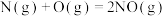

②

则表示氨气燃烧热的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(2)已知几种化学键的键能和热化学方程式如下:

 ,则
,则
___________ 。
(3)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷( )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应 (1)=
(1)=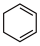 (1)的
(1)的
___________ 。

(4)利用多晶铜高效催化电解 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
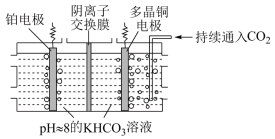
①电解过程中 向
向___________ (填“铂”或“多晶铜”)电极方向移动。
②铂电极产生的气体是___________ 。
③多晶铜电极上的电极反应式为___________ 。
(1)已知:①
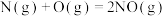

②


则表示氨气燃烧热的热化学方程式为
(2)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能 | a | b | c | x | d |

 ,则
,则
(3)4种不饱和烃分别与氢气发生加成反应生成1mol环己烷(
 )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应 (1)=
(1)= (1)的
(1)的

(4)利用多晶铜高效催化电解
 制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现
制乙烯的原理如图所示。因电解前后电解液浓度几乎不变,故可实现 的连续转化。
的连续转化。
①电解过程中
 向
向②铂电极产生的气体是
③多晶铜电极上的电极反应式为
您最近一年使用:0次
2023-12-09更新
|
180次组卷
|
2卷引用:天津市第一中学2023-2024学年高三上学期第二次月考化学试题
名校
5 . DCCNa(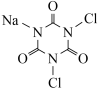 )是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸(
)是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸( )溶液反应制备DCCNa,实验装置如图所示:
)溶液反应制备DCCNa,实验装置如图所示:

已知: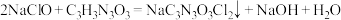
回答下列问题:
(1)仪器a的名称为______ 。
(2)装置A中发生的离子反应方程式为______ 。
(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是______ 。
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,其原因是______ 。
(5)实验过程中B的温度必须保持为7~12℃,pH控制在6.5~8.5的范围。若温度过高,pH过低, 在溶液中会与
在溶液中会与 发生副反应生成
发生副反应生成 和
和 等,写出该副反应的化学方程式:
等,写出该副反应的化学方程式:______ 。
(6)装置C的试剂可选用______ (填标号)。
a. b.NaCl c.
b.NaCl c. d。
d。
(7)反应结束后,装置B中的浊液经过滤、______ 、干燥得DCCNa粗产品。
 )是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸(
)是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸( )溶液反应制备DCCNa,实验装置如图所示:
)溶液反应制备DCCNa,实验装置如图所示:
已知:
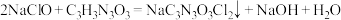
回答下列问题:
(1)仪器a的名称为
(2)装置A中发生的离子反应方程式为
(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,其原因是
(5)实验过程中B的温度必须保持为7~12℃,pH控制在6.5~8.5的范围。若温度过高,pH过低,
 在溶液中会与
在溶液中会与 发生副反应生成
发生副反应生成 和
和 等,写出该副反应的化学方程式:
等,写出该副反应的化学方程式:(6)装置C的试剂可选用
a.
 b.NaCl c.
b.NaCl c. d。
d。
(7)反应结束后,装置B中的浊液经过滤、
您最近一年使用:0次
2023-11-30更新
|
248次组卷
|
2卷引用: 天津市静海区第一中学2023-2024学年高三上学期12月月考化学试题
名校
6 . 化学中,酸的电离平衡常数( )是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
)是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
回答下列问题:
(1)写出CH3COOH的电离方程式:_____ 。
(2)T℃下,CH3COOH的电离平衡常数值为 ,则T
,则T_____ 25℃(填“>”、“<”或“=”)。估算T℃下,0.1mol/LCH3COOH溶液中
_____ 。保持温度不变,将该溶液加水稀释至0.01mol/L,在稀释过程中,
_____ (填“增大”、“减小”或“不变”)。
(3)根据以上数据,写出将少量CO2通入NaClO溶液发生反应的离子方程式:_____ 。
(4)向相同的两个密闭容器中加入0.05g镁条,分别注入2mL2mol/L盐酸、2mL2mol/L醋酸,测得容器内压强随时间变化如图所示。反应为醋酸的曲线是_____ (填字母)。

 )是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
)是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。| 酸 | CH3COOH | H2CO3 | HClO |
 |  | 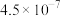 ( ( ) )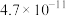 ( ( ) ) |  |
(1)写出CH3COOH的电离方程式:
(2)T℃下,CH3COOH的电离平衡常数值为
 ,则T
,则T

(3)根据以上数据,写出将少量CO2通入NaClO溶液发生反应的离子方程式:
(4)向相同的两个密闭容器中加入0.05g镁条,分别注入2mL2mol/L盐酸、2mL2mol/L醋酸,测得容器内压强随时间变化如图所示。反应为醋酸的曲线是

您最近一年使用:0次
2023-11-26更新
|
132次组卷
|
2卷引用:天津市南开区2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
7 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为_______ 。
(2)NaC1熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: ,加入
,加入 的目的是
的目的是_______ 。
(3) 的电子式为
的电子式为_______ 。在25℃和101kPa时,Na与 反应生成
反应生成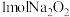 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:_______ 。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过_______ 、_______ (填序号)
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为_______ 。

(6)天然碱的主要成分为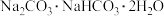 ,
,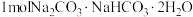 经充分加热得到
经充分加热得到 的质量为
的质量为_______ g。
(7)工业中可利用生产钛白的副产物 和硫铁矿
和硫铁矿 联合制备铁精粉
联合制备铁精粉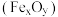 和硫酸,实现能源及资源的有效利用。
和硫酸,实现能源及资源的有效利用。 结构示意图如图。
结构示意图如图。

 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是_______ 、_______ 。
(1)基态Na原子的价层电子轨道表示式为
(2)NaC1熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成
反应生成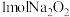 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为

(6)天然碱的主要成分为
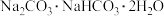 ,
,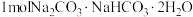 经充分加热得到
经充分加热得到 的质量为
的质量为(7)工业中可利用生产钛白的副产物
 和硫铁矿
和硫铁矿 联合制备铁精粉
联合制备铁精粉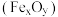 和硫酸,实现能源及资源的有效利用。
和硫酸,实现能源及资源的有效利用。 结构示意图如图。
结构示意图如图。
 中
中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是
您最近一年使用:0次
名校
8 . 有机物种类繁多,结构多样。现有8种不同的物质,请用所学知识回答下列问题:_______ 个碳原子,②的系统命名为_______ 。
(2)③与④互为_______ (填“同分异构体”或“同系物”),③的二氯代物有________ 种。
(3)⑤中官能团的名称____________ ,1mol⑤分别与足量的Na、NaHCO3反应,相同条件下产生气体的体积比为_______ 。
(4) ⑥与足量的
⑥与足量的 溶液反应,最多消耗
溶液反应,最多消耗 的物质的量为
的物质的量为_______  。
。
(5)⑦在浓硫酸催化下发生消去反应得到的有机产物的结构简式可能为_______ 、_______ 。
(6)⑧属于_______ 类,它与新制的 反应的化学方程式为
反应的化学方程式为_______ 。
① 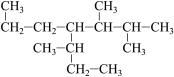 ②
②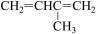
③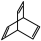 ④
④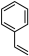 ⑤
⑤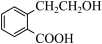
⑥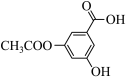 ⑦
⑦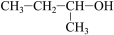
⑧
(2)③与④互为
(3)⑤中官能团的名称
(4)
 ⑥与足量的
⑥与足量的 溶液反应,最多消耗
溶液反应,最多消耗 的物质的量为
的物质的量为 。
。(5)⑦在浓硫酸催化下发生消去反应得到的有机产物的结构简式可能为
(6)⑧属于
 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
9 . 石油产品中含者H2S及COS等多种有机硫化物,石油化工催生出多种脱硫技术,请回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g) S2(g)+2H2(g) ΔH1=+180kJ·mol-1
S2(g)+2H2(g) ΔH1=+180kJ·mol-1
②CH4(g)+S2(g) CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
计算反应③:CH4(g)+2H2S(g) CS2(g)+4H2(g) ΔH3=
CS2(g)+4H2(g) ΔH3=___________ kJ·mol-1
(2)工业生产中应用:COS的水解反应为COS(g) + H2O(g) CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[
CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[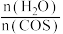 ]的转化关系如图甲所示。
]的转化关系如图甲所示。

① 向起始容器中投入一定量反应物,一定可以判断反应到达平衡状态的是___________ (填字母)。
A.容器中气体密度不变 B.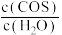 保持不变
保持不变
C.该反应化学平衡常数保持不变 D.υ逆(COS)= υ正(H2S)
② 根据图甲和图乙判断该反应的最佳条件为:投料比[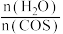 ]
]___________ ;温度___________

③ 当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是___________ ;___________ 。(写出两条)
(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示,则阳极区发生的总反应为___________ 。

(4)可以用K2CO3溶液吸收H2S,其原理:K2CO3+ H2S KHS +KHCO3,该反应的平衡常数为
KHS +KHCO3,该反应的平衡常数为___________ 。( 已知H2CO3的Ka1=4.2×10-7 ,Ka2=5.6×10-11 ;H2S的Ka1=5.6×10-8 ,Ka2=1.2×10-15)
(1)已知下列反应的热化学方程式:
①2H2S(g)
 S2(g)+2H2(g) ΔH1=+180kJ·mol-1
S2(g)+2H2(g) ΔH1=+180kJ·mol-1②CH4(g)+S2(g)
 CS2(g)+2H2(g) ΔH2=+81kJ·mol-1
CS2(g)+2H2(g) ΔH2=+81kJ·mol-1计算反应③:CH4(g)+2H2S(g)
 CS2(g)+4H2(g) ΔH3=
CS2(g)+4H2(g) ΔH3=(2)工业生产中应用:COS的水解反应为COS(g) + H2O(g)
 CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[
CO2 (g)+ H2S(g) ΔH<0。用活性α-Al2O3作催化剂,在恒温恒容密闭容器中COS(g)的平衡转化率随不同投料比[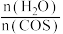 ]的转化关系如图甲所示。
]的转化关系如图甲所示。
① 向起始容器中投入一定量反应物,一定可以判断反应到达平衡状态的是
A.容器中气体密度不变 B.
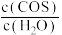 保持不变
保持不变C.该反应化学平衡常数保持不变 D.υ逆(COS)= υ正(H2S)
② 根据图甲和图乙判断该反应的最佳条件为:投料比[
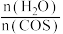 ]
]
③ 当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是
(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示,则阳极区发生的总反应为

(4)可以用K2CO3溶液吸收H2S,其原理:K2CO3+ H2S
 KHS +KHCO3,该反应的平衡常数为
KHS +KHCO3,该反应的平衡常数为
您最近一年使用:0次
10 . 元素周期表中,铍(Be)与铝处于对角线的位置,它们的性质相似。试回答:
(1)Be元素在元素周期表中的位置:___________ ,有关Be性质的推断不正确的是___________ (填序号)。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时, 溶液的
溶液的
(2)已知: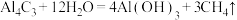 ,写出
,写出 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为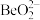 ):
):___________
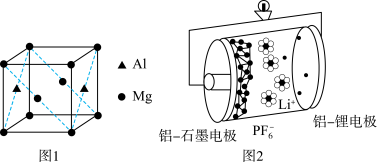
(3)基态铝原子的价电子排布式为___________ ,镁铝合金经过高温淬火获得一种储钠材料,用___________ 法测定其晶胞结构如图1所示,图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___________ ,该立方晶胞的晶胞的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为___________ pm。(列出计算式,可不化简)。
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: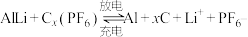 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为___________ ,充电时,应将铝-石墨电极与外接电源的___________ 极相连。
(1)Be元素在元素周期表中的位置:
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,
 溶液的
溶液的
(2)已知:
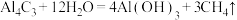 ,写出
,写出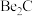 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为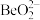 ):
):(3)基态铝原子的价电子排布式为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为:
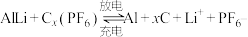 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为
您最近一年使用:0次



