解题方法
1 .  俗称萤石,它的晶胞如图所示,晶胞参数为
俗称萤石,它的晶胞如图所示,晶胞参数为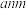 。据此回答下面问题:
。据此回答下面问题: 的晶胞中有
的晶胞中有___________ 个 ,一个
,一个 距离其最近且相等的F有
距离其最近且相等的F有___________ 个,这些F在空间围成几何图形是___________ 。(填“正方体”或“八面体”或“长方体”)
(2)已知金属钙三维空间采用面心立方最密堆积,钙晶体中钙的配位数是___________ 。
(3) 晶体中,
晶体中, 的配位是
的配位是___________ ,钙离子距离最近的钙离子的核间距为___________  ,密度为
,密度为___________  (列式即可)。提示:阿伏伽德罗常数用
(列式即可)。提示:阿伏伽德罗常数用 表示;Ca的相对原子质量为40,F的相对原子质量为19。
表示;Ca的相对原子质量为40,F的相对原子质量为19。
 俗称萤石,它的晶胞如图所示,晶胞参数为
俗称萤石,它的晶胞如图所示,晶胞参数为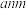 。据此回答下面问题:
。据此回答下面问题:
 的晶胞中有
的晶胞中有 ,一个
,一个 距离其最近且相等的F有
距离其最近且相等的F有(2)已知金属钙三维空间采用面心立方最密堆积,钙晶体中钙的配位数是
(3)
 晶体中,
晶体中, 的配位是
的配位是 ,密度为
,密度为 (列式即可)。提示:阿伏伽德罗常数用
(列式即可)。提示:阿伏伽德罗常数用 表示;Ca的相对原子质量为40,F的相对原子质量为19。
表示;Ca的相对原子质量为40,F的相对原子质量为19。
您最近一年使用:0次
名校
2 . 完成下列填空
(1)氯化铝水溶液呈_______ 性,(填“酸”、“中”、“碱”)原因是:_______ (用离子方程式表示)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______
(2)硫化钠溶于水时发生水解,其水解的离子方程为:_______ ,在配制硫化钠溶液时可以加入少量的_______ 以抑制其水解。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______ (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)_______ c(CH3COO-)(填“>”、“=”或“<”,下同)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈_______ ,溶液中c(Na+)_______ c(CH3COO-)。
(1)氯化铝水溶液呈
(2)硫化钠溶于水时发生水解,其水解的离子方程为:
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈
您最近一年使用:0次
2022-12-27更新
|
117次组卷
|
2卷引用:西藏拉萨中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
3 . A~G是几种烃分子的结构模型(如图),据此回答下列问题:

(1)常温下含氢质量分数最高的气态烃是_______ (填字母)。
(2)写出E失去一个氢原子后所得烃基的结构简式:_______ 。
(3)一卤代物种类最多的是_______ (填字母)。
(4)写出实验室制取D的化学方程式:_______ 。
(5)F具有的性质是_______ (填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
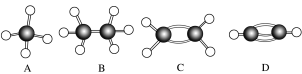
(6)萘也是一种芳香烃,它的分子式是C10H8,请你判断它的结构简式可能是_______ (填字母)。
A. B.
B. C.
C. D.
D.
萘的二氯代物共有_______ 种。


(1)常温下含氢质量分数最高的气态烃是
(2)写出E失去一个氢原子后所得烃基的结构简式:
(3)一卤代物种类最多的是
(4)写出实验室制取D的化学方程式:
(5)F具有的性质是
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(6)萘也是一种芳香烃,它的分子式是C10H8,请你判断它的结构简式可能是
A.
 B.
B. C.
C. D.
D.
萘的二氯代物共有
您最近一年使用:0次
2022-04-10更新
|
429次组卷
|
3卷引用:西藏拉萨中学2021-2022学年高二下学期第六次月考理综化学试题
4 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______ (填元素符号),其中C原子的核外电子排布式为__________ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为______ 和______ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为______ ,中心原子的杂化轨道类型为______ 。
(4)化合物D2A的立体构型为___ ,中心原子的价层电子对数为______ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_________ 。
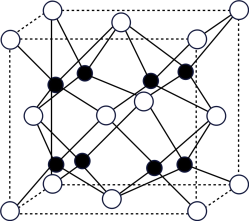
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为______ :晶胞中A原子的配位数为_________ ;列式计算晶体F的密度(g.cm-3)_____ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为

您最近一年使用:0次
2019-01-30更新
|
7108次组卷
|
32卷引用:西藏自治区日喀则市南木林高级中学2019届高三第一次月考理综化学试题
西藏自治区日喀则市南木林高级中学2019届高三第一次月考理综化学试题2015年全国普通高等学校招生统一考试化学(新课标II卷)2016届广东省仲元中学高三11月月考理科综合化学试卷2016届重庆市第一中学高三上12月月考理综化学试卷2016届宁夏六盘山中学高三上第一次模拟理综化学试卷2017届江西省九江市十校高三第二次联考理科综合化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题宁夏六盘山高级中学2017届高三第五次模拟考试理科综合化学试题宁夏石嘴山市第三中学2018届高三9月月考化学试题河北省正定中学2017届高三上学期第三次月考化学试题四川省南充高级中学2018届高三上学期第四次检测理综化学试题山西省临猗县临晋中学2017-2018学年高二下学期期末考试化学试题河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷山西省应县第一中学校2018-2019学年高二下学期期中考试化学试题云南省玉溪一中2020届高三上学期期中考试理综化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题四川省成都市双流棠湖中学2019-2020学年高二下学期第二次月考化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广东省广州市华南师范大学附属中学2020届高三教学质量监测卷理科综合化学试题广东省深圳外国语学校2021届高三上学期11月月考化学试题四川省成都市北大成都附属实验学校2021届高三上学期12月月考理科综合化学试题广东省2021届高三“六校联盟”第三次联考化学试题四川省成都龙泉中学2021届高三下学期4月月考理科综合化学试题吉林省松原市实验高级中学2021届高三5月月考化学试题(已下线)2020年海南卷化学高考真题变式题15-19山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷
真题
名校
5 . 早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______ 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有_______ 个未成对电子,三价铁离子的电子排布式为:_______ 可用硫氰化钾检验。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为_______ ;一摩尔乙醛分子中含有的σ键的数目为:_______ 。乙酸的沸点明显高于乙醛,其主要原因是:_______ 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______ 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_______ 。列式表示铝单质的密度_______ g·cm-3(不必计算出结果)。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)基态铁原子有
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为
您最近一年使用:0次
2019-01-30更新
|
4545次组卷
|
9卷引用:2017届西藏林芝一中高三上学期月考一化学试卷
10-11高二上·湖南·阶段练习
名校
6 . 在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________ 。
(2)该反应为______ 反应(选填吸热、放热)。
升高温度CO2的转化将____________ (填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______ (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______ ℃。
CO2(g)+H2(g)
 CO(g)+H2O(g),
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
升高温度CO2的转化将
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
您最近一年使用:0次
2019-01-30更新
|
1103次组卷
|
41卷引用:西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题
西藏自治区日喀则市南木林高级中学2018-2019学年高二上学期期中考试化学试题(已下线)2010年海南省嘉积中学高二上学期第二次月考化学试卷(已下线)2010—2011学年浙江省海盐元济高级中学高二3月月考化学试卷(已下线)2010-2011学年广东省中山市桂山中学高二下期中考试化学试卷(已下线)2011-2012学年山东省兖州市高二上学期期中考试化学试卷(已下线)2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷(已下线)2011-2012年广东东莞南城中学高二上学期期中考试化学试卷(已下线)2011-2012学年北京市第六十六中学高二上学期补考化学试卷(已下线)2011-2012学年广东始兴县风度中学高二下学期期中考试理综化学试卷(已下线)2011学年浙江省瑞安十校高二第二学期期中联考化学试卷(已下线)2011-2012学年广东省始兴县风度中学高二下学期期末考试理综化学卷(已下线)2011-2012学年陕西师大附中高二年级第一学期期中考试化学试卷(已下线)2013届贵州晴隆民族中学高三上学期期中考试理科综合化学试卷(已下线)2013届辽宁省实验中学分校高三12月月考化学试卷(已下线)2012-2013学年广东东莞第七高级中学高二上期中考试化学试卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷(已下线)2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(已下线)2012-2013学年新疆兵团农二师华山中学高二上学期期末考试化学试卷(已下线)2013-2014学年陕西省岐山县高二上学期期中质量检测理科化学试卷(已下线)2013-2014学年贵州省册亨县民族中学高二上学期期末考试化学试卷(已下线)2014年高二化学人教版选修四 9化学平衡常数练习卷(已下线)2015安徽望江中学同步课时练(人教选修4)2.3.3化学平衡常数试卷2014-2015学年黑龙江省伊春市伊春二中高二上学期期中化学试卷2014-2015学年吉林省松原市扶余县第一中学高一下期末化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(理)化学试卷2016届甘肃省武威二中高三下学期开学考试理综化学试卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2015-2016学年陕西省城固一中高二下学业水平模拟测试化学试卷2016-2017学年河北省秦皇岛北戴河中学高二上月考化学试卷2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷吉林省汪清县第六中学2018届高三9月月考化学试题甘肃省武威市第六中学2017-2018学年高二上学期第一次学段考试化学试题河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第三次月考化学试题江西省临川实验学校2017-2018学年高二上学期期末质量检测化学试题内蒙古阿拉善左旗高级中学2017-2018学年高二上学期期末考试化学试题甘肃省宁县二中2018-2019学年高二上学期期中考试化学试题山西省忻州二中2018-2019学年高二上学期期中考试化学试题新疆维吾尔自治区石河子二中2018-2019学年高二上学期第二次月考化学试题甘肃省靖远四中2018-2019学年高二第二学期开学检测化学试题海南省临高县临高中学2019-2020学年高二上学期期中考试化学试题
7 . 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知在酸性溶液中,NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
(1)上述反应中氧化剂是__________ 。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 , 你认为下列几组合适的是__________ (填选项)。
A.③⑤ B.①②④ C.①②⑤ D.①②
(3)某厂废液中,含有2%——5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是____________ 。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:
( ) Al+( ) NaNO3+( ) NaOH=( ) NaAlO2+( ) N2↑+( ) H2O。
若反应过程中转移1mol e—,则生成标准状况下N2的体积为___________ L。
(1)上述反应中氧化剂是
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 , 你认为下列几组合适的是
A.③⑤ B.①②④ C.①②⑤ D.①②
(3)某厂废液中,含有2%——5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:
若反应过程中转移1mol e—,则生成标准状况下N2的体积为
您最近一年使用:0次
名校
8 . VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为___________________ 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______________ 。
(3)NH3的沸点比PH3高,原因是___________ ;PO43-离子的立体构型为___________ 。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为______________ 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因_____________________ 。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏伽德罗常数的值为NA,则该晶体的密度为__________________ g/cm3(只要求列算式,不必计算)。
(1)砷的基态原子的电子排布式为
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为
(3)NH3的沸点比PH3高,原因是
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏伽德罗常数的值为NA,则该晶体的密度为

您最近一年使用:0次
2019-01-19更新
|
612次组卷
|
2卷引用:【全国百强校】西藏自治区拉萨中学2019届高三上学期第五次月考理科综合化学试题
名校
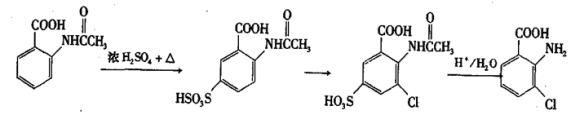
9 . 2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
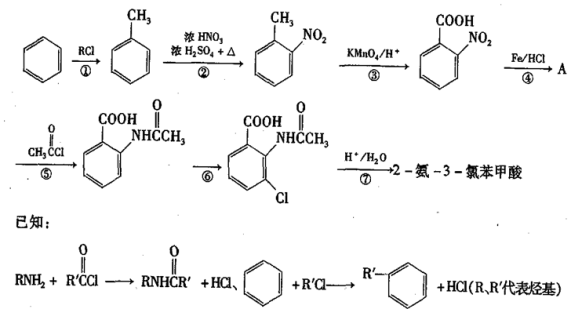
回答下列相关问题
(1)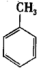 的名称是
的名称是___________ ,2-氨-3-氯苯甲酸中含N官能团的电子式为___________ 。
(2)反应①中R代表的是___________ ,反应②的反应类型为___________ 。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式___________ 。
(4)A的结构简式为___________ ,⑥的反应条件为___________ 。
(5)符合下列条件的同分异构体的结构简式为___________ 。
a 式量比 大42的苯的同系物;
大42的苯的同系物;
b 与酸性KMnO4反应能生成二元羧酸
c 仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
分析产率提高的原因是___________ 。

回答下列相关问题
(1)
 的名称是
的名称是(2)反应①中R代表的是
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式
(4)A的结构简式为
(5)符合下列条件的同分异构体的结构简式为
a 式量比
 大42的苯的同系物;
大42的苯的同系物;b 与酸性KMnO4反应能生成二元羧酸
c 仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。

分析产率提高的原因是
您最近一年使用:0次
2019-01-14更新
|
720次组卷
|
7卷引用:西藏自治区拉萨中学2020届高三上学期第四次月考理综化学试题
10 . 碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________ ,据此推测,锡的常见正价是__________ 。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________ ;P、S的第一电离能(I1)的大小为I1(P) __________ I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________ ;乙烯分子中σ键与π键数目之比为__________ 。
(4)NH3的沸点__________ (填“高于”或“低于”)PH3的沸点,原因是____________________ 。
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________ 的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________ nm(用含NA的代数式表示)。

(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(3)CO32-中C原子的杂化轨道类型为
(4)NH3的沸点
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次



