1 . 聚氨酯是一种高分子材料,其主要特征是分子链中含有多个重复的“氨基甲酸酯”基团 .一种合成聚氨酯viii的合成路线如图所示:
.一种合成聚氨酯viii的合成路线如图所示:
(1)反应②的反应类型为______________ ;化合物iii中所含官能团名称为________________ 。
(2)反应④中生成副产物的小分子为_______________ (填化学式)。
(3)化合物iv的分子式为_____________ ;化合物x为iv的同分异构体,且能与钠反应,核磁共振氢谱中有3组峰,峰面积之比为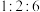 ,x的结构简式为
,x的结构简式为__________________ 。
(4)反应⑥的化学方程式为_______________ 。
(5)不含碳碳双键的化合物ii的同分异构体有_____________ 种(不考虑立体异构)。
(6)参考上述合成路线,无机试剂任选,以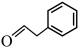 和
和 为含碳原料制备
为含碳原料制备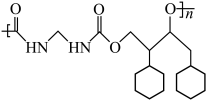 的合成路线为
的合成路线为__________________ 。
 .一种合成聚氨酯viii的合成路线如图所示:
.一种合成聚氨酯viii的合成路线如图所示: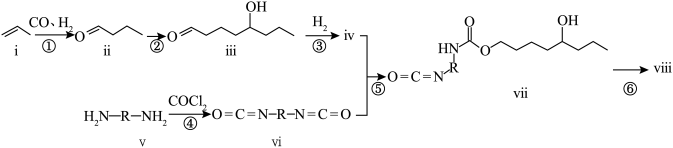
(1)反应②的反应类型为
(2)反应④中生成副产物的小分子为
(3)化合物iv的分子式为
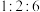 ,x的结构简式为
,x的结构简式为(4)反应⑥的化学方程式为
(5)不含碳碳双键的化合物ii的同分异构体有
(6)参考上述合成路线,无机试剂任选,以
 和
和 为含碳原料制备
为含碳原料制备 的合成路线为
的合成路线为
您最近一年使用:0次
2 .  俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备
俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备 并测定摩尔盐中
并测定摩尔盐中 的含量。已知:
的含量。已知:
三种盐的溶解度(单位为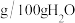 )
)
回答下列问题:
(1)制备硫酸亚铁(装置如图所示):称取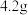 洗净的铁粉(含
洗净的铁粉(含 质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入
质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入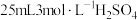 溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入
溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入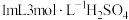 溶液,趁热过滤得
溶液,趁热过滤得 溶液。
溶液。______________________ ;装置b中所盛试剂的作用是______________________ 。
②若不及时向锥形瓶中补加水,导致硫酸浓度过大,可能造成的不良后果为______________________ 。
(2)在 的条件下,称取
的条件下,称取 晶体
晶体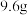 ,将其溶于
,将其溶于___________________  (结果保留一位小数,此温度下的水的密度近似为
(结果保留一位小数,此温度下的水的密度近似为 )水中,配成饱和溶液。
)水中,配成饱和溶液。
(3)将(2)中所配的 饱和溶液加入(1)所得
饱和溶液加入(1)所得 溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到
溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到 晶体,抽滤、洗涤得产品.洗涤的具体操作为
晶体,抽滤、洗涤得产品.洗涤的具体操作为_____________ 。
(4)测定产品中 的含量:称取
的含量:称取 产品,溶于水配成溶液并加入稀硫酸,用
产品,溶于水配成溶液并加入稀硫酸,用 的
的 标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗
标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗 标准溶液的体积为
标准溶液的体积为 。
。
①滴定反应的离子方程式为___________________ 。
②产品中 的质量分数为
的质量分数为____________________ 。
③若滴定终点时俯视读数,会使测定结果_____________ (填“偏低”或“偏高”)。
 俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备
俗称摩尔盐,是一种蓝绿色的无机复盐,不溶于酒精。在实验室以铁粉、稀硫酸、硫酸铵为原料制备 并测定摩尔盐中
并测定摩尔盐中 的含量。已知:
的含量。已知:三种盐的溶解度(单位为
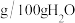 )
)温度/℃ |
|
|
|
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78 | 28.1 |
(1)制备硫酸亚铁(装置如图所示):称取
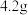 洗净的铁粉(含
洗净的铁粉(含 质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入
质量分数为2.3%)加入锥形瓶中。向锥形瓶中加入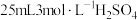 溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入
溶液,开始反应,加热,振荡,反应过程中适当补充水,防止硫酸浓度变大。然后再向锥形瓶中加入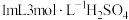 溶液,趁热过滤得
溶液,趁热过滤得 溶液。
溶液。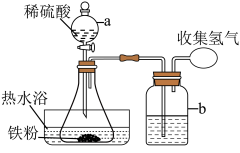
②若不及时向锥形瓶中补加水,导致硫酸浓度过大,可能造成的不良后果为
(2)在
 的条件下,称取
的条件下,称取 晶体
晶体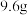 ,将其溶于
,将其溶于 (结果保留一位小数,此温度下的水的密度近似为
(结果保留一位小数,此温度下的水的密度近似为 )水中,配成饱和溶液。
)水中,配成饱和溶液。(3)将(2)中所配的
 饱和溶液加入(1)所得
饱和溶液加入(1)所得 溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到
溶液中,搅拌,小火加热,在蒸发皿中蒸发浓缩得到 晶体,抽滤、洗涤得产品.洗涤的具体操作为
晶体,抽滤、洗涤得产品.洗涤的具体操作为(4)测定产品中
 的含量:称取
的含量:称取 产品,溶于水配成溶液并加入稀硫酸,用
产品,溶于水配成溶液并加入稀硫酸,用 的
的 标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗
标准溶液进行滴定(杂质不参加反应),达到滴定终点时,消耗 标准溶液的体积为
标准溶液的体积为 。
。①滴定反应的离子方程式为
②产品中
 的质量分数为
的质量分数为③若滴定终点时俯视读数,会使测定结果
您最近一年使用:0次
3 . 硅酸盐锆矿的主要成分为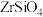 ,还含有
,还含有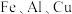 的氧化物,以该矿石为原料生产
的氧化物,以该矿石为原料生产 的工艺流程如图所示:
的工艺流程如图所示: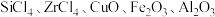 。
。
回答下列问题:
(1)“加热转化”时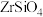 发生反应的化学方程式为
发生反应的化学方程式为__________________ 。
(2) 易水解可生成硅酸,
易水解可生成硅酸,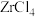 溶于水,试剂X为
溶于水,试剂X为_____________ 。
(3)常温下, ,测得“除铜”后溶液中
,测得“除铜”后溶液中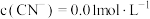 ,通过计算判断溶液中
,通过计算判断溶液中 是否除尽:
是否除尽:__________________ (写出计算过程,溶液中离子浓度低于 即可认为该离子已被除尽)。
即可认为该离子已被除尽)。
(4) 难溶于有机溶剂;
难溶于有机溶剂;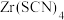 易溶于有机溶剂
易溶于有机溶剂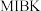 (密度小于水),微溶于水。若可选试剂为
(密度小于水),微溶于水。若可选试剂为 和有机溶剂
和有机溶剂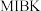 ,则从除铜后的溶液中“除铁”的具体操作为
,则从除铜后的溶液中“除铁”的具体操作为_______________ ,再用硫酸将含有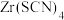 的有机层反萃取,得到含
的有机层反萃取,得到含 的溶液进入下一步流程(补全操作)。
的溶液进入下一步流程(补全操作)。
(5)常温下, ,“沉锆”后
,“沉锆”后 的溶液中,
的溶液中,
__________ 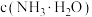 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
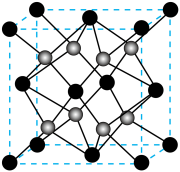
(6) 的立方晶胞结构如图所示,
的立方晶胞结构如图所示, 是阿伏加德罗常数的值,晶胞参数为
是阿伏加德罗常数的值,晶胞参数为 。
。__________________ 。
②与O配位的 围成的立体结构为
围成的立体结构为__________________ 。
③该晶体密度为_____________  (用含a、
(用含a、 的代数式表示,不用化简)。
的代数式表示,不用化简)。
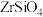 ,还含有
,还含有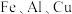 的氧化物,以该矿石为原料生产
的氧化物,以该矿石为原料生产 的工艺流程如图所示:
的工艺流程如图所示: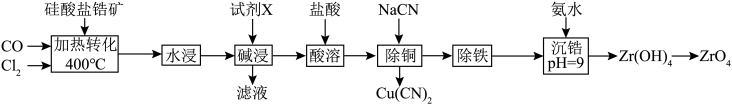
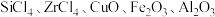 。
。回答下列问题:
(1)“加热转化”时
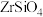 发生反应的化学方程式为
发生反应的化学方程式为(2)
 易水解可生成硅酸,
易水解可生成硅酸,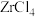 溶于水,试剂X为
溶于水,试剂X为(3)常温下,
 ,测得“除铜”后溶液中
,测得“除铜”后溶液中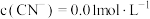 ,通过计算判断溶液中
,通过计算判断溶液中 是否除尽:
是否除尽: 即可认为该离子已被除尽)。
即可认为该离子已被除尽)。(4)
 难溶于有机溶剂;
难溶于有机溶剂;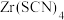 易溶于有机溶剂
易溶于有机溶剂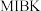 (密度小于水),微溶于水。若可选试剂为
(密度小于水),微溶于水。若可选试剂为 和有机溶剂
和有机溶剂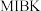 ,则从除铜后的溶液中“除铁”的具体操作为
,则从除铜后的溶液中“除铁”的具体操作为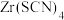 的有机层反萃取,得到含
的有机层反萃取,得到含 的溶液进入下一步流程(补全操作)。
的溶液进入下一步流程(补全操作)。(5)常温下,
 ,“沉锆”后
,“沉锆”后 的溶液中,
的溶液中,
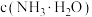 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(6)
 的立方晶胞结构如图所示,
的立方晶胞结构如图所示, 是阿伏加德罗常数的值,晶胞参数为
是阿伏加德罗常数的值,晶胞参数为 。
。
②与O配位的
 围成的立体结构为
围成的立体结构为③该晶体密度为
 (用含a、
(用含a、 的代数式表示,不用化简)。
的代数式表示,不用化简)。
您最近一年使用:0次
解题方法
4 . 氨和氨水能与多种金属离子形成配合物,且在生产和生活中都发挥着重要作用。回答下列问题:
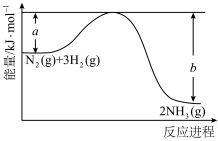
(1)合成氨反应的能量变化示意图如图所示,该反应的热化学方程式为_____ 。 显粉红色,
显粉红色, 显橙黄色,
显橙黄色, 显土黄色。
显土黄色。
①基态 的
的 电子轨道表示式为
电子轨道表示式为_____________ 。
②酸性条件下, 和
和 可与
可与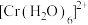 反应,补充完整反应的离子方程式:
反应,补充完整反应的离子方程式:
Ⅰ.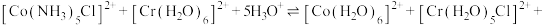
_____________ ;
Ⅱ.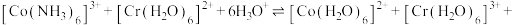
_____________ 。
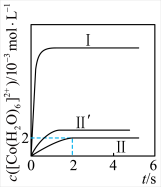
(3)某温度下,对(2)中的反应进行了研究。速率方程为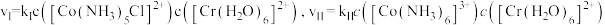 ;保持其他条件不变,分别用浓度相同的
;保持其他条件不变,分别用浓度相同的 和
和 与
与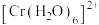 反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的
反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的 与
与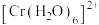 反应得到图中曲线Ⅱ和曲线
反应得到图中曲线Ⅱ和曲线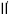 。
。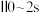 内,
内, 的平均生成速率为
的平均生成速率为_____________  。
。
②下列说法中正确的有_____________ (填选项字母)。
A.平衡后加入 ,反应Ⅰ和反应Ⅱ的
,反应Ⅰ和反应Ⅱ的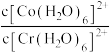 均减小
均减小
B.上述实验中,反应速率都随反应进程逐渐增加
C.上述实验中,体系颜色不再变化则达到平衡状态
(4)向还有未溶解 的
的 饱和溶液中滴加氨水,发生反应
饱和溶液中滴加氨水,发生反应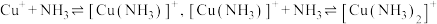 。平衡体系中
。平衡体系中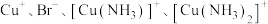 的浓度与
的浓度与 浓度的变化关系如图所示。
浓度的变化关系如图所示。_____________ {填“ ”“
”“ ”“
”“ ”或“
”或“ ”}浓度与
”}浓度与 浓度的变化曲线。
浓度的变化曲线。
② 的溶度积
的溶度积
_______________ 。
③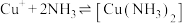 的平衡常数
的平衡常数
___________ 。
(1)合成氨反应的能量变化示意图如图所示,该反应的热化学方程式为
 显粉红色,
显粉红色, 显橙黄色,
显橙黄色, 显土黄色。
显土黄色。①基态
 的
的 电子轨道表示式为
电子轨道表示式为②酸性条件下,
 和
和 可与
可与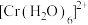 反应,补充完整反应的离子方程式:
反应,补充完整反应的离子方程式:Ⅰ.
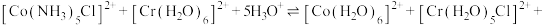
Ⅱ.
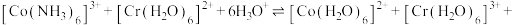
(3)某温度下,对(2)中的反应进行了研究。速率方程为
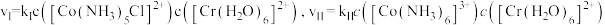 ;保持其他条件不变,分别用浓度相同的
;保持其他条件不变,分别用浓度相同的 和
和 与
与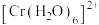 反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的
反应得到图中曲线Ⅰ和曲线Ⅱ;用不同浓度的 与
与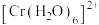 反应得到图中曲线Ⅱ和曲线
反应得到图中曲线Ⅱ和曲线 。
。
 内,
内, 的平均生成速率为
的平均生成速率为 。
。②下列说法中正确的有
A.平衡后加入
 ,反应Ⅰ和反应Ⅱ的
,反应Ⅰ和反应Ⅱ的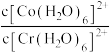 均减小
均减小B.上述实验中,反应速率都随反应进程逐渐增加
C.上述实验中,体系颜色不再变化则达到平衡状态
(4)向还有未溶解
 的
的 饱和溶液中滴加氨水,发生反应
饱和溶液中滴加氨水,发生反应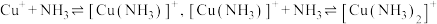 。平衡体系中
。平衡体系中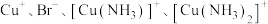 的浓度与
的浓度与 浓度的变化关系如图所示。
浓度的变化关系如图所示。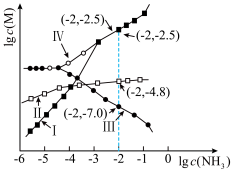
 ”“
”“ ”“
”“ ”或“
”或“ ”}浓度与
”}浓度与 浓度的变化曲线。
浓度的变化曲线。②
 的溶度积
的溶度积
③
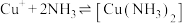 的平衡常数
的平衡常数
您最近一年使用:0次
5 . 钪 是一种稀土金属元素,在国防、航天,核能等领域具有重要应用。氯化钪
是一种稀土金属元素,在国防、航天,核能等领域具有重要应用。氯化钪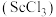 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有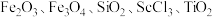 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下: 难溶于盐酸。
难溶于盐酸。
②常温下,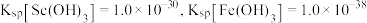 。
。
回答下列问题:
(1)某次实验中需要使用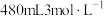 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为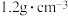 ,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为
,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为___________  。
。
(2)滤渣1的主要成分是______________ (填化学式)。“酸浸”时温度过高,酸浸速率反而减慢,其原因是__________ 。
(3)常温下,“调 ”时,溶液中
”时,溶液中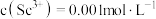 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是___________ (当溶液中某离子浓度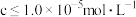 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(4)“氧化”时反应的离子方程式为________________ 。
(5)实验室模拟流程中“灼烧”得到 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为___________ ,“加热氯化”步骤中所加入焦炭过量,写出由 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:________________ 。
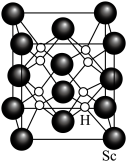
(6) 的一种氢化物的晶胞结构如图所示,已知晶胞的边长为
的一种氢化物的晶胞结构如图所示,已知晶胞的边长为 。
。_______________ 。
②设 表示阿伏加德罗常数的值,则钪晶体的密度为
表示阿伏加德罗常数的值,则钪晶体的密度为___________  。
。
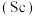 是一种稀土金属元素,在国防、航天,核能等领域具有重要应用。氯化钪
是一种稀土金属元素,在国防、航天,核能等领域具有重要应用。氯化钪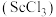 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有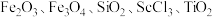 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下: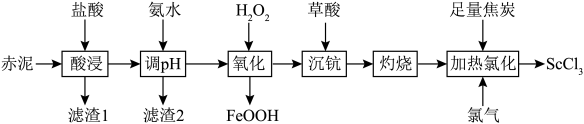
 难溶于盐酸。
难溶于盐酸。②常温下,
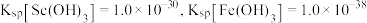 。
。回答下列问题:
(1)某次实验中需要使用
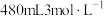 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为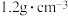 ,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为
,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为 。
。(2)滤渣1的主要成分是
(3)常温下,“调
 ”时,溶液中
”时,溶液中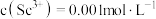 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是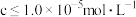 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(4)“氧化”时反应的离子方程式为
(5)实验室模拟流程中“灼烧”得到
 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:(6)
 的一种氢化物的晶胞结构如图所示,已知晶胞的边长为
的一种氢化物的晶胞结构如图所示,已知晶胞的边长为 。
。
②设
 表示阿伏加德罗常数的值,则钪晶体的密度为
表示阿伏加德罗常数的值,则钪晶体的密度为 。
。
您最近一年使用:0次
2024-06-08更新
|
31次组卷
|
2卷引用:黑龙江省双鸭山市友谊县高级中学2023-2024学年高三下学期第三次模拟考试化学试题
6 . 叠氮化钠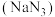 是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,
是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚, 以上易分解,在有机合成和汽车行业有着重要应用。某学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。制备
以上易分解,在有机合成和汽车行业有着重要应用。某学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。制备 的装置如下:
的装置如下: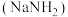 熔点为
熔点为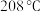 ,易潮解和氧化;
,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸
有强氧化性,不与酸、碱反应;叠氮酸 不稳定,易分解爆炸。
不稳定,易分解爆炸。
②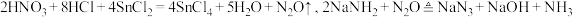 .
.
回答下列问题:
(1)仪器X的名称是___________ ;装置B的作用是______________ 。
(2)装置C处充分反应后,停止加热,为防止倒吸,需继续进行的操作为___________ ;装置D的作用是___________ 。
(3)装置E中生成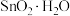 沉淀和无污染气体,反应的化学方程式为
沉淀和无污染气体,反应的化学方程式为________________ 。
(4)反应后的产品中可能含有杂质 和
和___________ ;产品冷却后,溶解于水,再加入乙醇并搅拌,然后过滤,___________ ,干燥。
(5)产品纯度的测定:称取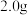 产品,配成
产品,配成 溶液.取
溶液.取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 溶液
溶液 ,充分反应后,再用
,充分反应后,再用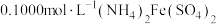 标准溶液滴定过量的
标准溶液滴定过量的 ,终点时消耗标准溶液
,终点时消耗标准溶液 。相关反应如下(假设杂质均不参与反应):
。相关反应如下(假设杂质均不参与反应):
i.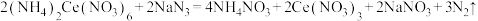
ii.
产品中叠氮化钠的纯度为___________ 。
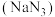 是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,
是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚, 以上易分解,在有机合成和汽车行业有着重要应用。某学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。制备
以上易分解,在有机合成和汽车行业有着重要应用。某学习小组对叠氮化钠的制备和产品纯度测定进行相关探究。制备 的装置如下:
的装置如下:
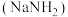 熔点为
熔点为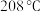 ,易潮解和氧化;
,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸
有强氧化性,不与酸、碱反应;叠氮酸 不稳定,易分解爆炸。
不稳定,易分解爆炸。②
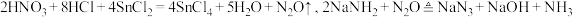 .
.回答下列问题:
(1)仪器X的名称是
(2)装置C处充分反应后,停止加热,为防止倒吸,需继续进行的操作为
(3)装置E中生成
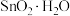 沉淀和无污染气体,反应的化学方程式为
沉淀和无污染气体,反应的化学方程式为(4)反应后的产品中可能含有杂质
 和
和(5)产品纯度的测定:称取
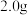 产品,配成
产品,配成 溶液.取
溶液.取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 溶液
溶液 ,充分反应后,再用
,充分反应后,再用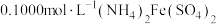 标准溶液滴定过量的
标准溶液滴定过量的 ,终点时消耗标准溶液
,终点时消耗标准溶液 。相关反应如下(假设杂质均不参与反应):
。相关反应如下(假设杂质均不参与反应):i.
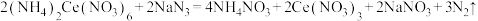
ii.

产品中叠氮化钠的纯度为
您最近一年使用:0次
2024-06-08更新
|
29次组卷
|
2卷引用:黑龙江省双鸭山市友谊县高级中学2023-2024学年高三下学期第三次模拟考试化学试题
7 . 苯乙烯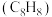 主要用作合成树脂、离子交换树脂及合成橡胶等的重要单体,也可用于制药、染料、农药以及选矿等行业。在催化剂作用下,苯乙烯可由乙苯
主要用作合成树脂、离子交换树脂及合成橡胶等的重要单体,也可用于制药、染料、农药以及选矿等行业。在催化剂作用下,苯乙烯可由乙苯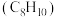 直接脱氢或氧化脱氢制备。
直接脱氢或氧化脱氢制备。
反应Ⅰ(直接脱氢):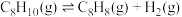
反应Ⅱ(氧化脱氢):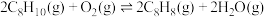
回答下列问题:
(1)已知:①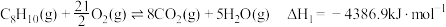
②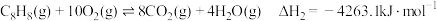
③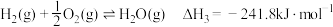
则反应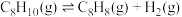 的
的
___________  ,若该反应的活化能
,若该反应的活化能 (正)为
(正)为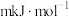 ,则该反应逆反应的活化能
,则该反应逆反应的活化能 (逆)为
(逆)为___________  。
。
(2)对于反应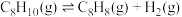 ,保持温度和压强不变,向一体积可变的密闭容器(起始体积为
,保持温度和压强不变,向一体积可变的密闭容器(起始体积为 )中分别通入
)中分别通入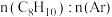 为
为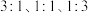 的混合气体
的混合气体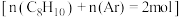 ,直接脱氢过程中
,直接脱氢过程中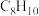 转化率随时间变化如图所示:
转化率随时间变化如图所示: 的目的是
的目的是_________________ 。
②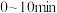 内反应速率最慢的混合气对应图中曲线
内反应速率最慢的混合气对应图中曲线___________ (填“a”“b”或“c”)。
(3)在 温度下,将
温度下,将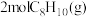 和
和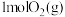 加入恒容的密闭容器中,发生反应Ⅰ、反应Ⅱ,测得
加入恒容的密闭容器中,发生反应Ⅰ、反应Ⅱ,测得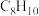 的转化率及体系内的压强随时间的变化关系如图所示(忽略温度对压强、催化剂的影响):
的转化率及体系内的压强随时间的变化关系如图所示(忽略温度对压强、催化剂的影响):
①
___________  (填“<”或“>”)。
(填“<”或“>”)。
② 温度下,反应Ⅰ的分压平衡常数
温度下,反应Ⅰ的分压平衡常数
___________  (保留小数点后一位,
(保留小数点后一位, 为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
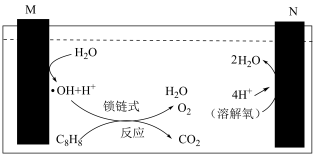
为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 ),已知:
),已知: (羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成
(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成 和
和 。
。___________ (填“正极”或“负极”)。
②苯乙烯被 氧化的化学反应方程式为
氧化的化学反应方程式为__________________ 。
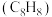 主要用作合成树脂、离子交换树脂及合成橡胶等的重要单体,也可用于制药、染料、农药以及选矿等行业。在催化剂作用下,苯乙烯可由乙苯
主要用作合成树脂、离子交换树脂及合成橡胶等的重要单体,也可用于制药、染料、农药以及选矿等行业。在催化剂作用下,苯乙烯可由乙苯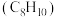 直接脱氢或氧化脱氢制备。
直接脱氢或氧化脱氢制备。反应Ⅰ(直接脱氢):
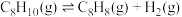
反应Ⅱ(氧化脱氢):
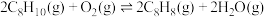
回答下列问题:
(1)已知:①
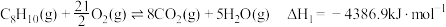
②
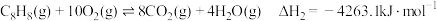
③
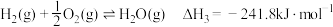
则反应
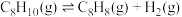 的
的
 ,若该反应的活化能
,若该反应的活化能 (正)为
(正)为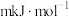 ,则该反应逆反应的活化能
,则该反应逆反应的活化能 (逆)为
(逆)为 。
。(2)对于反应
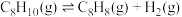 ,保持温度和压强不变,向一体积可变的密闭容器(起始体积为
,保持温度和压强不变,向一体积可变的密闭容器(起始体积为 )中分别通入
)中分别通入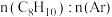 为
为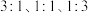 的混合气体
的混合气体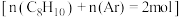 ,直接脱氢过程中
,直接脱氢过程中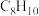 转化率随时间变化如图所示:
转化率随时间变化如图所示: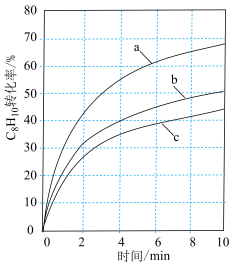
 的目的是
的目的是②
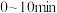 内反应速率最慢的混合气对应图中曲线
内反应速率最慢的混合气对应图中曲线(3)在
 温度下,将
温度下,将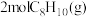 和
和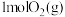 加入恒容的密闭容器中,发生反应Ⅰ、反应Ⅱ,测得
加入恒容的密闭容器中,发生反应Ⅰ、反应Ⅱ,测得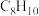 的转化率及体系内的压强随时间的变化关系如图所示(忽略温度对压强、催化剂的影响):
的转化率及体系内的压强随时间的变化关系如图所示(忽略温度对压强、催化剂的影响):①

 (填“<”或“>”)。
(填“<”或“>”)。②
 温度下,反应Ⅰ的分压平衡常数
温度下,反应Ⅰ的分压平衡常数
 (保留小数点后一位,
(保留小数点后一位, 为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
为用平衡分压表示的平衡常数,即用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。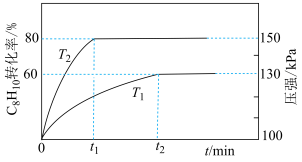
 ),已知:
),已知: (羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成
(羟基自由基)具有很强的氧化性,可以将苯乙烯氧化成 和
和 。
。
②苯乙烯被
 氧化的化学反应方程式为
氧化的化学反应方程式为
您最近一年使用:0次
2024-06-07更新
|
34次组卷
|
2卷引用:黑龙江省双鸭山市友谊县高级中学2023-2024学年高三下学期第三次模拟考试化学试题
8 . 盐酸苯达莫司汀(Ⅰ)常用于治疗慢性淋巴细胞白血病、非霍奇金淋巴瘤等疾病。一种合成盐酸苯达莫司汀的路线如下: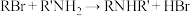 。
。
(1)A中所含官能团的名称为___________ ; 的反应类型为
的反应类型为___________ 。
(2)D的核磁共振氢谱图的波峰数有___________ 个;G的结构简式为___________ 。
(3) 的化学方程式为
的化学方程式为________________ 。
(4)同时符合下列条件的化合物D的同分异构体有___________ 种(不考虑立体异构)。
①能发生银镜反应;②能与 反应产生气体;③无环状结构。
反应产生气体;③无环状结构。
(5)等物质的量的I与H分别在一定条件下与足量 溶液反应,消耗
溶液反应,消耗 的物质的量之比为
的物质的量之比为___________ 。
(6)以乙烯、 为原料合成
为原料合成 的一种合成路线如下:
的一种合成路线如下:__________________ ,X的结构简式为_________________ 。
 。
。② 。
。
(1)A中所含官能团的名称为
 的反应类型为
的反应类型为(2)D的核磁共振氢谱图的波峰数有
(3)
 的化学方程式为
的化学方程式为(4)同时符合下列条件的化合物D的同分异构体有
①能发生银镜反应;②能与
 反应产生气体;③无环状结构。
反应产生气体;③无环状结构。(5)等物质的量的I与H分别在一定条件下与足量
 溶液反应,消耗
溶液反应,消耗 的物质的量之比为
的物质的量之比为(6)以乙烯、
 为原料合成
为原料合成 的一种合成路线如下:
的一种合成路线如下: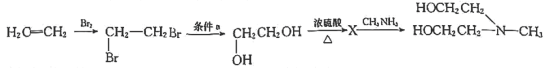
您最近一年使用:0次
2024-06-03更新
|
87次组卷
|
2卷引用:黑龙江省双鸭山市友谊县高级中学2023-2024学年高三下学期第三次模拟考试化学试题
名校
9 . X、Y、Z、Q、M、R、T、W是原子序数依次增大的前四周期元素,其中X元素的原子核外只有一个电子;X与Y原子序数之和等于Z的原子序数;Z元素的气态氢化物极易溶于水,可用作制冷剂;Q基态原子核外s能级电子总数与p能级电子总数相等;M基态原子核外有6个原子轨道排有电子,且只有1个未成对电子;R最高价氧化物的水化物是一种强酸;T为s区元素且基态原子各能层没有未成对电子;W最外层只有1个电子,其内层各能级所有轨道电子均成对。
(1)Y的基态原子最高能层符号为___________ ,Z基态原子有___________ 种不同运动状态的电子。
(2)Y、Z、Q与分别X形成的10电子化合物,键角由大到小的顺序是___________ (用分子式表示)。X与Q组成的原子个数1:1的化合物的电子式为___________ 。
(3)W在元素周期表中的位置为___________ ,其基态原子的价电子轨道表示式为___________ 。
(4)下列说法不正确的是___________ 。
A.X、Y、Z都能与Q形成原子个数之比为1:1的化合物
B.Y、Z、Q的第一电离能依次逐渐增大
C.简单离子半径大小:R>T>M
D.W的焰色试验与原子核外电子跃迁吸收能量有关
E.M同周期元素氧化物的晶体类型按离子晶体、共价晶体、分子晶体的顺序过渡
(1)Y的基态原子最高能层符号为
(2)Y、Z、Q与分别X形成的10电子化合物,键角由大到小的顺序是
(3)W在元素周期表中的位置为
(4)下列说法不正确的是
A.X、Y、Z都能与Q形成原子个数之比为1:1的化合物
B.Y、Z、Q的第一电离能依次逐渐增大
C.简单离子半径大小:R>T>M
D.W的焰色试验与原子核外电子跃迁吸收能量有关
E.M同周期元素氧化物的晶体类型按离子晶体、共价晶体、分子晶体的顺序过渡
您最近一年使用:0次
名校
10 . 回答下列问题
(1)Si原子结构示意图为___________ ,在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为___________ 。___________ ,写出检验过程中生成配位数为6的配合物的离子方程式 ___________ 。
(3)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,石墨烯是从石墨材料中剥离出来的,下列说法正确的是___________ 。
B.石墨中的碳原子采取sp2杂化,金刚石晶体中,C原子采取 杂化
杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面
E.石墨烯中平均每个六元碳环含有3个碳原子
(4)经X射线衍射测定发现,晶体钴的晶胞和堆积方式剖面图如下图所示,则该晶胞中含钴原子个数为___________ 个,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为___________ (用含π的代数式表示。空间利用率=原子总体积与晶胞体积之比)。
(1)Si原子结构示意图为
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,Si与O的原子数之比为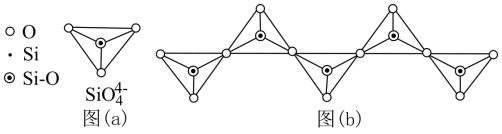
(3)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,石墨烯是从石墨材料中剥离出来的,下列说法正确的是
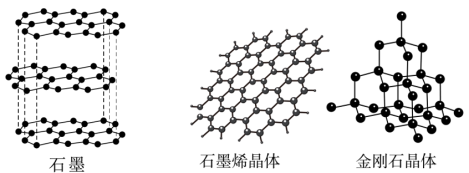
B.石墨中的碳原子采取sp2杂化,金刚石晶体中,C原子采取
 杂化
杂化C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接12个六元环,六元环中最多有4个C原子在同一平面
E.石墨烯中平均每个六元碳环含有3个碳原子
(4)经X射线衍射测定发现,晶体钴的晶胞和堆积方式剖面图如下图所示,则该晶胞中含钴原子个数为


您最近一年使用:0次



