名校
1 . 乙烯是重要的化工原料,有关乙烯的部分转化关系如图:
(1)写出A的结构简式:___________ 。
(2)反应②的反应类型为___________ 。
(3)反应③的化学方程式为___________ 。
(4)乙二醇和乙酸发生酯化反应得到产物 ,为测定B的分子式,取有机物
,为测定B的分子式,取有机物 ,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和
,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和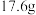 ,写出有机物
,写出有机物 的分子式
的分子式___________ 。
(5)有机物 的同分异构体
的同分异构体 ,
,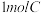 与足量的
与足量的 粉末反应,生成
粉末反应,生成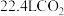 (标准状况),若与足量金属钠反应则生成
(标准状况),若与足量金属钠反应则生成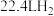 (标准状况),则
(标准状况),则 可能的结构有
可能的结构有___________ 种。

(1)写出A的结构简式:
(2)反应②的反应类型为
(3)反应③的化学方程式为
(4)乙二醇和乙酸发生酯化反应得到产物
 ,为测定B的分子式,取有机物
,为测定B的分子式,取有机物 ,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和
,在足量氧气中充分燃烧,并使产物依次缓慢通过浓硫酸、碱石灰,两者分别增重7.2和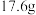 ,写出有机物
,写出有机物 的分子式
的分子式(5)有机物
 的同分异构体
的同分异构体 ,
,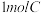 与足量的
与足量的 粉末反应,生成
粉末反应,生成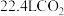 (标准状况),若与足量金属钠反应则生成
(标准状况),若与足量金属钠反应则生成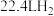 (标准状况),则
(标准状况),则 可能的结构有
可能的结构有
您最近一年使用:0次
名校
解题方法
2 . 汽车尾气中含有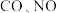 等有害气体。
等有害气体。
(1)汽车尾气中 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图:___________ 。
(2)利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 。
。
①该反应的化学方程式为___________ 。
②某温度下,在 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为___________  ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为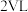 ,则该反应的速率会
,则该反应的速率会___________ (填“增大”“减小”或“不变”)。
③下列可以表明上述可逆反应已达到化学平衡状态的是___________ (填序号)。
a.容器中的气体压强保持不变
b.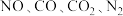 的浓度之比为
的浓度之比为
c. 的浓度不再改变
的浓度不再改变
d.相同时间内,反应消耗 的同时消耗
的同时消耗
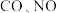 等有害气体。
等有害气体。(1)汽车尾气中
 生成过程的能量变化示意图如图:
生成过程的能量变化示意图如图: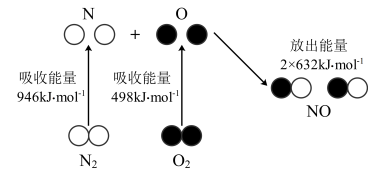
(2)利用催化技术可将汽车尾气中的
 和
和 转化为
转化为 和
和 。
。①该反应的化学方程式为
②某温度下,在
 的密闭容器中通入
的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:时间/ | 0 | 1 | 2 | 3 | … |
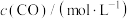 | 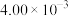 |  |  |  | … |
 的浓度变化表示反应由开始到
的浓度变化表示反应由开始到 时的平均反应速率为
时的平均反应速率为 ;若恒温下保持起始投料量相同,容器体积变为
;若恒温下保持起始投料量相同,容器体积变为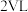 ,则该反应的速率会
,则该反应的速率会③下列可以表明上述可逆反应已达到化学平衡状态的是
a.容器中的气体压强保持不变
b.
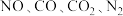 的浓度之比为
的浓度之比为
c.
 的浓度不再改变
的浓度不再改变d.相同时间内,反应消耗
 的同时消耗
的同时消耗
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、M、Q、R是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如表所示:
回答下列问题。
(1)X与Q的电负性大小顺序为___________ (用元素符号表示)。
(2)Y元素基态原子的简化电子排布式为___________ ;R元素基态原子的价层电子轨道表示式为___________ 。
(3)R元素可形成 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(4)Y、Z的电负性较大的是___________ (填元素符号)。
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:___________ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期主族元素中最大 |
| M | 逐级电离能(单位: )依次为578、1817、2745、11575、14830、18376、23293 )依次为578、1817、2745、11575、14830、18376、23293 |
| Q | 基态原子的核外电子占据5个能级,且最外层p轨道上有2个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子3d能级上有6个电子 |
(1)X与Q的电负性大小顺序为
(2)Y元素基态原子的简化电子排布式为
(3)R元素可形成
 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(4)Y、Z的电负性较大的是
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:
您最近一年使用:0次
4 . 某学生用标准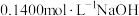 溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
A.用酸式滴定管取稀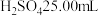 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的 溶液润洗后,将标准液注入碱式滴定管刻度“0”以上
溶液润洗后,将标准液注入碱式滴定管刻度“0”以上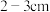 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去 溶液
溶液
(1)在G操作中如何确定终点___________ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果___________ (填“偏小”、“偏大”或“恰好合适”)。
(3)配制 标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是
标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是___________ 。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,会导致测得的稀 溶液浓度测定值
溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
(5)计算待测硫酸溶液的物质的量浓度___________ 。
(6)利用 燃料电池电解制备
燃料电池电解制备 并得到副产物
并得到副产物 、
、 、
、 ,装置如图所示
,装置如图所示
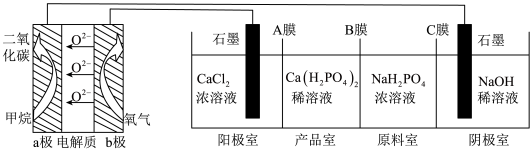
①a极的电极方程式:___________ 。
②A膜为___________ 、B膜为___________ (阳离子交换膜或阴离子交换膜)。
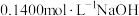 溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):A.用酸式滴定管取稀
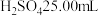 ,注入锥形瓶中,加入酚酞
,注入锥形瓶中,加入酚酞B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的
 溶液润洗后,将标准液注入碱式滴定管刻度“0”以上
溶液润洗后,将标准液注入碱式滴定管刻度“0”以上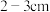 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去
 溶液
溶液
(1)在G操作中如何确定终点
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(3)配制
 标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是
标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,会导致测得的稀
 溶液浓度测定值
溶液浓度测定值(5)计算待测硫酸溶液的物质的量浓度
(6)利用
 燃料电池电解制备
燃料电池电解制备 并得到副产物
并得到副产物 、
、 、
、 ,装置如图所示
,装置如图所示
①a极的电极方程式:
②A膜为
您最近一年使用:0次
名校
解题方法
5 . 环成二烯(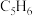 )是一种重要的有机化工原料。
)是一种重要的有机化工原料。
Ⅰ.环戊二烯容易反应生成双环戊二烯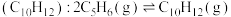 。不同温度下,溶液中环戊二烯(
。不同温度下,溶液中环戊二烯(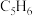 )浓度(初始浓度为
)浓度(初始浓度为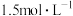 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
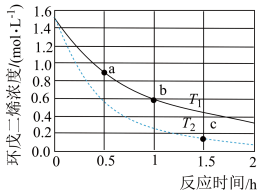
(1)反应开始至b点时,用双环戊二烯(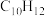 )表示的平均速率为
)表示的平均速率为___________  (小数表示)。
(小数表示)。
(2)
___________  (填“大于”、“小于”或“等于”);
(填“大于”、“小于”或“等于”);
(3)a点的正反应速率___________ b点的逆反应速率(填“大于”、“小于”或“等于”)。
Ⅱ.可用环戊二烯(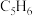 )制备环戊烯(
)制备环戊烯(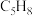 )。有如下反应:
)。有如下反应:
反应ⅰ: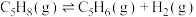
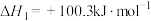
反应ⅱ:
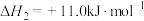
反应ⅲ: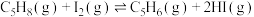

(4)反应ⅲ的焓变
___________  。
。
(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应ⅲ,起始总压为 ,平衡时总压为
,平衡时总压为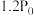 。
。
①平衡时环戊烯(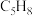 )的体积分数为
)的体积分数为___________  。
。
②用平衡分压(分压 总压
总压 物质的量分数)代替平衡浓度计算压强平衡常数
物质的量分数)代替平衡浓度计算压强平衡常数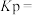
___________ 。
A.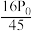 B.
B.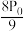 C.
C.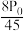 D.
D.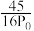
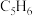 )是一种重要的有机化工原料。
)是一种重要的有机化工原料。Ⅰ.环戊二烯容易反应生成双环戊二烯
 。不同温度下,溶液中环戊二烯(
。不同温度下,溶液中环戊二烯( )浓度(初始浓度为
)浓度(初始浓度为 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
(1)反应开始至b点时,用双环戊二烯(
 )表示的平均速率为
)表示的平均速率为 (小数表示)。
(小数表示)。(2)

 (填“大于”、“小于”或“等于”);
(填“大于”、“小于”或“等于”);(3)a点的正反应速率
Ⅱ.可用环戊二烯(
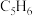 )制备环戊烯(
)制备环戊烯(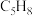 )。有如下反应:
)。有如下反应:反应ⅰ:
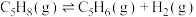
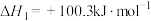
反应ⅱ:

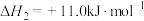
反应ⅲ:
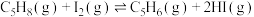

(4)反应ⅲ的焓变

 。
。(5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应ⅲ,起始总压为
 ,平衡时总压为
,平衡时总压为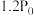 。
。①平衡时环戊烯(
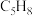 )的体积分数为
)的体积分数为 。
。②用平衡分压(分压
 总压
总压 物质的量分数)代替平衡浓度计算压强平衡常数
物质的量分数)代替平衡浓度计算压强平衡常数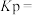
A.
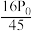 B.
B.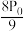 C.
C.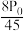 D.
D.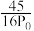
您最近一年使用:0次
6 . 某科研人员以废镍催化剂(主要成分为 ,另含
,另含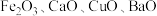 )为原料回收镍,工艺流程如图。
)为原料回收镍,工艺流程如图。 如表。
如表。
回答下列问题:
(1)浸出渣主要成分为___________ 、___________ 。(填化学式)
(2)“除铜”时, 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“氧化”的目的是将溶液中 氧化为
氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。温度需控制在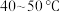 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是___________ 。
(4)“调 ”时,
”时, 的控制范围为
的控制范围为___________ 。
(5)“除钙”后,若溶液中 浓度为
浓度为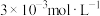 ,则
,则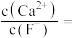
___________ 。[已知常温下, ]
]
(6)用可溶性碳酸盐,可以浸取 固体,在溶液浸取过程发生反应:
固体,在溶液浸取过程发生反应: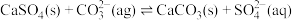 。已知:
。已知: 时,
时,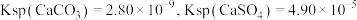 ,则此温度下该反应的平衡常数K为
,则此温度下该反应的平衡常数K为___________ (计算结果保留三位有效数字)。
 ,另含
,另含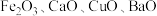 )为原料回收镍,工艺流程如图。
)为原料回收镍,工艺流程如图。
 如表。
如表。| 氢氧化物 |  |  |  |
开始沉淀的 | 1.5 | 6.5 | 7.7 |
沉淀完全的 | 3.7 | 9.7 | 9.2 |
(1)浸出渣主要成分为
(2)“除铜”时,
 与
与 反应的离子方程式为
反应的离子方程式为(3)“氧化”的目的是将溶液中
 氧化为
氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式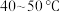 之间,该步骤温度不能太高的原因是
之间,该步骤温度不能太高的原因是(4)“调
 ”时,
”时, 的控制范围为
的控制范围为(5)“除钙”后,若溶液中
 浓度为
浓度为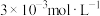 ,则
,则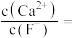
 ]
](6)用可溶性碳酸盐,可以浸取
 固体,在溶液浸取过程发生反应:
固体,在溶液浸取过程发生反应: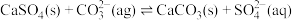 。已知:
。已知: 时,
时,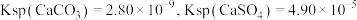 ,则此温度下该反应的平衡常数K为
,则此温度下该反应的平衡常数K为
您最近一年使用:0次
2023-09-16更新
|
873次组卷
|
4卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
7 . 用乙酸和正丁醇 制备乙酸正丁酯,反应方程式如下:
制备乙酸正丁酯,反应方程式如下: 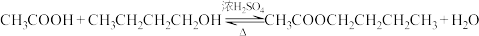 。相关数据如表。
。相关数据如表。
请回答有关问题:
I.乙酸正丁酯粗产品的制备
在三颈烧瓶中加入几粒碎瓷片,再加入 正丁醇和
正丁醇和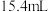 冰醋酸(稍过量),再加3~4滴浓硫酸,摇匀。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热(温度控制在115℃~125℃之间)冷凝回流反应。
冰醋酸(稍过量),再加3~4滴浓硫酸,摇匀。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热(温度控制在115℃~125℃之间)冷凝回流反应。_______ (填a或b)端管口流出。
(2)加入碎瓷片的作用是_______ ,实验中应采取的最佳加热方式为_______ 。
A.水浴加热 B.油浴加热 C.直接加热
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下操作进行精制:①水洗、分液 ②蒸馏 ③用无水 干燥 ④用10%碳酸钠溶液洗涤、分液。正确的操作步骤是
干燥 ④用10%碳酸钠溶液洗涤、分液。正确的操作步骤是_______ (填字母序号),其中蒸馏操作中收集产品的温度约为_______ 。
A.①②③④ B.③①④② C.①④①③② D.④①③②③
(4)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回A中,下层水层从分水器下口放出,反应结束的标志是_______ 。
(5)称量制得的乙酸正丁酯的质量为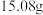 ,则乙酸正丁酯的产率
,则乙酸正丁酯的产率_______ (保留两位有效数字)。
 制备乙酸正丁酯,反应方程式如下:
制备乙酸正丁酯,反应方程式如下: 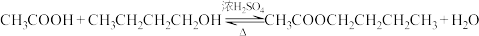 。相关数据如表。
。相关数据如表。| 化合物 | 相对分子质量 | 密度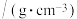 | 沸点/℃ | 溶解度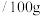 水 水 |
| 正丁醇 | 74 | 0.80 | 118 | 9 |
| 冰醋酸 | 60 | 1.045 | 118 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126 | 0.7 |
I.乙酸正丁酯粗产品的制备
在三颈烧瓶中加入几粒碎瓷片,再加入
 正丁醇和
正丁醇和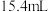 冰醋酸(稍过量),再加3~4滴浓硫酸,摇匀。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热(温度控制在115℃~125℃之间)冷凝回流反应。
冰醋酸(稍过量),再加3~4滴浓硫酸,摇匀。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热(温度控制在115℃~125℃之间)冷凝回流反应。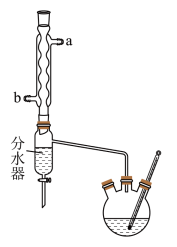
(2)加入碎瓷片的作用是
A.水浴加热 B.油浴加热 C.直接加热
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下操作进行精制:①水洗、分液 ②蒸馏 ③用无水
 干燥 ④用10%碳酸钠溶液洗涤、分液。正确的操作步骤是
干燥 ④用10%碳酸钠溶液洗涤、分液。正确的操作步骤是A.①②③④ B.③①④② C.①④①③② D.④①③②③
(4)分水器的“分水”原理是冷凝液在分水器中分层,上层有机层从支管处流回A中,下层水层从分水器下口放出,反应结束的标志是
(5)称量制得的乙酸正丁酯的质量为
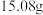 ,则乙酸正丁酯的产率
,则乙酸正丁酯的产率
您最近一年使用:0次
2023-07-13更新
|
315次组卷
|
4卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二上学期开学考试化学试卷
黑龙江省大兴安岭实验中学2023-2024学年高二上学期开学考试化学试卷吉林省长春市东北师范大学附属中学2022-2023学年高一下学期期末考试化学试题(已下线)综合02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)(已下线)猜想07 几类常考有机问题(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
名校
8 . 海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程如图所示,回答下列问题:_______ 等(任填一种即可)。
(2)由海水晒制的粗盐中含有 、
、 、
、 等离子,步骤①中所加试剂及有关操作的先后顺序为(试剂写化学式)
等离子,步骤①中所加试剂及有关操作的先后顺序为(试剂写化学式)_______ 、_______ 、 、过滤、
、过滤、 。
。
(3)步骤②中加入的物质是_______ (填物质名称)。
(4)利用下图所示装置模拟工业上从母液中提取溴,在B瓶中得到较浓的溴水。 至反应完全,发生反应的的离子方程式是
至反应完全,发生反应的的离子方程式是_______ ;再关闭a、c,打开b、d、e,由b向A中鼓入足量热空气,同时由e向B中通入足量_______ ;关闭b、e,打开a,再由a向B中缓缓鼓入足量 ,即可在B中得到较浓的溴水。
,即可在B中得到较浓的溴水。
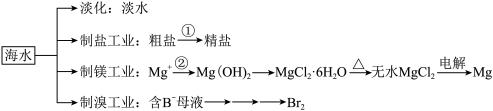
(2)由海水晒制的粗盐中含有
 、
、 、
、 等离子,步骤①中所加试剂及有关操作的先后顺序为(试剂写化学式)
等离子,步骤①中所加试剂及有关操作的先后顺序为(试剂写化学式) 、过滤、
、过滤、 。
。(3)步骤②中加入的物质是
(4)利用下图所示装置模拟工业上从母液中提取溴,在B瓶中得到较浓的溴水。
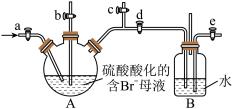
 至反应完全,发生反应的的离子方程式是
至反应完全,发生反应的的离子方程式是 ,即可在B中得到较浓的溴水。
,即可在B中得到较浓的溴水。
您最近一年使用:0次
2023-07-13更新
|
148次组卷
|
2卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二上学期开学考试化学试卷
9 . 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:

(1)I、II、III、IV装置可盛放的试剂是:I___________ ;II___________ ;III___________ ;IV___________ (将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是___________ 。
(3)使用装置II的目的是___________ 。
(4)使用装置III的目的是___________ 。
(5)确定含有乙烯的现象是___________ 。

(1)I、II、III、IV装置可盛放的试剂是:I
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是
(3)使用装置II的目的是
(4)使用装置III的目的是
(5)确定含有乙烯的现象是
您最近一年使用:0次
2023-06-29更新
|
69次组卷
|
18卷引用:黑龙江省大兴安岭地区漠河县第一中学2018-2019学年高二上学期第一次月考化学试题
黑龙江省大兴安岭地区漠河县第一中学2018-2019学年高二上学期第一次月考化学试题(已下线)2012年人教版高中化学选修5 2.1脂肪烃练习卷(已下线)2014年高一化学人教版必修2 3.2.1乙烯练习卷内蒙古北京八中乌兰察布分校2016-2017学年高一下学期第二次调考化学试题高二人教版选修5 第三章 烃的含氧衍生物 第一节 醇酚云南省绥江县一中2018-2019学年高一下学期期末考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高二上学期第二次月考化学试题课时1 石油的炼制 乙烯——A学习区 夯实基础(鲁科版必修2)课时1 甲烷 石油的炼制与乙烯——A学习区 夯实基础(鲁科版(2019)第二册)山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题福建省莆田第七中学2020-2021学年高二上学期第一次月考化学试题上海市奉城高级中学2018-2019学年高二上学期期末考试化学试题安徽省安庆桐城市第八中学2020-2021学年高二上学期第一次段考化学试题黑龙江省双鸭山市第一中学2020-2021学年高二下学期4月月考化学试题云南省元阳县一中2020-2021学年高一下学期6月份考试化学试题陕西省西安市蓝田县大学区联考2022-2023学年高二下学期6月期末考试化学试题2.1.1有机化学反应的主要类型(课前)-鲁科版选择性必修3陕西省西安市蓝田县大学区联考2022-2023学年高二下学期4月期中考试化学试题
解题方法
10 . 从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),试回答:

(1)化合物的结构简式:B_____ 、C_____ 。
(2)③的反应类型是_____ 。
(3)反应⑥所用试剂和条件是_____ 。
(4)反应①~⑦中属于消去反应的是_____ 。(填数字代号)
(5)②的反应化学方程式_____ 。

(1)化合物的结构简式:B
(2)③的反应类型是
(3)反应⑥所用试剂和条件是
(4)反应①~⑦中属于消去反应的是
(5)②的反应化学方程式
您最近一年使用:0次



