1 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2020-07-08更新
|
12802次组卷
|
13卷引用:青海省湟川中学2020-2021学年高二下学期第一次月考化学试题
青海省湟川中学2020-2021学年高二下学期第一次月考化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国卷Ⅱ化学真题变式题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题
2 . CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______ mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
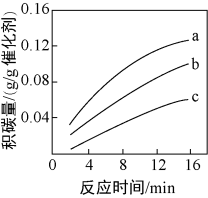
①由上表判断,催化剂X____ Y(填“优于”或“劣于”),理由是_________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________ 填标号)。

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为

您最近一年使用:0次
2018-06-09更新
|
14138次组卷
|
23卷引用:青海省湟川中学2020-2021学年高二上学期期中考试化学试题
青海省湟川中学2020-2021学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合(已下线)高考母题题源14 基本概念、基本理论综合二【全国百强校】西藏自治区拉萨中学2019届高三上学期第二次月考理科综合化学试题【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题【校级联考】江西省上饶市“山江湖”协作体2018-2019学年高二上学期第三次月考化学试题(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略【全国百强校】江西省南昌市第十中学2019届高三下学期期中考试(第二次模拟)理科综合化学试题辽宁省实验中学东戴河分校2019-2020学年高二10月月考化学试题四川省宜宾市叙州区第一中学2020届高三上学期开学考试理综化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题山东省2020届高三新高考仿真模拟化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练甘肃省临夏县中学2020-2021学年高二上学期期末考试化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题湖南省长沙县第九中学2021-2022学年高二上学期第二次月考化学试题
3 . 醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:
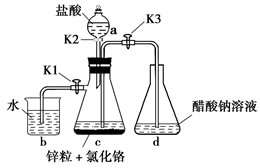
(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________ ,仪器a的名称是_______ 。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________ 。
②同时c中有气体产生,该气体的作用是_____________ 。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________ ;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________ 、_________ 、洗涤、干燥。
(4)指出装置d可能存在的缺点______________ 。

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为
②同时c中有气体产生,该气体的作用是
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是
(4)指出装置d可能存在的缺点
您最近一年使用:0次
2018-06-09更新
|
13804次组卷
|
26卷引用:青海省湟川中学2019-2020学年高一下学期期中考试化学试题
青海省湟川中学2019-2020学年高一下学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(新课标I卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源17 物质的制备和定量实验【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题四川省成都市龙泉第二中学2019届高三上学期12月月考化学试题云南省文山壮族苗族自治州马关县第一中学2020届高三上学期9月份考试化学试题云南省广南县第三中学2020届高三上学期开学考试化学试题云南省文山州广南县第二中学2020届高三上学期9月份考试化学试题云南省文山州马关县实验高中2020届高三上学期开学考试化学试题云南省屏边县民中2020届高三上学期开学考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》安徽省合肥二中2019-2020学年度高三上学期第一次段考化学试题浙江省宁波市效实中学2020届高三上学期复习阶段性测试化学试题西藏自治区拉萨市拉萨中学2019-2020学年高二第五次月考理科综合化学试题(已下线)专题13 实验题大题不丢分-2021年高考化学必做热点专题黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题黑龙江省齐齐哈尔市2020-2021学年高二下学期期末考试化学试题(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)山东省鄄城县实验中学2021-2022学年高三上学期第一次月考化学试卷题(已下线)2021年高考全国乙卷化学试题变式题河南省信阳高中2021-2022学年高一上学期期末考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题
4 . 环己醇常用于工业上制取增塑剂、表面活性剂以及用作工业溶剂等。苯酚( )催化加氢制备环己醇一直受到研究人员的关注,该反应为
)催化加氢制备环己醇一直受到研究人员的关注,该反应为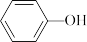 (g)+3H2(g)
(g)+3H2(g)
 (g)
(g) 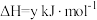 。请回答下列问题。
。请回答下列问题。
(1)已知: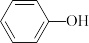

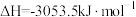 ;
;
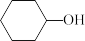
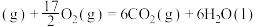
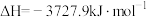 ;
;

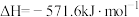 。
。
则
_______ 。
(2)向体积为50L的恒容密闭容器中充入一定量的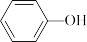 (g)和
(g)和 不同温度下,反应均进行5min测得反应物的转化率随温度的变化关系如图所示,已知曲线Ⅰ表示苯酚的转化率)。
不同温度下,反应均进行5min测得反应物的转化率随温度的变化关系如图所示,已知曲线Ⅰ表示苯酚的转化率)。
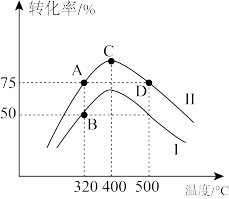
①起始时投入的苯酚和氢气的物质的量之比为_______ 。
②A、B、C、D四点对应的正反应速率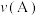 、
、 、
、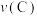 、
、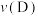 的大小关系为
的大小关系为_______ 。
③温度低于400℃时, 和苯酚的转化率随温度升高而增大的原因是
和苯酚的转化率随温度升高而增大的原因是_______ 。
④已知 ,V代表体积;n代表气体物质的量;T代表温度;R是摩尔气体常数,单位是
,V代表体积;n代表气体物质的量;T代表温度;R是摩尔气体常数,单位是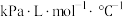 。若初始时向容器中充入的苯酚为1mol,则反应从起始进行到A点,其平均反应速率
。若初始时向容器中充入的苯酚为1mol,则反应从起始进行到A点,其平均反应速率
_______ ;当反应温度为500℃时,反应达到平衡后,
_______ 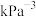 。(
。( 表示用分压代替浓度计算的平衡常数,结果用含R的代数式表示)
表示用分压代替浓度计算的平衡常数,结果用含R的代数式表示)
(3)氢原子和苯分子吸附在金属催化剂表面活性中心时,才能发生反应。当 中混有微量
中混有微量 杂质时,相同时间内测得环己醇的产率降低。推测其可能原因为
杂质时,相同时间内测得环己醇的产率降低。推测其可能原因为_______ 。
 )催化加氢制备环己醇一直受到研究人员的关注,该反应为
)催化加氢制备环己醇一直受到研究人员的关注,该反应为 (g)+3H2(g)
(g)+3H2(g)
 (g)
(g)  。请回答下列问题。
。请回答下列问题。(1)已知:
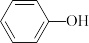

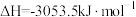 ;
;
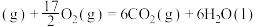
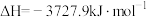 ;
;
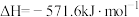 。
。则

(2)向体积为50L的恒容密闭容器中充入一定量的
 (g)和
(g)和 不同温度下,反应均进行5min测得反应物的转化率随温度的变化关系如图所示,已知曲线Ⅰ表示苯酚的转化率)。
不同温度下,反应均进行5min测得反应物的转化率随温度的变化关系如图所示,已知曲线Ⅰ表示苯酚的转化率)。
①起始时投入的苯酚和氢气的物质的量之比为
②A、B、C、D四点对应的正反应速率
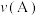 、
、 、
、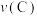 、
、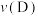 的大小关系为
的大小关系为③温度低于400℃时,
 和苯酚的转化率随温度升高而增大的原因是
和苯酚的转化率随温度升高而增大的原因是④已知
 ,V代表体积;n代表气体物质的量;T代表温度;R是摩尔气体常数,单位是
,V代表体积;n代表气体物质的量;T代表温度;R是摩尔气体常数,单位是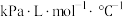 。若初始时向容器中充入的苯酚为1mol,则反应从起始进行到A点,其平均反应速率
。若初始时向容器中充入的苯酚为1mol,则反应从起始进行到A点,其平均反应速率

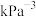 。(
。( 表示用分压代替浓度计算的平衡常数,结果用含R的代数式表示)
表示用分压代替浓度计算的平衡常数,结果用含R的代数式表示)(3)氢原子和苯分子吸附在金属催化剂表面活性中心时,才能发生反应。当
 中混有微量
中混有微量 杂质时,相同时间内测得环己醇的产率降低。推测其可能原因为
杂质时,相同时间内测得环己醇的产率降低。推测其可能原因为
您最近一年使用:0次
2022-04-22更新
|
1203次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2022届高三第二次模拟考试理科综合化学试题
5 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5613次组卷
|
40卷引用:青海省西宁二十一中2018届高三上学期12月月考化学试卷
青海省西宁二十一中2018届高三上学期12月月考化学试卷2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省邻水实验学校2022届高三上学期入学考试理综化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
6 . 金属元素Cu、Mn、Co、Ni等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
(1)基态Cu原子中,核外电子占据最高能层的符号是_______ 。
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,
表示,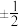 即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铜锰氧化物(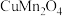 )能在常温下催化氧化甲醛(结构如图)生成甲酸。
)能在常温下催化氧化甲醛(结构如图)生成甲酸。
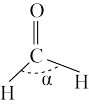
①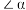
_______ (填“>”、“=”或“<”)120°;从原子轨道重叠方式分类,分子中 键的类型是
键的类型是_______ 。
②气态时,测得甲酸的相对分子质量大于46,其原因可能是_______ 。
(4) 是有机催化剂,其溶液为天蓝色。
是有机催化剂,其溶液为天蓝色。
①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则 的杂化轨道类型为
的杂化轨道类型为_______ (填标号)。
A. B.sp C.
B.sp C. D.
D.
② 的空间构型为
的空间构型为_______ ;分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为_______ 。
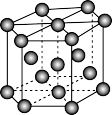
(5)Co晶体堆积方式为六方最密堆积,其晶胞结构如图所示,已知Co的原子半径为r,该晶胞的空间利用率为_______ (晶胞上占有的原子的体积与晶胞体积之比为晶胞的空间利用率,用含π的代数式表示)。
(1)基态Cu原子中,核外电子占据最高能层的符号是
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,
表示,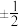 即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为(3)铜锰氧化物(
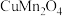 )能在常温下催化氧化甲醛(结构如图)生成甲酸。
)能在常温下催化氧化甲醛(结构如图)生成甲酸。
①
 键的类型是
键的类型是②气态时,测得甲酸的相对分子质量大于46,其原因可能是
(4)
 是有机催化剂,其溶液为天蓝色。
是有机催化剂,其溶液为天蓝色。①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则
 的杂化轨道类型为
的杂化轨道类型为A.
 B.sp C.
B.sp C. D.
D.
②
 的空间构型为
的空间构型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为(5)Co晶体堆积方式为六方最密堆积,其晶胞结构如图所示,已知Co的原子半径为r,该晶胞的空间利用率为

您最近一年使用:0次
2022-04-22更新
|
1131次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2022届高三第二次模拟考试理科综合化学试题
青海省西宁市大通回族土族自治县2022届高三第二次模拟考试理科综合化学试题河北省部分学校2022届高三4月份联考化学试题河北省秦皇岛市2022届高三二模化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
7 . 某化学兴趣小组对有关SO2性质进行如下探究活动。___________ ,装置A中发生反应的化学方程式为___________ 。
(2)①B中品红溶液褪色,是因为SO2具有___________ (填“氧化”“还原”或“漂白”,下同)性,C装置中酸性KMnO4溶液褪色,表明SO2具有___________ 性。
②证明亚硫酸酸性比碳酸酸性强的实验现象是___________ ;
③若将SO2气体直接通入澄清石灰水中,溶液变浑浊,则该反应的离子方程式为___________ 。
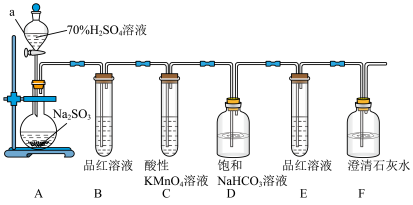
(2)①B中品红溶液褪色,是因为SO2具有
②证明亚硫酸酸性比碳酸酸性强的实验现象是
③若将SO2气体直接通入澄清石灰水中,溶液变浑浊,则该反应的离子方程式为
您最近一年使用:0次
2022-01-03更新
|
2155次组卷
|
8卷引用:青海省西宁市第五中学2023-2024学年高一下学期4月月考化学试题
青海省西宁市第五中学2023-2024学年高一下学期4月月考化学试题湖南师范大学附属中学2020-2021学年高一上学期期末考试化学试题广东省揭阳市普宁市华侨中学2021—2022学年高一下学期第一次月考化学科试题(已下线)第04练 常见气体的制备与性质实验-2022年【暑假分层作业】高一化学(人教版2019必修第二册)四川省宜宾市叙州区第一中学校2022-2023学年高一下学期开学考试化学试题第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第五章 化工生产中的重要非金属元素【单元测试A卷】广东实验中学越秀学校2023-2024学年高一3月段考化学试题
名校
8 . 硫脲[ ]是一种白色且具有光泽的晶体,熔点:176~178℃,温度过高时分解,易潮解,易溶于水,微溶于乙醚,常用于制造药物、染料、树脂、压塑粉等。实验室可通过硫氢化钙[
]是一种白色且具有光泽的晶体,熔点:176~178℃,温度过高时分解,易潮解,易溶于水,微溶于乙醚,常用于制造药物、染料、树脂、压塑粉等。实验室可通过硫氢化钙[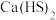 ]和氰氨化钙(
]和氰氨化钙( )制备硫脲,按要求回答问题。
)制备硫脲,按要求回答问题。
(1)制备硫氢化钙悬浊液,装置如图甲所示。
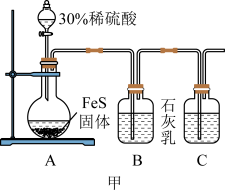
①装置A的作用为_______ 。
②为加快反应速率,可适当增加硫酸浓度,但硫酸浓度不能过大,原因是_______ 。
③装置B中发生反应的离子方程式为_______ 。
(2)备硫脲。将制得的硫氢化钙悬浊液转移到加热容器中,再加入氰氨化钙,在(80±5)℃下反应3h,制备硫脲粗品,制备装置如图乙所示。
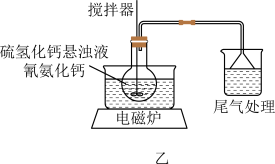
①温度控制在(80±5)℃的加热方式为_______ 。
②制备硫脲的化学方程式为_______ (只有两种生成物)。
③已知氰氨化钙遇水生成一种无色、具有强烈刺激性气味的气体,请设计简单实验证明处理的尾气的主要成分:_______ 。
(3)分离提纯硫脲。将反应所得的悬浊液减压过滤,再将滤液蒸发浓缩、趁热过滤、冷却结晶,离心脱水干燥得到硫脲晶体。
①采用离心脱水干燥而不用加热干燥的原因是_______ 。
②制备 时所用原料为13.2gFeS,最终制得硫脲1.74g,硫脲的产率为
时所用原料为13.2gFeS,最终制得硫脲1.74g,硫脲的产率为_______ (保留3位有效数字)。
 ]是一种白色且具有光泽的晶体,熔点:176~178℃,温度过高时分解,易潮解,易溶于水,微溶于乙醚,常用于制造药物、染料、树脂、压塑粉等。实验室可通过硫氢化钙[
]是一种白色且具有光泽的晶体,熔点:176~178℃,温度过高时分解,易潮解,易溶于水,微溶于乙醚,常用于制造药物、染料、树脂、压塑粉等。实验室可通过硫氢化钙[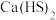 ]和氰氨化钙(
]和氰氨化钙( )制备硫脲,按要求回答问题。
)制备硫脲,按要求回答问题。(1)制备硫氢化钙悬浊液,装置如图甲所示。

①装置A的作用为
②为加快反应速率,可适当增加硫酸浓度,但硫酸浓度不能过大,原因是
③装置B中发生反应的离子方程式为
(2)备硫脲。将制得的硫氢化钙悬浊液转移到加热容器中,再加入氰氨化钙,在(80±5)℃下反应3h,制备硫脲粗品,制备装置如图乙所示。

①温度控制在(80±5)℃的加热方式为
②制备硫脲的化学方程式为
③已知氰氨化钙遇水生成一种无色、具有强烈刺激性气味的气体,请设计简单实验证明处理的尾气的主要成分:
(3)分离提纯硫脲。将反应所得的悬浊液减压过滤,再将滤液蒸发浓缩、趁热过滤、冷却结晶,离心脱水干燥得到硫脲晶体。
①采用离心脱水干燥而不用加热干燥的原因是
②制备
 时所用原料为13.2gFeS,最终制得硫脲1.74g,硫脲的产率为
时所用原料为13.2gFeS,最终制得硫脲1.74g,硫脲的产率为
您最近一年使用:0次
2023-02-21更新
|
1102次组卷
|
3卷引用:青海省西宁市2023届高三一模理科综合化学试题
9 . 自2021年美国央行的大量放水,大宗原材料价格猛涨,企业十分重视提高原材料的利用率。某大型企业以工业烧渣(主要含ZnO,还含少量Fe3O4、Al2O3、CuO及SiO2等)为原料制取有机高分子材料的阻燃剂一磷酸锌[Zn3(PO4)2]的工艺流程如图所示。
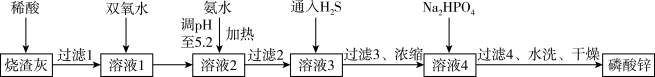
已知:室温下,几种金属离子开始沉淀与沉淀完全的pH如下表所示。
(1)在180 °C对“烧渣灰”进行酸溶最适合的酸是_______ (填“盐酸”、“硫酸”或“硝酸”)。
(2)加入双氧水的作用是作氧化剂,则发生反应的化学方程式为_______ ;可用NaClO代替双氧水,两者相比,_______ (填化学式)的氧化效率更高。(氧化效率以单位质量的氧化剂得到的电子数表示)
(3)加氨水过程中加热的目的是_______ ;“过滤2”得到的滤渣的主要成分为_______ (填化学式)。
(4)通入H2S的目的是_______ ;加入Na2 HPO4发生反应的离子方程式为_______ 。
(5)确认磷酸锌洗涤干净的操作是_______ 。
(6)在通入H2S之前,“溶液3”中A13+的浓度为_______ mol·L-1。

已知:室温下,几种金属离子开始沉淀与沉淀完全的pH如下表所示。
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.7 | 2.2 | 5.2 | 6.5 |
| 沉淀完全(c=1.0×10-5mol· L-1)的pH | 4.7 | 3.2 | 6.7 | 8.0 |
(2)加入双氧水的作用是作氧化剂,则发生反应的化学方程式为
(3)加氨水过程中加热的目的是
(4)通入H2S的目的是
(5)确认磷酸锌洗涤干净的操作是
(6)在通入H2S之前,“溶液3”中A13+的浓度为
您最近一年使用:0次
10 . 化合物H是一种新型树脂材料,工业上由正庚烷制备H的一条路线如下:
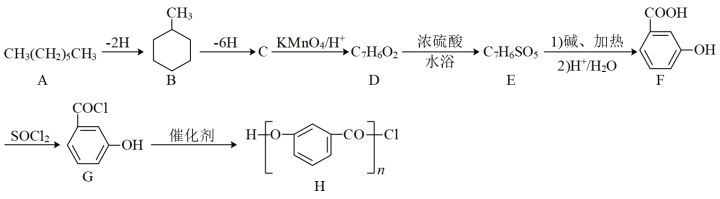
请回答下列问题:
(1)C的结构简式为_______ ;B的化学名称为_______ 。
(2)F所含的官能团的名称是_______ 。
(3)由G生成H的反应类型是_______ 。
(4)由D生成E的化学方程式为_______ 。
(5)X是D的同分异构体,符合下列条件的X的结构有_______ 种,请写出其中核磁共振氢谱峰面积比为1:1:1的结构简式_______ (只写一种)。
a.分子中含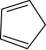
b.能发生银镜反应,且1 mol X最多能生成432 g Ag
(6)请以正己烷、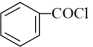 为原料(无机试剂任选),设计制备化合物
为原料(无机试剂任选),设计制备化合物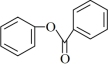 的合成路线。
的合成路线。_______

请回答下列问题:
(1)C的结构简式为
(2)F所含的官能团的名称是
(3)由G生成H的反应类型是
(4)由D生成E的化学方程式为
(5)X是D的同分异构体,符合下列条件的X的结构有
a.分子中含

b.能发生银镜反应,且1 mol X最多能生成432 g Ag
(6)请以正己烷、
 为原料(无机试剂任选),设计制备化合物
为原料(无机试剂任选),设计制备化合物 的合成路线。
的合成路线。
您最近一年使用:0次
2022-05-04更新
|
892次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2022届高三第二次模拟考试理科综合化学试题



