名校
解题方法
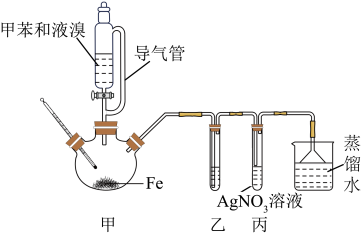
1 . 对溴甲苯( )是一种有机合成原料,广泛应用于医药合成。实验室中对溴甲苯可由甲苯和溴反应制得,装置如图所示。
)是一种有机合成原料,广泛应用于医药合成。实验室中对溴甲苯可由甲苯和溴反应制得,装置如图所示。
| 甲苯 | 溴 | 对溴甲苯 | |
| 沸点/℃ | 110 | 59 | 184 |
| 水溶性 | 难溶 | 微溶 | 难溶 |
(1)装置甲中导气管的作用是
(2)装置甲中生成对溴甲苯的化学方程式为
(3)要证明装置甲中发生的是取代反应,而不是加成反应,试管乙中盛放的试剂名称为
(4)装置甲中反应后的混合物,经过下列步骤分离提纯:
①
②滤液依次用水、8 mL 10%的NaOH溶液、水洗涤。NaOH溶液洗涤的作用是除去HBr和未反应的
 ,写出除
,写出除 的离子方程式:
的离子方程式:③用
A.重结晶 B.过滤 C.蒸馏 D.萃取 E.分液
您最近一年使用:0次
名校
解题方法
2 . 铝的化合物在化工、医药、材料等方面应用广泛。回答下列问题:
(1) 分子中心原子的杂化方式为
分子中心原子的杂化方式为_______ ,其空间结构为_______ 。
(2) 属于
属于_______ (填“极性”或“非极性”)分子,其熔点低于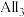 ,原因是
,原因是_______ 。
(3) (共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。
(共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。 晶胞中含有
晶胞中含有_______ 个Al,其配位数为_______ 。
②熔融 晶体,需要破坏的作用力是
晶体,需要破坏的作用力是_______ 。
③若 晶体的密度为
晶体的密度为 ,其晶胞参数为
,其晶胞参数为_______ nm(设 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)
 分子中心原子的杂化方式为
分子中心原子的杂化方式为(2)
 属于
属于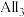 ,原因是
,原因是(3)
 (共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。
(共价化合物,高熔、沸点)是良好的耐热冲击材料,其晶胞结构如图所示。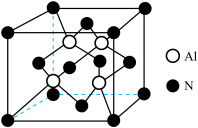
 晶胞中含有
晶胞中含有②熔融
 晶体,需要破坏的作用力是
晶体,需要破坏的作用力是③若
 晶体的密度为
晶体的密度为 ,其晶胞参数为
,其晶胞参数为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
3 . 实验室由安息香(M=212g/mol)制备二苯乙二酮(M=210g/mol)的反应式如下:
装置示意图如下图所示,实验步骤为:
②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min
③加入50mL水,煮沸后冷却,有黄色固体析出
④过滤,并用冷水洗涤固体3次,得到粗品
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g
回答下列问题:
(1)仪器B的作用是_______ ;冷却水应_______ (填“a”或“b”)口流出。
(2)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_______ 。
(3)在本实验中,FeCl3为氧化剂且过量,其还原产物为_______ ;某同学尝试改进本实验:
采用催化量的FeCl3并通入空气制备二苯乙二酮,该方法的优点是_______ 。
(4)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是_______ 。
(5)若粗品中混有少量未氧化的安息香,可用少量_______ 洗涤的方法除去(填标号)。
a.冷水 b.热水 c.乙酸 d.乙醇
若要得到更高纯度的产品,可用_______ 的方法进一步提纯。
(6)本实验的产率最接近于_______ (填标号)。
a.85% b.80% c.75% d.70%

| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 安息香 | 白色固体 | 133 | 344 | 难溶于冷水、溶于热水、乙醇、乙酸 |
二苯乙二酮 | 淡黄色固体 | 95 | 347 | 不溶于水、溶于乙醇、苯、乙酸 |
| 冰乙酸 | 无色液体 | 17 | 118 | 与水、乙醇互溶 |

②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min
③加入50mL水,煮沸后冷却,有黄色固体析出
④过滤,并用冷水洗涤固体3次,得到粗品
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g
回答下列问题:
(1)仪器B的作用是
(2)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是
(3)在本实验中,FeCl3为氧化剂且过量,其还原产物为
采用催化量的FeCl3并通入空气制备二苯乙二酮,该方法的优点是
(4)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是
(5)若粗品中混有少量未氧化的安息香,可用少量
a.冷水 b.热水 c.乙酸 d.乙醇
若要得到更高纯度的产品,可用
(6)本实验的产率最接近于
a.85% b.80% c.75% d.70%
您最近一年使用:0次
名校
4 . 现有4.1g含杂质的烧碱样品,某小组同学为测定其纯度,将其配制成250mL待测液,准确量取10.00mL待测液,并用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液(假设烧碱中不含有与酸反应的杂质),试根据实验回答。
(1)在上述溶液配制与滴定过程中,不需要用到的实验仪器是___________。
(2)选用___________ 为指示剂,滴定终点的判断依据是___________ 。
(3)根据表中数据,计算样品烧碱的质量分数为___________ (结果保留两位有效数字)。
(4)滴定过程,下列情况会使测定结果偏高的是___________。
(1)在上述溶液配制与滴定过程中,不需要用到的实验仪器是___________。
A. | B. | C. | D. |
(3)根据表中数据,计算样品烧碱的质量分数为
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| A.量取待测液的滴定管水洗后,直接用来量取待测液 |
| B.滴定前,滴定管有气泡,滴定后消失 |
| C.滴定过程中振荡锥形瓶时不慎有少量液体溅出 |
| D.盛装待测液的锥形瓶水洗后未烘干 |
您最近一年使用:0次
名校
解题方法
5 . 有机反应一般速率较小,副反应多,产物复杂。
(1)常见的有机反应装置示意图,如下所示:_________ (填上图装置序号)。
②装置C可以做1-溴丙烷的水解反应实验,该反应的化学方程式为______________ 。
③实验室可用装置D制溴苯,下列有关说法不正确 的是_________ (填字母)。
a.圆底烧瓶中所装试剂为苯和浓溴水
b.冷凝管的作用是导气和冷凝回流,可以提高原料利用率
c.停止反应后,可直接通过分液将溴苯与苯分离
④写出上述①~③实验中消去反应的化学方程式:________________ 。
(2)检验反应的产物是判断有机反应类型的主要方法。下面是关于1-溴丙烷的实验及产物检验。
步骤I:向试管中加入少量1-溴丙烷,再加入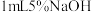 溶液,充分振荡,观察到溶液分为两层。
溶液,充分振荡,观察到溶液分为两层。
步骤Ⅱ:稍微加热一段时间后,冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴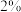 的
的 溶液。
溶液。
步骤Ⅲ:将下层液体取出,分离主要得到两种物质。经核磁共报氢谱验证,物质1分子中含有四种不同化学环境的H原子,其个数比为 ,物质2分子中含有三种不同化学环境的H原子,其个数比为
,物质2分子中含有三种不同化学环境的H原子,其个数比为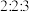 。
。
①步骤I中,1-溴丙烷主要存在于溶液的_________ 层(填“上”或“下”)。
②步骤Ⅱ中,试剂a为_________ ,加入 溶液后观察到的现象为
溶液后观察到的现象为__________________ 。
Ⅲ③写出步骤中物质2的结构简式:__________________ 。
④综合分析上述实验,实验中发生了取代反应,判断的理由是__________________ 。
(1)常见的有机反应装置示意图,如下所示:
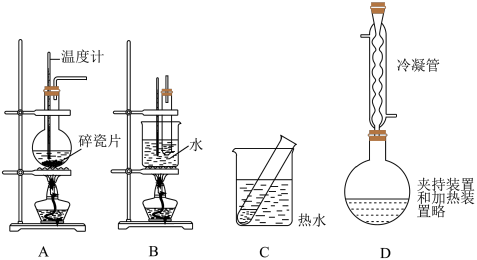
②装置C可以做1-溴丙烷的水解反应实验,该反应的化学方程式为
③实验室可用装置D制溴苯,下列有关说法
a.圆底烧瓶中所装试剂为苯和浓溴水
b.冷凝管的作用是导气和冷凝回流,可以提高原料利用率
c.停止反应后,可直接通过分液将溴苯与苯分离
④写出上述①~③实验中消去反应的化学方程式:
(2)检验反应的产物是判断有机反应类型的主要方法。下面是关于1-溴丙烷的实验及产物检验。
步骤I:向试管中加入少量1-溴丙烷,再加入
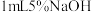 溶液,充分振荡,观察到溶液分为两层。
溶液,充分振荡,观察到溶液分为两层。步骤Ⅱ:稍微加热一段时间后,冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴
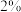 的
的 溶液。
溶液。步骤Ⅲ:将下层液体取出,分离主要得到两种物质。经核磁共报氢谱验证,物质1分子中含有四种不同化学环境的H原子,其个数比为
 ,物质2分子中含有三种不同化学环境的H原子,其个数比为
,物质2分子中含有三种不同化学环境的H原子,其个数比为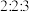 。
。①步骤I中,1-溴丙烷主要存在于溶液的
②步骤Ⅱ中,试剂a为
 溶液后观察到的现象为
溶液后观察到的现象为Ⅲ③写出步骤中物质2的结构简式:
④综合分析上述实验,实验中发生了取代反应,判断的理由是
您最近一年使用:0次
6 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
名校
解题方法
7 . 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下,它是无色油状液体,密度为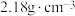 ,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示:
,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示:
(1)向装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入_______ ,烧瓶内发生反应的化学方程式为_______ 。
(2)装置B的作用是_______ ;实验进行时若装置D中长导管发生堵塞,此时装置B中的现象为_______ 。
(3)装置C中盛有10%的 溶液,其作用是
溶液,其作用是_______ 。
(4)开始反应时需向装置D中的烧杯里加入冰水,这是为了_______ ;烧杯中试管内发生反应的化学方程式是_______ 。
(5)进行此实验时,装置D中试管内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为_______ 。
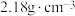 ,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示:
,沸点为131.4℃,熔点为9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如图所示: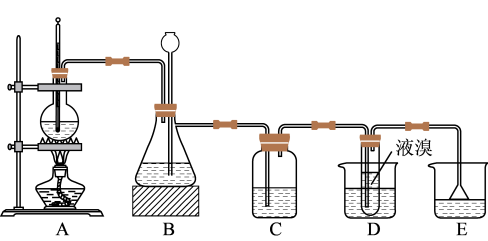
(1)向装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入
(2)装置B的作用是
(3)装置C中盛有10%的
 溶液,其作用是
溶液,其作用是(4)开始反应时需向装置D中的烧杯里加入冰水,这是为了
(5)进行此实验时,装置D中试管内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为
您最近一年使用:0次
名校
解题方法
8 . 有机物的种类繁多,在日常生活中有重要的用途。请回答下列问题:
(1)键线式 表示的分子式
表示的分子式______ ,系统命名法名称是______ 。
(2) 中含有的官能团的名称为
中含有的官能团的名称为______ 、______ 。
(3)A~G是几种烃的分子球棍模型(如图),据此回答下列问题:______ (填标号,下同),常温下,含碳量最高的烃有______ ,能够发生加成反应的气态烃是______ 。
②写出C发生加聚反应的化学方程式:______ 。
③写出G生成三硝基取代物的化学方程式:______ 。
(4)有机物M(CH2=CH-CH=CH2)是合成顺丁橡胶的单体
①M的实验式为______ 。其二溴代物共有______ 种。
②发生1,4-加聚反应,得到顺丁橡胶(顺式结构产物)的反应方程式是______ 。
(1)键线式
 表示的分子式
表示的分子式(2)
 中含有的官能团的名称为
中含有的官能团的名称为(3)A~G是几种烃的分子球棍模型(如图),据此回答下列问题:

②写出C发生加聚反应的化学方程式:
③写出G生成三硝基取代物的化学方程式:
(4)有机物M(CH2=CH-CH=CH2)是合成顺丁橡胶的单体
①M的实验式为
②发生1,4-加聚反应,得到顺丁橡胶(顺式结构产物)的反应方程式是
您最近一年使用:0次
名校
解题方法
9 . 铜是人类最早使用的金属之一,最近科学家发现Cu元素有很强的杀菌作用,还可代替 布线在硅芯片上。用黄铜矿(主要成分为
布线在硅芯片上。用黄铜矿(主要成分为 )生产粗铜,其反应原理如下:
)生产粗铜,其反应原理如下:
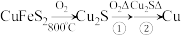
回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。 的熔点
的熔点___________  的熔点(填写“<”、“>”或“=”)。
的熔点(填写“<”、“>”或“=”)。
(2)反应①、②中生成的气体 ,
, 分子的
分子的 模型为
模型为___________ (填名称)。
(3) 能与
能与 形成配位数为4的配合物,向
形成配位数为4的配合物,向 溶液中加入氨水,最终形成配合物
溶液中加入氨水,最终形成配合物 。请判断:
。请判断: 中存在的化学键的类型有
中存在的化学键的类型有___________ (填序号)。
a.离子键 b.金属键 c.配位键 d.非极性共价键 e.极性共价键
(4)如图是铜的一种氧化物晶体的晶胞结构。该化合物的化学式为___________ ,每个 原子周围与它最近且等距离的
原子周围与它最近且等距离的 原子有
原子有___________ 个,每个 原子周围与它最近且等距离的
原子周围与它最近且等距离的 原子有
原子有___________ 个。
 布线在硅芯片上。用黄铜矿(主要成分为
布线在硅芯片上。用黄铜矿(主要成分为 )生产粗铜,其反应原理如下:
)生产粗铜,其反应原理如下: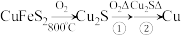
回答下列问题:
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 的熔点
的熔点 的熔点(填写“<”、“>”或“=”)。
的熔点(填写“<”、“>”或“=”)。(2)反应①、②中生成的气体
 ,
, 分子的
分子的 模型为
模型为(3)
 能与
能与 形成配位数为4的配合物,向
形成配位数为4的配合物,向 溶液中加入氨水,最终形成配合物
溶液中加入氨水,最终形成配合物 。请判断:
。请判断: 中存在的化学键的类型有
中存在的化学键的类型有a.离子键 b.金属键 c.配位键 d.非极性共价键 e.极性共价键
(4)如图是铜的一种氧化物晶体的晶胞结构。该化合物的化学式为
 原子周围与它最近且等距离的
原子周围与它最近且等距离的 原子有
原子有 原子周围与它最近且等距离的
原子周围与它最近且等距离的 原子有
原子有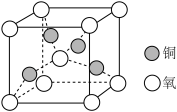
您最近一年使用:0次
名校
10 . 按要求填空。
(1)等质量的 Zn粉分别投入pH=1 体积均为10ml的试管A(盐酸)和试管B (醋酸)中,开始时反应速率A___________ B(填>,=,<),若Zn过量,产生H2的体积A___________ B(填>,=,<)。
(2)有以下物质:
① 溶液、②干冰、③液态HCl、④铜、⑤
溶液、②干冰、③液态HCl、④铜、⑤ 固体、⑥蔗糖、⑦
固体、⑥蔗糖、⑦ 、⑧
、⑧ 固体、⑨盐酸、⑩
固体、⑨盐酸、⑩
属于强电解质的是___________ (填序号,下同)﹔属于非电解质的是___________ 。
(3)理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________ 。
(4)SO2(g)+2H2S(g) =3S(s)+2H2O(l) ΔH<0,该反应熵变ΔS___________ 0,该反应自发进行的条件是___________ (填“低温”“高温”或“任意温度”)。
(5)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO 水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)___________ 。
(1)等质量的 Zn粉分别投入pH=1 体积均为10ml的试管A(盐酸)和试管B (醋酸)中,开始时反应速率A
(2)有以下物质:
①
 溶液、②干冰、③液态HCl、④铜、⑤
溶液、②干冰、③液态HCl、④铜、⑤ 固体、⑥蔗糖、⑦
固体、⑥蔗糖、⑦ 、⑧
、⑧ 固体、⑨盐酸、⑩
固体、⑨盐酸、⑩
属于强电解质的是
(3)理论上强酸强碱的中和热为57.3kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式
(4)SO2(g)+2H2S(g) =3S(s)+2H2O(l) ΔH<0,该反应熵变ΔS
(5)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO
 水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
您最近一年使用:0次



