1 . 二氯二氢硅(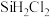 )常用于外延法工艺中重要的硅源。该物质易燃、有毒,与水接触易水解,沸点为8.2℃。在铜催化作用下,HCl与硅在250~260℃反应可以制得
)常用于外延法工艺中重要的硅源。该物质易燃、有毒,与水接触易水解,沸点为8.2℃。在铜催化作用下,HCl与硅在250~260℃反应可以制得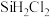 。
。___________ 性。
(2)D装置中生成二氯二氢硅的化学方程式为___________ 。
(3)按照气体从左到右的方向,制取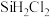 的装置(h处用止水夹夹好)连接顺序为
的装置(h处用止水夹夹好)连接顺序为___________ 。
a→( )→( )→( )→( )→( )→( )→( )(填仪器接口的字母,其中装置C用到2次)
(4)按从左到右的顺序,前面装置C中装的药品为___________ ,后面装置C的作用为___________ 。
(5)反应除生成二氯二氢硅之外,还会生成 和
和___________ 、___________ 等。
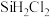 )常用于外延法工艺中重要的硅源。该物质易燃、有毒,与水接触易水解,沸点为8.2℃。在铜催化作用下,HCl与硅在250~260℃反应可以制得
)常用于外延法工艺中重要的硅源。该物质易燃、有毒,与水接触易水解,沸点为8.2℃。在铜催化作用下,HCl与硅在250~260℃反应可以制得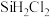 。
。
(2)D装置中生成二氯二氢硅的化学方程式为
(3)按照气体从左到右的方向,制取
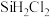 的装置(h处用止水夹夹好)连接顺序为
的装置(h处用止水夹夹好)连接顺序为a→( )→( )→( )→( )→( )→( )→( )(填仪器接口的字母,其中装置C用到2次)
(4)按从左到右的顺序,前面装置C中装的药品为
(5)反应除生成二氯二氢硅之外,还会生成
 和
和
您最近一年使用:0次
2 . 雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物 和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。
和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。 溶液中的离子浓度由大到小顺序是
溶液中的离子浓度由大到小顺序是___________ 。
(2)①已知: 生成
生成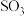 总反应的化学方程式是
总反应的化学方程式是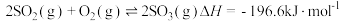 ,此反应可通过如下两步完成:
,此反应可通过如下两步完成: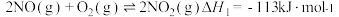 ;
;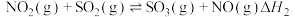 。则
。则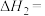
___________ 。
②一定温度下,向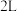 恒容密闭容器中充入
恒容密闭容器中充入 和
和 各
各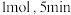 达到平衡,此时容器中
达到平衡,此时容器中 和
和 的浓度之比为
的浓度之比为 ,则
,则 的平衡转化率是
的平衡转化率是___________ 。
(3) 属于酸性氧化物,将其通入
属于酸性氧化物,将其通入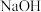 溶液中,得到
溶液中,得到 溶液。
溶液。
① 溶液呈酸性,其原因是
溶液呈酸性,其原因是___________ 。
②向 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的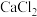 溶液,溶液中出现浑浊,
溶液,溶液中出现浑浊, 降为2,用化学平衡移动原理解释溶液
降为2,用化学平衡移动原理解释溶液 降低的原因:
降低的原因:___________ 。
(4)通过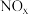 传感器可监测
传感器可监测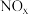 的含量,其工作原理示意图如图。
的含量,其工作原理示意图如图。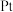 电极上发生的是
电极上发生的是___________ (填“氧化”或“还原”)反应。
②写出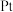 电极的电极反应式:
电极的电极反应式:___________ 。
③写出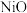 电极的电极反应式:
电极的电极反应式:___________ 。
 和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。
和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如图所示。
 溶液中的离子浓度由大到小顺序是
溶液中的离子浓度由大到小顺序是(2)①已知:
 生成
生成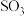 总反应的化学方程式是
总反应的化学方程式是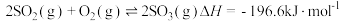 ,此反应可通过如下两步完成:
,此反应可通过如下两步完成: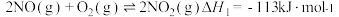 ;
;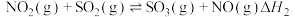 。则
。则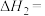
②一定温度下,向
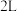 恒容密闭容器中充入
恒容密闭容器中充入 和
和 各
各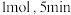 达到平衡,此时容器中
达到平衡,此时容器中 和
和 的浓度之比为
的浓度之比为 ,则
,则 的平衡转化率是
的平衡转化率是(3)
 属于酸性氧化物,将其通入
属于酸性氧化物,将其通入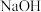 溶液中,得到
溶液中,得到 溶液。
溶液。①
 溶液呈酸性,其原因是
溶液呈酸性,其原因是②向
 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的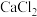 溶液,溶液中出现浑浊,
溶液,溶液中出现浑浊, 降为2,用化学平衡移动原理解释溶液
降为2,用化学平衡移动原理解释溶液 降低的原因:
降低的原因:(4)通过
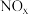 传感器可监测
传感器可监测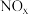 的含量,其工作原理示意图如图。
的含量,其工作原理示意图如图。
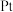 电极上发生的是
电极上发生的是②写出
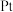 电极的电极反应式:
电极的电极反应式:③写出
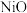 电极的电极反应式:
电极的电极反应式:
您最近一年使用:0次
名校
3 .  高效转化利用是实现“碳达峰”“碳中和”的重要一环。
高效转化利用是实现“碳达峰”“碳中和”的重要一环。 催化加氢制甲醇反应的方程式为:
催化加氢制甲醇反应的方程式为: 。回答下列问题:
。回答下列问题:
(1)写出一种能加快 催化加氢制甲醇反应速率的措施
催化加氢制甲醇反应速率的措施___________ 。
(2)在恒温、恒容的条件下,能说明反应已达平衡状态的___________。
(3)某温度下,在体积为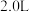 的密闭容器中,充入
的密闭容器中,充入 和
和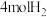 ,测得
,测得 、
、 的物质的量随时间变化如图:
的物质的量随时间变化如图: 末时的v正
末时的v正_________ v逆(填“>”“<或“=”,下同), 时的v正
时的v正___________ 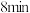 末时的v正。
末时的v正。
②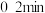 时间段内,
时间段内, 的平均反应速率=
的平均反应速率=___________ 。
③平衡时 的转化率=
的转化率=___________ , 实际产率=
实际产率=_________ 。
 高效转化利用是实现“碳达峰”“碳中和”的重要一环。
高效转化利用是实现“碳达峰”“碳中和”的重要一环。 催化加氢制甲醇反应的方程式为:
催化加氢制甲醇反应的方程式为: 。回答下列问题:
。回答下列问题:(1)写出一种能加快
 催化加氢制甲醇反应速率的措施
催化加氢制甲醇反应速率的措施(2)在恒温、恒容的条件下,能说明反应已达平衡状态的___________。
A. 体积分数保持不变 体积分数保持不变 | B.容器中 与 与 物质的量相等 物质的量相等 |
| C.容器内气体的密度不再变化 | D. 的生成速率与 的生成速率与 的生成速率相等 的生成速率相等 |
(3)某温度下,在体积为
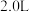 的密闭容器中,充入
的密闭容器中,充入 和
和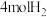 ,测得
,测得 、
、 的物质的量随时间变化如图:
的物质的量随时间变化如图:
 末时的v正
末时的v正 时的v正
时的v正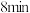 末时的v正。
末时的v正。②
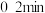 时间段内,
时间段内, 的平均反应速率=
的平均反应速率=③平衡时
 的转化率=
的转化率= 实际产率=
实际产率=
您最近一年使用:0次
4 . 已知A是一种气态烃,其密度在标准状况下是H2的14倍。下列关系图中部分产物可能略去,试回答下列问题: R—OH+NaX(R代表烃基,X代表卤素原子)。
R—OH+NaX(R代表烃基,X代表卤素原子)。
(1)写出A、C分子中的官能团名称:A__________ ,C__________ 。
(2)反应①~⑦中属于取代反应的是________ 。
(3)C与F以物质的量之比2∶1反应生成G,反应④的化学方程式为______________ 。
(4)B物质可在催化剂作用下被空气中的氧气氧化为具有刺激性气味的物质,写出反应的化学方程式:_________________ 。
(5)聚苯乙烯的结构简式为____________ 。
(6)下列说法正确的是________ (填字母)。
a.D在一定条件下可能会和水反应生成B和C
b.B和F互为同系物
c.A、B、F和I都能使酸性高锰酸钾溶液褪色
d.与E互为同分异构体的有机物只有1种

 R—OH+NaX(R代表烃基,X代表卤素原子)。
R—OH+NaX(R代表烃基,X代表卤素原子)。(1)写出A、C分子中的官能团名称:A
(2)反应①~⑦中属于取代反应的是
(3)C与F以物质的量之比2∶1反应生成G,反应④的化学方程式为
(4)B物质可在催化剂作用下被空气中的氧气氧化为具有刺激性气味的物质,写出反应的化学方程式:
(5)聚苯乙烯的结构简式为
(6)下列说法正确的是
a.D在一定条件下可能会和水反应生成B和C
b.B和F互为同系物
c.A、B、F和I都能使酸性高锰酸钾溶液褪色
d.与E互为同分异构体的有机物只有1种
您最近一年使用:0次
5 . 某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣(已除去葡萄糖溶液过滤得到的),对甘蔗渣进行综合利用不仅可以提高经济效益,而且还能防止环境污染。生产流程如图所示。 的产量可以用来衡量一个国家石油化学工业的发展水平,
的产量可以用来衡量一个国家石油化学工业的发展水平,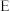 的分子中含有醛基,
的分子中含有醛基, 是具有香味的液体。完成下列各题。
是具有香味的液体。完成下列各题。
(1)A的名称为___________ ; 的名称为
的名称为___________ 。
(2)B的结构简式为___________ ; 的结构简式为
的结构简式为___________ , 的官能团名称为
的官能团名称为___________ 。
(3)写出 的化学方程式:
的化学方程式:___________ 。
(4)写出 的化学方程式:
的化学方程式:___________ 。
(5)写出 的同分异构体中与
的同分异构体中与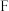 互为同系物的结构简式:
互为同系物的结构简式:___________ 。

 的产量可以用来衡量一个国家石油化学工业的发展水平,
的产量可以用来衡量一个国家石油化学工业的发展水平,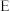 的分子中含有醛基,
的分子中含有醛基, 是具有香味的液体。完成下列各题。
是具有香味的液体。完成下列各题。(1)A的名称为
 的名称为
的名称为(2)B的结构简式为
 的结构简式为
的结构简式为 的官能团名称为
的官能团名称为(3)写出
 的化学方程式:
的化学方程式:(4)写出
 的化学方程式:
的化学方程式:(5)写出
 的同分异构体中与
的同分异构体中与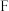 互为同系物的结构简式:
互为同系物的结构简式:
您最近一年使用:0次
6 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
(1)考古工作者利用表中某元素的一种核素测定一些文物的年代,这种核素的原子符号是________ 。
(2)由元素②和元素④形成原子个数比为1:2的化合物的电子式为________ 。
(3)元素⑦的最高价氧化物与元素⑥的最高价氧化物的水化物的水溶液反应的离子方程式为________ 。
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是________ (填化学式,用“>”连接)。
(5)元素④和⑥形成的淡黄色固体与元素①和④形成的常用化合物反应的离子方程式为________ 。
(6)将元素⑧的单质通入元素⑥和⑨形成的化合物水溶液中,观察到的现象是________ 。

(1)考古工作者利用表中某元素的一种核素测定一些文物的年代,这种核素的原子符号是
(2)由元素②和元素④形成原子个数比为1:2的化合物的电子式为
(3)元素⑦的最高价氧化物与元素⑥的最高价氧化物的水化物的水溶液反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)元素④和⑥形成的淡黄色固体与元素①和④形成的常用化合物反应的离子方程式为
(6)将元素⑧的单质通入元素⑥和⑨形成的化合物水溶液中,观察到的现象是
您最近一年使用:0次
名校
解题方法
7 . 以 作催化剂,可用乙烯脱除烟气中
作催化剂,可用乙烯脱除烟气中 并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的
并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的 ,实验装置(夹持装置已略)如图所示:
,实验装置(夹持装置已略)如图所示:
回答下列问题:
(1)装置a中的作用是___________ 。(答出2点即可)
(2)装置b中有S、 、
、 生成,则发生反应的化学方程式为
生成,则发生反应的化学方程式为___________ 。
(3)装置c用冷水水浴的目的是___________ 。
(4)有同学认为可将溴水换成酸性高锰酸钾溶液,你认为是否可行,说明你的理由___________ 。
(5)装置e中品红溶液的作用是___________ 。
 作催化剂,可用乙烯脱除烟气中
作催化剂,可用乙烯脱除烟气中 并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的
并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的 ,实验装置(夹持装置已略)如图所示:
,实验装置(夹持装置已略)如图所示: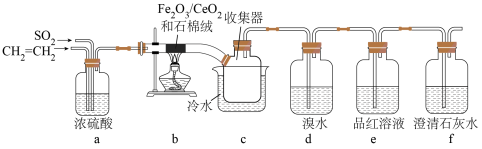
回答下列问题:
(1)装置a中的作用是
(2)装置b中有S、
 、
、 生成,则发生反应的化学方程式为
生成,则发生反应的化学方程式为(3)装置c用冷水水浴的目的是
(4)有同学认为可将溴水换成酸性高锰酸钾溶液,你认为是否可行,说明你的理由
(5)装置e中品红溶液的作用是
您最近一年使用:0次
名校
解题方法
8 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下农是实验过程中的数据及相关信息:
(注:气体体积均在相同条件下测得)
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为_______ mL;实验②和③探究_______ 对反应速率的影响。
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,目的是_______ (用文字表达)。
(3)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是_______ ,后期速率慢慢减小的主要原因是_______ 。
Ⅱ.研究NOx、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(4)一定温度下,在恒容的密闭容器中充入lmolCO和2molH2,发生CO(g)+ 2H2(g) CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
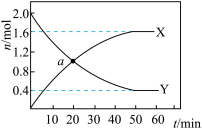
(5)利用反应2NO(g)+2CO(g) N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
①X代表的物质是_______ ;a点正反应速率_______ 逆反应速率(填“>”、“<”或“=”)。_______ 。
Ⅰ.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下农是实验过程中的数据及相关信息:
| 序号 | 反应温度/℃ | c(HCl)/(mol/L) | V(HCl)/mL | V(H2O)/mL | 10gFe的形状 | t/min |
| ① | 20 | 2 | 5 | V1 | 块状 | 1 |
| ② | 20 | 2 | 10 | 0 | 块状 | 1 |
| ③ | 20 | 2 | 10 | 0 | 粉末 | 1 |
| ④ | 40 | 2 | 10 | 0 | 块状 | 1 |
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,目的是
(3)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是
Ⅱ.研究NOx、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(4)一定温度下,在恒容的密闭容器中充入lmolCO和2molH2,发生CO(g)+ 2H2(g)
 CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。| A.反应过程中n(CO)∶n(H2)不变 |
| B.(升高温度,正反应速率减小 |
| C.往容器中充入He,压强增大,反应速率加快 |
| D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡 |
(5)利用反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。①X代表的物质是
您最近一年使用:0次
名校
解题方法
9 . 氮化铬(CrN)熔点高、硬度大,常用作耐磨材料。某小组在实验室用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬。已知:①CCl4的沸点是76.8℃;
②COCl2有毒,遇水生成HCl和CO2;③CrCl3易溶于水且易与水反应。
【实验一】制备无水氯化铬反应原理为: ,相关实验装置如下图(夹持装置略)。
,相关实验装置如下图(夹持装置略)。
a.水浴加热并维持A的温度在60~65℃
b.打开K,通入N2并保证锥形瓶中每分钟有250个左右的气泡逸出
c.点燃B处酒精喷灯,使瓷舟温度升至720℃左右,反应一定时间
d.一段时间后停止通入N2
e.先后停止加热A、B,冷却,并继续通入一段时间的N2
(1)上述操作步骤的先后顺序为:a→__________ 。
(2)A使用水浴加热的优点是_______ 。
(3)D中盛有过量NaOH溶液,用化学反应方程式说明D的作用:_______ 。
【实验二】制备氮化铬:其反应原理为 。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。
。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。_______ 。
(5)H中盛放碱石灰,其作用是_______ 。
(6)实验过程中需间歇性微热b处导管的目的是_______ 。(写出必要的化学方程式并解释)
②COCl2有毒,遇水生成HCl和CO2;③CrCl3易溶于水且易与水反应。
【实验一】制备无水氯化铬反应原理为:
 ,相关实验装置如下图(夹持装置略)。
,相关实验装置如下图(夹持装置略)。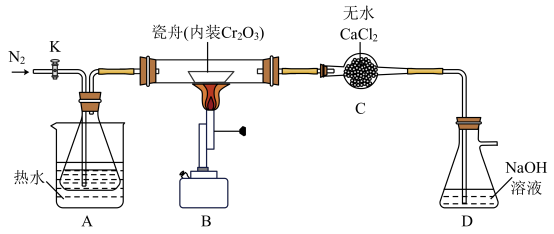
a.水浴加热并维持A的温度在60~65℃
b.打开K,通入N2并保证锥形瓶中每分钟有250个左右的气泡逸出
c.点燃B处酒精喷灯,使瓷舟温度升至720℃左右,反应一定时间
d.一段时间后停止通入N2
e.先后停止加热A、B,冷却,并继续通入一段时间的N2
(1)上述操作步骤的先后顺序为:a→
(2)A使用水浴加热的优点是
(3)D中盛有过量NaOH溶液,用化学反应方程式说明D的作用:
【实验二】制备氮化铬:其反应原理为
 。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。
。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。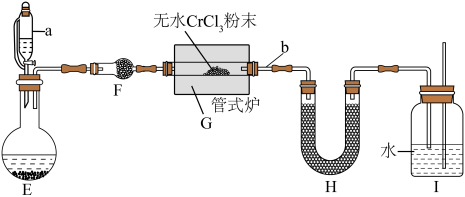
(5)H中盛放碱石灰,其作用是
(6)实验过程中需间歇性微热b处导管的目的是
您最近一年使用:0次
名校
10 . 化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大___________ min(填“0~1”、“1~2”、“2~3”、“3~4”或“4~5”)。
②另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为___________ ,溶液中H+移向___________ (填“正”或“负”)极。
(2)某温度下在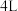 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:___________ mol/L,该反应的化学方程式是___________ 。
②5min时,Z的生成速率___________ (填“大于”、“小于”或“等于”)6min时Z的生成速率。
③若升高温度,则逆反应速率___________ (填“增大”、“减小”或“不变”)。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在
 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 109 | 220 | 332 | 412 | 480 |
②另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为
(2)某温度下在
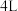 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
②5min时,Z的生成速率
③若升高温度,则逆反应速率
您最近一年使用:0次



