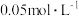1 . 某小组欲研究烷烃的某些性质设计下图实验装置。回答下列问题:
向如图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧两个弹簧夹,用光照射硬质玻璃管。
(1)B装置有三种功能:①均匀混合气体;②干燥混合气体;③___________ 。
(2)写出装置C中CH2Cl2与Cl2反应生成氯仿的化学方程式___________ 。
(3)一段时间后,C中玻璃管内的实验现象:___________ 、___________ 。
(4)若2molCH4与Cl2发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是___________ mol。
Ⅱ.某烃可以发生氧化反应
将0.2mol的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
(5)试写出该烃分子式___________ ,其同分异构体有___________ 种。

向如图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧两个弹簧夹,用光照射硬质玻璃管。
(1)B装置有三种功能:①均匀混合气体;②干燥混合气体;③
(2)写出装置C中CH2Cl2与Cl2反应生成氯仿的化学方程式
(3)一段时间后,C中玻璃管内的实验现象:
(4)若2molCH4与Cl2发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是
Ⅱ.某烃可以发生氧化反应
将0.2mol的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
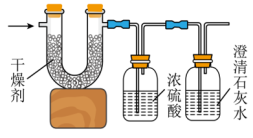
| 实验前 | 实验后 | |
| 实验前实验后(干燥剂+U形管)的质量 | 102.1g | 120.1g |
| (石灰水+广口瓶)的质量 | 310.0g | 345.2g |
(5)试写出该烃分子式
您最近一年使用:0次
名校
2 . 某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如图:
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是___________ 。
(2)“分解塔”中的温度不宜过高,其原因是___________ 。
(3)按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则“分解塔”中发生反应的化学方程式为___________ 。
(4)为提高氮氧化物的转化率,可向“尾气”中通入一定量的___________ 气体,再通入“吸收塔”中,实现循环吸收。
(5)NaNO2可将正常血红蛋白中的铁元素由+2价变为+3价,此时血红蛋白就失去了携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂,解毒剂美蓝体现___________ 性(填“氧化”或“还原”)。
(6)用NH3催化还原NOx还可以消除氮氧化物的污染。
① NH3电子式为:___________ 。
②已知:① 4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=a kJ· mol-1;
② N2(g)+O2(g)=2NO(g) ΔH2=b kJ· mol-1
则NH3还原NO至N2,则该反应的热化学方程式为:___________ 。

(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是
(2)“分解塔”中的温度不宜过高,其原因是
(3)按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则“分解塔”中发生反应的化学方程式为
(4)为提高氮氧化物的转化率,可向“尾气”中通入一定量的
(5)NaNO2可将正常血红蛋白中的铁元素由+2价变为+3价,此时血红蛋白就失去了携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂,解毒剂美蓝体现
(6)用NH3催化还原NOx还可以消除氮氧化物的污染。
① NH3电子式为:
②已知:① 4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=a kJ· mol-1;
② N2(g)+O2(g)=2NO(g) ΔH2=b kJ· mol-1
则NH3还原NO至N2,则该反应的热化学方程式为:
您最近一年使用:0次
名校
解题方法
3 . NaAlH4是常用的还原剂;Na2FeO4常做净水剂和消毒剂。工业上以制备硫酸的烧渣(主要成分为Fe3O4、Fe2O3和Al2O3含少量SiO2)为原料制备NaAlH4和Na2FeO4的流程如下:
(1)NaAlH4中氢的化合价为___________ 。
(2)浸渣的主要成分是___________ (填化学式);“转化”中Cl2的作用是___________ (用离子方程式表示)。
(3)由Fe(OH)3制备Na2FeO4的离子方程式为___________ ;“分离”中铝元素转化成___________ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是___________ 。
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为___________ 。
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为___________ (计算结果保留三位有效数字)。
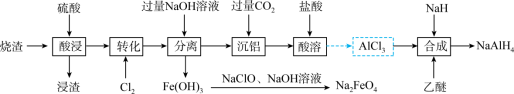
(1)NaAlH4中氢的化合价为
(2)浸渣的主要成分是
(3)由Fe(OH)3制备Na2FeO4的离子方程式为
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为
您最近一年使用:0次
7日内更新
|
109次组卷
|
2卷引用:重庆市万州二中2023-2024学年高一下学期期中考试化学试题
名校
4 . Ⅰ.某同学完成了如下系列实验,探究元素周期表中元素性质的递变规律.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:___________ 与硫酸反应速率最慢,___________ 与硫酸反应产生的气体最多;(填元素符号)
(2)向 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为___________ 。
Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证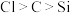 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为___________ 、___________ .该实验采用的理论依据为___________ ;
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:___________ ;
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂 .
. 为
为___________ (填“一”、“二”或“三”)元酸.
(6)不考虑产物的损失,标准状况下若有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成___________ 升 气体.
气体.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:
(2)向
 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证
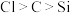 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂
 .
.
 为
为(6)不考虑产物的损失,标准状况下若有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成 气体.
气体.
您最近一年使用:0次
7日内更新
|
29次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一下学期5月期中考试化学试题
5 . 利用CO2合成甲醇(CH3OH)是实现碳中和的措施之一,其反应方程式为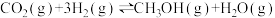 。回答下列问题:
。回答下列问题:
(1)CO2合成甲醇的能量变化如图所示。_______ 反应(填“放热”或“吸热”),反应物的化学键断裂所吸收的总能量_______ 生成物的化学键形成所释放的总能量(填“大于”或“小于”)。
(2)向2L恒容密闭容器中加入4molCO2、10molH2,恒温下发生反应,测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。_______ 逆反应速率(填“>”、“<”或“=”)。
②0~9min内,用H2表示的平均反应速率v(H2)=_______ mol·L-1·min-1。
③下列能说明反应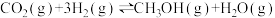 达到平衡状态的是
达到平衡状态的是_______ (填标号)。
A.混合气体的密度保持不变 B.3v正(CH3OH)=v逆(H2)
C.c(CH3OH)=c(H2O) D.2molC=O键断裂的同时生成3molH-H键
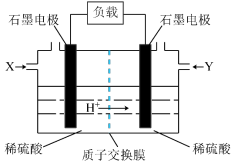
(3)以甲醇作燃料的燃料电池如图所示。_______ (填“甲醇”或“空气”);正极的电极反应式为_______ 。
②若有1molCO2生成,理论上通过质子交换膜的H+的物质的量为_______ 。
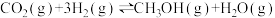 。回答下列问题:
。回答下列问题:(1)CO2合成甲醇的能量变化如图所示。

(2)向2L恒容密闭容器中加入4molCO2、10molH2,恒温下发生反应,测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。

②0~9min内,用H2表示的平均反应速率v(H2)=
③下列能说明反应
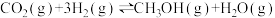 达到平衡状态的是
达到平衡状态的是A.混合气体的密度保持不变 B.3v正(CH3OH)=v逆(H2)
C.c(CH3OH)=c(H2O) D.2molC=O键断裂的同时生成3molH-H键
(3)以甲醇作燃料的燃料电池如图所示。
②若有1molCO2生成,理论上通过质子交换膜的H+的物质的量为
您最近一年使用:0次
名校
解题方法
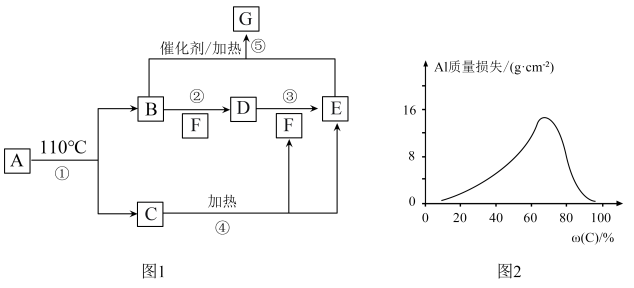
6 . A~G的转化关系如图1所示(部分产物略去),其中E为红棕色气体,G为单质。常温下,将Al片浸在不同质量分数的C溶液中,经过相同时间的腐蚀后,Al片的质量损失情况如图2所示。
(1)A的化学式为_______ 。
(2)实验室中常用_______ 检验B,现象是_______ 。
(3)反应④、⑤的化学方程式依次为_______ 、_______ 。
(4)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为_______ 。
(5)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68 LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5 mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是_______ mL。
(1)A的化学式为
(2)实验室中常用
(3)反应④、⑤的化学方程式依次为
(4)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为
(5)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68 LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5 mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是
您最近一年使用:0次
名校
解题方法
7 . I.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]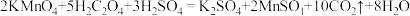
[实验内容及记录]
(1)请完成此实验设计,其中:
_______ ,
_______ 。
(2)实验①、②探究的是_______ 对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是_______ 。
(3)探究温度对化学反应速率的影响,应选择实验_______ (填实验编号)。
(4)利用实验①中的数据,计算用 表示的化学反应速率为
表示的化学反应速率为_______ 。
Ⅱ.某小组同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像 那样还原
那样还原 呢?他们设计实验制取氨气并探究上述问题:
呢?他们设计实验制取氨气并探究上述问题:
①制取氨气
(5)实验室除可用氯化铵和熟石灰制备氨气外,还有多种快速制氨气的方法,写出实验室用生石灰和浓氨水取氨气的化学方程式_______ 。
(6)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?_______ (填“能”或“否”),理由是_______ 。
②该小组中某同学设计了如下实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:_______ 。
(8)利用改进后的装置进行实验,观察到 变为红色物质,无水
变为红色物质,无水 变蓝色,同时生成一种无污染的气体。写出氨气与
变蓝色,同时生成一种无污染的气体。写出氨气与 反应的化学方程式
反应的化学方程式_______ 。
[实验原理]
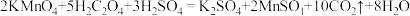
[实验内容及记录]
实验编号 | ① | ② | ③ | |
实验温度/ | 25 | 25 | 50 | |
试管中所加试剂及其用量/ |
| 3.0 | 2.0 | 2.0 |
|
| 3.0 |
| |
| 2.0 | 2.0 | 2.0 | |
| 3.0 | 3.0 | 3.0 | |
溶液褪至无色所需时间/ | 1.5 | 2.7 | 1.0 | |
(1)请完成此实验设计,其中:


(2)实验①、②探究的是
(3)探究温度对化学反应速率的影响,应选择实验
(4)利用实验①中的数据,计算用
 表示的化学反应速率为
表示的化学反应速率为Ⅱ.某小组同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像
 那样还原
那样还原 呢?他们设计实验制取氨气并探究上述问题:
呢?他们设计实验制取氨气并探究上述问题:①制取氨气
(5)实验室除可用氯化铵和熟石灰制备氨气外,还有多种快速制氨气的方法,写出实验室用生石灰和浓氨水取氨气的化学方程式
(6)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?
②该小组中某同学设计了如下实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
(8)利用改进后的装置进行实验,观察到
 变为红色物质,无水
变为红色物质,无水 变蓝色,同时生成一种无污染的气体。写出氨气与
变蓝色,同时生成一种无污染的气体。写出氨气与 反应的化学方程式
反应的化学方程式
您最近一年使用:0次
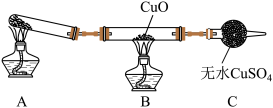
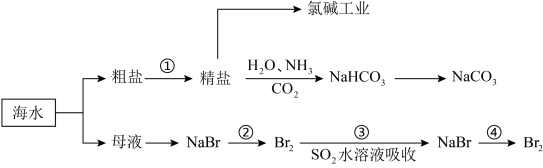
8 . 海洋中有丰富的矿产、能源、水产……等资源,部分化学资源获取途径如下:
(1)下列有关实验室模拟步骤①的说法正确的是_______ 。
a.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
b.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
c.当蒸发到剩有少量液体时停止加热,利用余热蒸干
d.制得的晶体转移到新过滤器中,需用大量水进行洗涤
(2)在海水提溴的实验中,通入热空气吹出Br2,利用了溴的_______ 性。
(3)步骤③反应的离子方程式为_______ 。
(4)下列有关说法正确的是_______ (填字母序号)。
a.在第②、④步骤中,溴元素均被氧化,在第③步骤中,溴元素被还原
b.用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.除去粗盐中Ca2+、Mg2+、 加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
d.海水中还含有碘元素,将海水中的碘升华可直接制备单质碘
Ⅱ.如图是从海水中提取镁的简单流程。_______ (填名称)。
②由无水MgCl2制取Mg的化学方程式是_______ 。
(1)下列有关实验室模拟步骤①的说法正确的是
a.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
b.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
c.当蒸发到剩有少量液体时停止加热,利用余热蒸干
d.制得的晶体转移到新过滤器中,需用大量水进行洗涤
(2)在海水提溴的实验中,通入热空气吹出Br2,利用了溴的
(3)步骤③反应的离子方程式为
(4)下列有关说法正确的是
a.在第②、④步骤中,溴元素均被氧化,在第③步骤中,溴元素被还原
b.用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.除去粗盐中Ca2+、Mg2+、
 加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
加入试剂的先后顺序为NaOH、BaCl2、Na2CO3d.海水中还含有碘元素,将海水中的碘升华可直接制备单质碘
Ⅱ.如图是从海水中提取镁的简单流程。

②由无水MgCl2制取Mg的化学方程式是
您最近一年使用:0次
名校
9 . 某化学兴趣小组用以下装置制备SO2并探究其部分性质。_______ ,装置B可贮存多余的SO2,B中试剂瓶内应盛放的液体是_______ 。
(2)若装置C中溶液无明显现象,装置D中溶液红色褪去,说明使品红水溶液褪色的含硫微粒是_______ (填化学式)。
(3)通入SO2后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为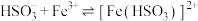 (红棕色)。
(红棕色)。
①溶液中产生 的离子方程式为
的离子方程式为_______ 。与该过程发生的其他化学反应相比, 与Fe3+反应生成[Fe(HSO3)]2+的活化能更
与Fe3+反应生成[Fe(HSO3)]2+的活化能更_______ (填“大”或“小”)。
②红棕色的[Fe(HSO3)]2+与Fe3+反应,溶液变成浅绿色,反应的离子方程式为_______ ;检验生成的阴离子的方法_______ 。
③为了缩短红棕色变为浅绿色的时间,该小组进行如下实验:
实验Ⅰ:往5 mL 1 mol/LFeCl3溶液中通入SO2,微热3分钟,溶液变为浅绿色。
实验Ⅱ:用浓盐酸酸化FeCl3溶液后再通入SO2,几分钟后,溶液变为浅绿色。
结论:通过_______ 可缩短浅绿色出现的时间。
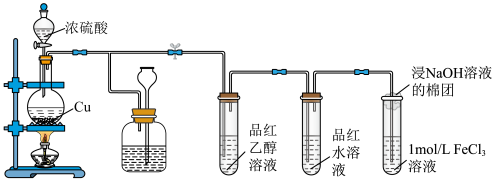
A B C D E
(1)装置A中制备SO2的化学反应方程式为(2)若装置C中溶液无明显现象,装置D中溶液红色褪去,说明使品红水溶液褪色的含硫微粒是
(3)通入SO2后,E中溶液立即由棕黄色变成红棕色,将混合液静置12小时后,溶液变成浅绿色。查阅资料,发现溶液出现红棕色是因为
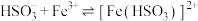 (红棕色)。
(红棕色)。①溶液中产生
 的离子方程式为
的离子方程式为 与Fe3+反应生成[Fe(HSO3)]2+的活化能更
与Fe3+反应生成[Fe(HSO3)]2+的活化能更②红棕色的[Fe(HSO3)]2+与Fe3+反应,溶液变成浅绿色,反应的离子方程式为
③为了缩短红棕色变为浅绿色的时间,该小组进行如下实验:
实验Ⅰ:往5 mL 1 mol/LFeCl3溶液中通入SO2,微热3分钟,溶液变为浅绿色。
实验Ⅱ:用浓盐酸酸化FeCl3溶液后再通入SO2,几分钟后,溶液变为浅绿色。
结论:通过
您最近一年使用:0次
10 . 我国力争2030年前实现碳达峰,2060年前实现碳中和。 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚(
加氢可转化为二甲醚( ),反应原理为
),反应原理为 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。
(1)该反应为_______ (填“放热”或“吸热”)反应。
(2)在固定体积的绝热密闭容器中发生该反应,能说明该反应达到平衡状态的是_______ (填字母)。
a. 的含量保持不变 c.容器内温度不变
的含量保持不变 c.容器内温度不变
b.混合气体的密度不变 d.混合气体的平均相对分子质量不变
e.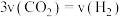
(3)恒温条件下,在体积为 密闭容器中充入
密闭容器中充入 和
和 ,测得
,测得 、
、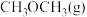 的物质的量随时间变化如图甲所示。
的物质的量随时间变化如图甲所示。
①反应到达 时,
时,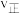
_______  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
②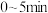 内,
内,
_______ 。
③反应达到平衡状态时,容器内的压强与起始压强之比为_______ 。
④“二甲醚( )酸性燃料电池”的工作原理示意图如图乙所示。
)酸性燃料电池”的工作原理示意图如图乙所示。
X电极为_______ (填“正”或“负”)极;X电极的电极反应式为_______ ;Y电极的电极反应式为_______ 。
 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚(
加氢可转化为二甲醚( ),反应原理为
),反应原理为 。该反应的能量变化如图所示。
。该反应的能量变化如图所示。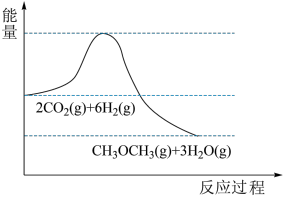
(1)该反应为
(2)在固定体积的绝热密闭容器中发生该反应,能说明该反应达到平衡状态的是
a.
 的含量保持不变 c.容器内温度不变
的含量保持不变 c.容器内温度不变b.混合气体的密度不变 d.混合气体的平均相对分子质量不变
e.
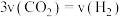
(3)恒温条件下,在体积为
 密闭容器中充入
密闭容器中充入 和
和 ,测得
,测得 、
、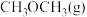 的物质的量随时间变化如图甲所示。
的物质的量随时间变化如图甲所示。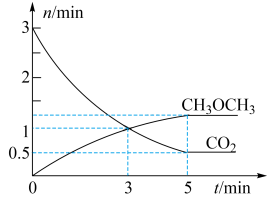
①反应到达
 时,
时,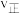
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。②
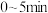 内,
内,
③反应达到平衡状态时,容器内的压强与起始压强之比为
④“二甲醚(
 )酸性燃料电池”的工作原理示意图如图乙所示。
)酸性燃料电池”的工作原理示意图如图乙所示。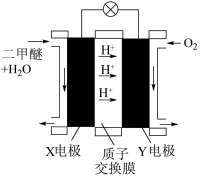
X电极为
您最近一年使用:0次




 溶液
溶液


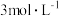 稀
稀 溶液
溶液