1 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:
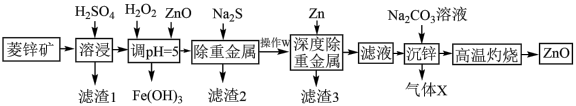
(1)写出Ni、Fe元素在周期表中的位置_______ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释_______ 。
(2)加入H2O2的目的是_______ ;“调pH”时除ZnO外还可以选用的物质是_______ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了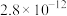 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为_______ 。证明Fe3+已除尽的化学方法是_______ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:_______ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为_______ 。
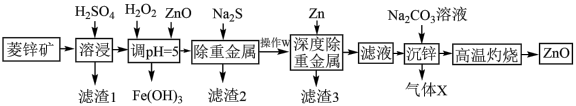
(1)写出Ni、Fe元素在周期表中的位置
(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
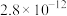 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为
您最近一年使用:0次
名校
2 . 三氯化铬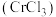 是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为,其实验装置如图所示:
的反应为,其实验装置如图所示:
已知:① (俗称光气)有毒,遇水发生水解;
(俗称光气)有毒,遇水发生水解;
②碱性条件下, 可将
可将 氧化为
氧化为 ;酸性条件下,
;酸性条件下, 将
将 还原为
还原为 。
。
回答下列问题:
(1)基态 原子的简化核外电子排布式为
原子的简化核外电子排布式为___________ 。
(2)无水 的作用是
的作用是___________ 。
(3)装置E用来收集产物。实验过程中若D处出现堵塞,可通过___________ (填操作方法)使实验继续进行。
(4)装置G中发生生成两种盐的反应的化学方程式为___________ 。
(5)测定产品中 质量分数的实验步骤如下:
质量分数的实验步骤如下:
I.取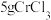 产品,在强碱性条件下,加入过量的
产品,在强碱性条件下,加入过量的 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;
II.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使 转化为
转化为 ,再加适量的蒸馏水将溶液稀释至
,再加适量的蒸馏水将溶液稀释至 ;
;
III.取 溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的
溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液
标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。
①该样品中 的质量分数为
的质量分数为___________  (保留小数点后两位,
(保留小数点后两位,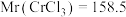 )
)
②下列操作将导致产品中 质量分数测定值偏低的是
质量分数测定值偏低的是___________ (填标号)。
A.步骤I中未继续加热一段时间
B.步骤III中所用 溶液已变质
溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
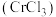 是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的反应为,其实验装置如图所示:
的反应为,其实验装置如图所示:
已知:①
 (俗称光气)有毒,遇水发生水解;
(俗称光气)有毒,遇水发生水解;②碱性条件下,
 可将
可将 氧化为
氧化为 ;酸性条件下,
;酸性条件下, 将
将 还原为
还原为 。
。回答下列问题:
(1)基态
 原子的简化核外电子排布式为
原子的简化核外电子排布式为(2)无水
 的作用是
的作用是(3)装置E用来收集产物。实验过程中若D处出现堵塞,可通过
(4)装置G中发生生成两种盐的反应的化学方程式为
(5)测定产品中
 质量分数的实验步骤如下:
质量分数的实验步骤如下:I.取
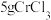 产品,在强碱性条件下,加入过量的
产品,在强碱性条件下,加入过量的 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;II.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使
 转化为
转化为 ,再加适量的蒸馏水将溶液稀释至
,再加适量的蒸馏水将溶液稀释至 ;
;III.取
 溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的
溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液
标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。①该样品中
 的质量分数为
的质量分数为 (保留小数点后两位,
(保留小数点后两位,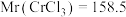 )
)②下列操作将导致产品中
 质量分数测定值偏低的是
质量分数测定值偏低的是A.步骤I中未继续加热一段时间
B.步骤III中所用
 溶液已变质
溶液已变质C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
名校
解题方法
3 . 草酸亚铁晶体(FeC2O4•2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。南宁三中实验小组对其进行了一系列探究。采用如图装置进行实验。
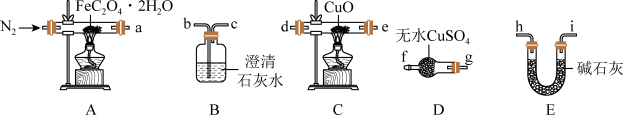
(1)为验证FeC2O4•2H2O的分解的气态产物,按照气流从左到右的方向,上述装置的连接顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(4)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol/LKMnO4标准溶液滴定至终点,消耗标准液V2mL。
①步骤2中滴定终点的现象为_______ ;步骤3加入锌粉的目的_______ 。
②该样品中草酸亚铁晶体的质量分数的计算式为_______ 。
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。

(1)为验证FeC2O4•2H2O的分解的气态产物,按照气流从左到右的方向,上述装置的连接顺序为A→
(2)实验证明了气体产物中含有CO,依据的实验现象为
(3)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(4)工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol/LKMnO4标准溶液滴定至终点,消耗标准液V2mL。
①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的计算式为
③若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
名校
解题方法
4 . 国庆期间,思源同学参观了2023上海新能源车展,他了解到目前新能源电车大部分使用的都是磷酸铁锂电池,草酸亚铁晶体( ,难溶于水)是制备磷酸铁锂正极材料所需的主要原材料。思源同学想在实验室里利用废铁屑制备草酸亚铁晶体(
,难溶于水)是制备磷酸铁锂正极材料所需的主要原材料。思源同学想在实验室里利用废铁屑制备草酸亚铁晶体( )并测定产品的纯度。请帮助他一起完成探究!
)并测定产品的纯度。请帮助他一起完成探究!
Ⅰ.草酸亚铁晶体( )的制备:
)的制备:
(1)实验前的准备——药品的选择与处理
为了防止制备的硫酸亚铁溶液变质,制备过程中应采取的措施是______ 。
(2)实验过程中——操作与观察
思源同学选取了如图所示装置,在实验过程中,往装置中不断通入 ,其目的有:
,其目的有:______ 、______ (结合实验装置回答,至少答出两点)。
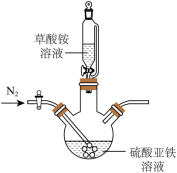
(3)反应结束后——产物的分离与后处理
反应完全后,用蒸馏水和无水乙醇多次洗涤,进行固液分离,在60℃下干燥12h,得到淡黄色的草酸亚铁晶体产品。
①检验草酸亚铁晶体洗涤干净的方法是______ ;
②写出制备草酸亚铁晶体的离子方程式:______ 。
Ⅱ.产品纯度的测定:
思源同学对比发现自己制得的草酸亚铁晶体在外观上和商品出售的高纯度草酸亚铁晶体略有不同,他猜测这是由于产物中含有杂质 和
和 所致,于是接着设计实验来测定所得产物中
所致,于是接着设计实验来测定所得产物中 的质量分数。
的质量分数。
实验过程:
①将准确称量的ag草酸亚铁晶体样品置于250 锥形瓶内,加入适量2
锥形瓶内,加入适量2 的
的 溶解,加热至70℃左右,用浓度为0.2000
溶解,加热至70℃左右,用浓度为0.2000 的高锰酸钾标准溶液滴定至终点,重复3次,平均消耗高锰酸钾溶液b
的高锰酸钾标准溶液滴定至终点,重复3次,平均消耗高锰酸钾溶液b ;(已知:
;(已知: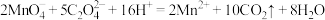 )
)
②向上述滴定混合液中加入适量的 粉和过量的2
粉和过量的2 的
的 溶液,煮沸(不含
溶液,煮沸(不含 ),继续用0.2000
),继续用0.2000 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液c
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液c 。
。
(4)步骤②中加入锌粉的目的是______ 。
(5)步骤②中检验溶液不含 的操作:取一滴煮沸后的溶液滴入装有
的操作:取一滴煮沸后的溶液滴入装有______ (填化学式)溶液的试管中,若______ ,则说明溶液不含 。
。
(6)样品中 的质量分数为
的质量分数为______ %(用含a、b、c的式子表示)。
 ,难溶于水)是制备磷酸铁锂正极材料所需的主要原材料。思源同学想在实验室里利用废铁屑制备草酸亚铁晶体(
,难溶于水)是制备磷酸铁锂正极材料所需的主要原材料。思源同学想在实验室里利用废铁屑制备草酸亚铁晶体( )并测定产品的纯度。请帮助他一起完成探究!
)并测定产品的纯度。请帮助他一起完成探究!Ⅰ.草酸亚铁晶体(
 )的制备:
)的制备:(1)实验前的准备——药品的选择与处理
为了防止制备的硫酸亚铁溶液变质,制备过程中应采取的措施是
(2)实验过程中——操作与观察
思源同学选取了如图所示装置,在实验过程中,往装置中不断通入
 ,其目的有:
,其目的有:
(3)反应结束后——产物的分离与后处理
反应完全后,用蒸馏水和无水乙醇多次洗涤,进行固液分离,在60℃下干燥12h,得到淡黄色的草酸亚铁晶体产品。
①检验草酸亚铁晶体洗涤干净的方法是
②写出制备草酸亚铁晶体的离子方程式:
Ⅱ.产品纯度的测定:
思源同学对比发现自己制得的草酸亚铁晶体在外观上和商品出售的高纯度草酸亚铁晶体略有不同,他猜测这是由于产物中含有杂质
 和
和 所致,于是接着设计实验来测定所得产物中
所致,于是接着设计实验来测定所得产物中 的质量分数。
的质量分数。实验过程:
①将准确称量的ag草酸亚铁晶体样品置于250
 锥形瓶内,加入适量2
锥形瓶内,加入适量2 的
的 溶解,加热至70℃左右,用浓度为0.2000
溶解,加热至70℃左右,用浓度为0.2000 的高锰酸钾标准溶液滴定至终点,重复3次,平均消耗高锰酸钾溶液b
的高锰酸钾标准溶液滴定至终点,重复3次,平均消耗高锰酸钾溶液b ;(已知:
;(已知: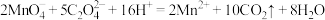 )
)②向上述滴定混合液中加入适量的
 粉和过量的2
粉和过量的2 的
的 溶液,煮沸(不含
溶液,煮沸(不含 ),继续用0.2000
),继续用0.2000 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液c
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液c 。
。(4)步骤②中加入锌粉的目的是
(5)步骤②中检验溶液不含
 的操作:取一滴煮沸后的溶液滴入装有
的操作:取一滴煮沸后的溶液滴入装有 。
。(6)样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
5 . SO2和焦亚硫酸钠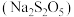 可用作食品添加剂。某化学实验小组对其进行探究。回答下列问题:
可用作食品添加剂。某化学实验小组对其进行探究。回答下列问题:
实验小组同学设计了两种制备 的方案。
的方案。
Ⅰ.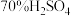 溶液与
溶液与 粉末反应;
粉末反应;
Ⅱ. 粉与浓
粉与浓 在加热条件下反应。
在加热条件下反应。
(1)方案Ⅰ所涉及的化学方程式为_______ 。
(2)两种方案相比,方案Ⅰ的优点为_______ 。
(3)小组同学用如下图所示装置检验上述方案Ⅱ中所有气体产物。
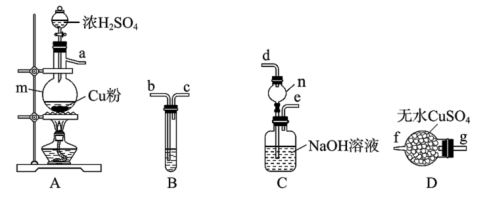
①按气流方向,上述装置合理的连接顺序为
_______  填仪器接口的小写字母
填仪器接口的小写字母 。
。
②装置B中盛放的试剂是_______ ,装置C的作用为 _______ 。
(4)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知: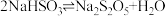 。
。
试剂:稀盐酸、稀 、稀
、稀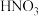 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
(5)小组利用如图装置测定空气中 的含量。
的含量。
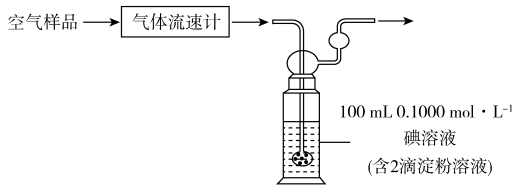
若空气流速为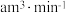 ,当观察到
,当观察到 _______ 时,结束计时,测定耗时 。假定样品中的
。假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是_______ 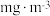 。
。
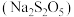 可用作食品添加剂。某化学实验小组对其进行探究。回答下列问题:
可用作食品添加剂。某化学实验小组对其进行探究。回答下列问题:实验小组同学设计了两种制备
 的方案。
的方案。Ⅰ.
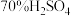 溶液与
溶液与 粉末反应;
粉末反应;Ⅱ.
 粉与浓
粉与浓 在加热条件下反应。
在加热条件下反应。(1)方案Ⅰ所涉及的化学方程式为
(2)两种方案相比,方案Ⅰ的优点为
(3)小组同学用如下图所示装置检验上述方案Ⅱ中所有气体产物。

①按气流方向,上述装置合理的连接顺序为

 填仪器接口的小写字母
填仪器接口的小写字母 。
。②装置B中盛放的试剂是
(4)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
已知:
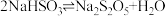 。
。试剂:稀盐酸、稀
 、稀
、稀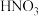 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液| 实验编号 | 实验步骤 | 现象 | 结论 |
 | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 |  |
 | 取实验 的溶液, 的溶液, | 样品已氧化变质 | |
 | 另取实验 的溶液, 的溶液, | 样品未完全氧化变质 |
 的含量。
的含量。
若空气流速为
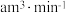 ,当观察到
,当观察到  。假定样品中的
。假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是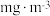 。
。
您最近一年使用:0次
名校
解题方法
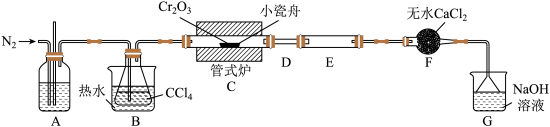
6 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g) 2CrCl3(s)+3COCl2(g),其实验装置如图所示:
2CrCl3(s)+3COCl2(g),其实验装置如图所示:
②碱性条件下,H2O2可将Cr3+氧化为CrO ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+
还原为Cr3+
回答下列问题:
(1)基态Cr原子的简化核外电子排布式为______ 。
(2)无水CaCl2的作用是______ 。
(3)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是______ ;可通过______ (填操作)使实验继续进行。
(4)装置G中发生反应生成两种盐的化学方程式为______ 。
(5)测定产品中CrCl3质量分数的实验步骤如下:
I.取5gCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO ,继续加热一段时间;
,继续加热一段时间;
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使CrO 转化为Cr2O
转化为Cr2O ,再加适量的蒸馏水将溶液稀释至100mL;
,再加适量的蒸馏水将溶液稀释至100mL;
Ⅲ.取25.00mL溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的1.0mol•L-1的(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗(NH4)2Fe(SO4)2标准溶液21.00mL(已知Cr2O 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
①该样品中CrCl3的质量分数为______ %(保留小数点后两位)
②下列操作将导致产品中CrCl3质量分数测定值偏低的是______ (填标号)。
A.步骤I中未继续加热一段时间
B.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤Ⅱ中未加浓磷酸
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 2CrCl3(s)+3COCl2(g),其实验装置如图所示:
2CrCl3(s)+3COCl2(g),其实验装置如图所示: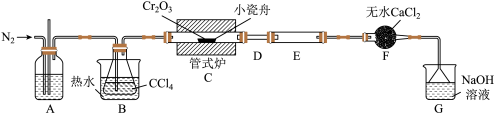
②碱性条件下,H2O2可将Cr3+氧化为CrO
 ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+
还原为Cr3+回答下列问题:
(1)基态Cr原子的简化核外电子排布式为
(2)无水CaCl2的作用是
(3)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是
(4)装置G中发生反应生成两种盐的化学方程式为
(5)测定产品中CrCl3质量分数的实验步骤如下:
I.取5gCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使CrO
 转化为Cr2O
转化为Cr2O ,再加适量的蒸馏水将溶液稀释至100mL;
,再加适量的蒸馏水将溶液稀释至100mL;Ⅲ.取25.00mL溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的1.0mol•L-1的(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗(NH4)2Fe(SO4)2标准溶液21.00mL(已知Cr2O
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。①该样品中CrCl3的质量分数为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
A.步骤I中未继续加热一段时间
B.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤Ⅱ中未加浓磷酸
D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
2023-05-18更新
|
173次组卷
|
2卷引用:湖南省新高考教学教研联盟(长郡十八校联盟)2022-2023学年高二下学期5月联考化学试题
名校
解题方法
7 . 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。 是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备
是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。
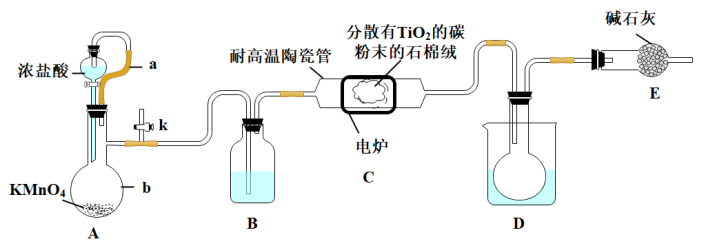
已知:HCl与 不发生反应;装置C中除生成
不发生反应;装置C中除生成 外,同时还生成一种有毒气态氧化物和少量
外,同时还生成一种有毒气态氧化物和少量 。其它相关信息如下表所示:
。其它相关信息如下表所示:
请回答下列问题:
(1)装置A中导管a的作用为___________ ,装置B中所盛试剂为___________ ,装置A中发生反应的离子方程式为___________ (反应后Mn元素以 形式存在)。
形式存在)。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:___________→___________→b→___________→___________→d。__________
(3)下列说法不正确 的是___________ 。
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与 、碳粉的接触面积,以加快反应速率
、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使 变质
变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4) 可制备纳米
可制备纳米 :以
:以 为载体,用
为载体,用 和水蒸气反应生成
和水蒸气反应生成 。再控制温度生成纳米
。再控制温度生成纳米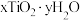 。测定产物
。测定产物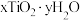 组成的方法如下:
组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为
还原为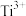 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用 的
的 标准溶液滴定,将
标准溶液滴定,将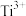 氧化为
氧化为 ,三次滴定消耗标准溶液的平均值为24.00mL。
,三次滴定消耗标准溶液的平均值为24.00mL。
①滴定终点的判断方法是___________ 。
②通过分析、计算,该样品的组成为___________ 。
 是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备
是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。
已知:HCl与
 不发生反应;装置C中除生成
不发生反应;装置C中除生成 外,同时还生成一种有毒气态氧化物和少量
外,同时还生成一种有毒气态氧化物和少量 。其它相关信息如下表所示:
。其它相关信息如下表所示:| 熔点/℃ | 沸点/℃ | 密度/(g/cm3) | 水溶性 | |
 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中导管a的作用为
 形式存在)。
形式存在)。(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:___________→___________→b→___________→___________→d。
(3)下列说法
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与
 、碳粉的接触面积,以加快反应速率
、碳粉的接触面积,以加快反应速率C.装置D中的烧杯中可加入冰水,便于收集到纯的液态

D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使
 变质
变质E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)
 可制备纳米
可制备纳米 :以
:以 为载体,用
为载体,用 和水蒸气反应生成
和水蒸气反应生成 。再控制温度生成纳米
。再控制温度生成纳米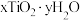 。测定产物
。测定产物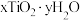 组成的方法如下:
组成的方法如下:步骤一:取样品2.100g用稀硫酸充分溶解得到
 ,再用足量铝将
,再用足量铝将 还原为
还原为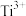 ,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用
 的
的 标准溶液滴定,将
标准溶液滴定,将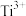 氧化为
氧化为 ,三次滴定消耗标准溶液的平均值为24.00mL。
,三次滴定消耗标准溶液的平均值为24.00mL。①滴定终点的判断方法是
②通过分析、计算,该样品的组成为
您最近一年使用:0次
2022-01-27更新
|
463次组卷
|
3卷引用:浙江省金衢六校联盟2021-2022学年高二上学期期末联考化学试题
名校
解题方法
8 . 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
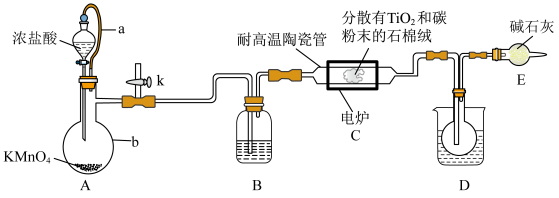
已知:HCl与TiO2不发生反应;装置 中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:
中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:
请回答下列问题:
(1)装置A中导管a的作用为_______ ,装置B中所盛试剂为_______ ,装置A中发生反应的离子方程式为_______ (反应后Mn元素以Mn2+形式存在)。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性
d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:____→____→b→____→____→____,____ 。
(3)下列说法不正确 的是_______ 。
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米 。测定产物
。测定产物 组成的方法如下:
组成的方法如下:
步骤一:取样品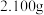 用稀硫酸充分溶解得到
用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入
还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入 容量瓶,定容得到待测液。
容量瓶,定容得到待测液。
步骤二:取待测液 于锥形瓶中,加几滴KSCN溶液作指示剂,用
于锥形瓶中,加几滴KSCN溶液作指示剂,用 的
的 标准溶液滴定,将Ti3+氧化为
标准溶液滴定,将Ti3+氧化为 ,三次滴定消耗标准溶液的平均值为
,三次滴定消耗标准溶液的平均值为 。
。
①滴定终点的判断方法是_______ 。
②通过分析、计算,该样品的组成为_______ 。

已知:HCl与TiO2不发生反应;装置
 中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:
中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:| 熔点/℃ | 沸点/℃ | 密度/(g∙cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中导管a的作用为
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性
d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:____→____→b→____→____→____,
(3)下列说法
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米
 。测定产物
。测定产物 组成的方法如下:
组成的方法如下:步骤一:取样品
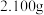 用稀硫酸充分溶解得到
用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入
还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入 容量瓶,定容得到待测液。
容量瓶,定容得到待测液。步骤二:取待测液
 于锥形瓶中,加几滴KSCN溶液作指示剂,用
于锥形瓶中,加几滴KSCN溶液作指示剂,用 的
的 标准溶液滴定,将Ti3+氧化为
标准溶液滴定,将Ti3+氧化为 ,三次滴定消耗标准溶液的平均值为
,三次滴定消耗标准溶液的平均值为 。
。①滴定终点的判断方法是
②通过分析、计算,该样品的组成为
您最近一年使用:0次
2021-09-20更新
|
676次组卷
|
7卷引用:河北省石家庄市正定中学2022-2023学年高二上学期12月月考化学试题
河北省石家庄市正定中学2022-2023学年高二上学期12月月考化学试题浙江省嘉兴市2022届高三上学期9月基础测试化学试题(已下线)2022年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B(已下线)备战2022年高考化学精准检测卷【全国卷】18(已下线)解密13 实验化学(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
9 . 氯碱工业的产物可用于制取“84”消毒液的主要成份次氯酸钠。
I.常温下,将 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
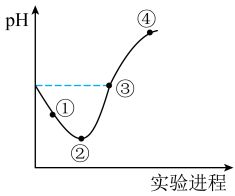
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
(2)③点所示溶液中:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);
(3)比较水的电离程度:曲线③点处___________ 曲线②点处。
II.探究发现 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
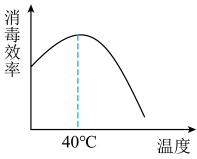
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因_______ 。
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中 的含量。
的含量。
其实验步骤为:称取工业烧碱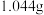 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)
(5)上述实验步骤中需要用到的全部定量仪器有:___________ 。
(6)计算该样品中 的质量分数为
的质量分数为___________ 。(用小数表示,保留至小数点后第3位)
(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
I.常温下,将
 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
A.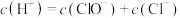 | B. |
C.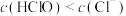 | D.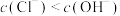 |
(2)③点所示溶液中:

 (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);(3)比较水的电离程度:曲线③点处
II.探究发现
 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中
 的含量。
的含量。其实验步骤为:称取工业烧碱
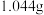 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)(5)上述实验步骤中需要用到的全部定量仪器有:
(6)计算该样品中
 的质量分数为
的质量分数为(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
| A.工业烧碱已发生潮解 | B.滴定时往锥形瓶中加水 |
| C.配制的待测液敞口放置时间过长 | D.滴定管水洗后未用标准盐酸润洗 |
您最近一年使用:0次
10 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
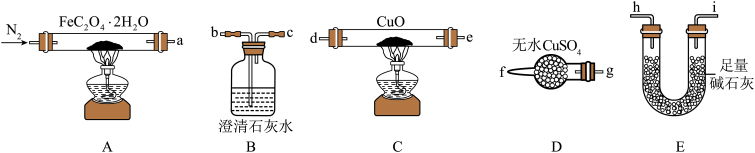
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__ 。
③实验证明了气体产物中含有CO,依据的实验现象为__ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__ ;步骤3中加入锌粉的目的为___ 。
(5)若步骤 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将__ (填“偏高”、“偏低”或“不变”)
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:

①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)若步骤
 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近一年使用:0次
2020-06-12更新
|
1223次组卷
|
3卷引用:江苏省海门中学2021-2022学年度高二上学期10月月考化学试题



