名校
解题方法
1 . 乙二胺四乙酸铁钠可用于感光材料冲洗药品及漂白剂,化学式为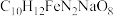 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下:
(1)基态氯原子的价层电子排布图为___________ 。
(2)下列氮原子能量最高的是___________(填标号)。
(3)EDTA的组成元素中C、N、O的第一电离能由大到小顺序为___________ (填元素符号)。碳原子的杂化轨道类型为___________ 。
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为___________ 。
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为___________ 。___________ 区(填“s”“p”“d”或“ds”)。铁的某种晶胞沿面对角线的位置切下之后可以得到如图2所示的截面。假设铁的原子半径为a nm,则该铁晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
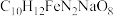 ;工业上可用EDTA与
;工业上可用EDTA与 、NaOH溶液发生反应进行制备,合成路线如下:
、NaOH溶液发生反应进行制备,合成路线如下: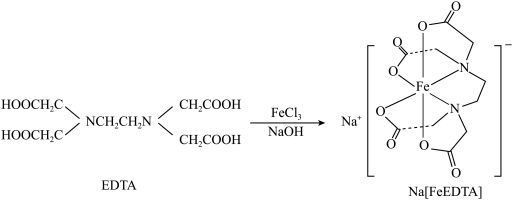
(1)基态氯原子的价层电子排布图为
(2)下列氮原子能量最高的是___________(填标号)。
A.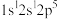 | B. | C. | D.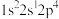 |
(4)NH3中N—H键的键角小于CH4中C—H键的键角,其原因为
(5)某种Fe、N组成的磁性化合物的结构如图1所示,N随机排列在Fe构成的正八面体的空隙中。该磁性化合物的化学式为
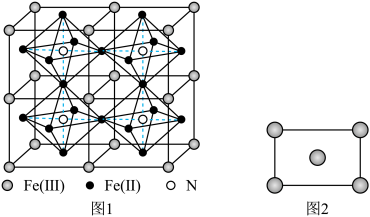
 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-04-23更新
|
902次组卷
|
8卷引用:北京市第二中学2022-2023学年高二下学期期末考试化学试题
北京市第二中学2022-2023学年高二下学期期末考试化学试题福建省百校联盟2023届高三第三次模拟考试化学试题福建省百校联盟2023届高三下学期第三次模拟考试化学试题(已下线)押题密卷 02-【热题狂飙】2023年高考化学样卷(全国卷专用)广西壮族自治区南宁市第二中学2023届高三下学期收网考理科综合化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京市首都师范大学附属中学2023-2024学年高三下学期3月月考化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学
名校
解题方法
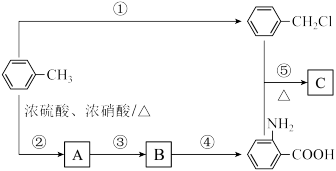
2 . 苯及其同系物是一类重要的有机化工原料。
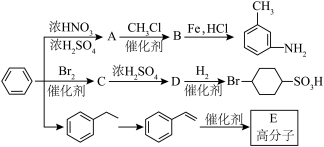
(1)B生成 的反应类型为:
的反应类型为:________ , 分子中最多有
分子中最多有________ 个原子共面。
(2)由 生成A温度控制在50~60℃,温度不宜过高或者过低,理由是
生成A温度控制在50~60℃,温度不宜过高或者过低,理由是________ 。
(3)已知: (R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为
(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为________ 。
(4)反应②的副产物D与A互为同分异构体,写出生成D结构简式:________ 。
(5)反应④的条件为________ 。
(6)邻氨基苯甲酸在一定条件下可发生取代反应,生成酰胺类化合物,请写出由两个邻氨基苯甲酸分子生成的环状酰胺类化合物的结构简式________ 。
已知:①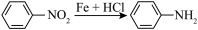 (苯胺,弱碱性,易被氧化)
(苯胺,弱碱性,易被氧化)
②苯的同系物能被酸性高锰酸钾氧化,如: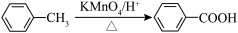
(1)B生成
 的反应类型为:
的反应类型为: 分子中最多有
分子中最多有(2)由
 生成A温度控制在50~60℃,温度不宜过高或者过低,理由是
生成A温度控制在50~60℃,温度不宜过高或者过低,理由是(3)已知:
 (R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为
(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为 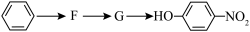
(4)反应②的副产物D与A互为同分异构体,写出生成D结构简式:
(5)反应④的条件为
(6)邻氨基苯甲酸在一定条件下可发生取代反应,生成酰胺类化合物,请写出由两个邻氨基苯甲酸分子生成的环状酰胺类化合物的结构简式
您最近一年使用:0次
名校
3 . 苯及其同系物是一类重要的有机化工原料。 (R和
(R和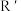 代表烃基)
代表烃基)
I.用苯作为原料制备一系列化合物的转化关系图。
(1) 中所含官能团的电子式为
中所含官能团的电子式为___________ ,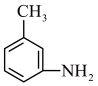 分子中最多有
分子中最多有___________ 个原子共面。
(2)由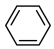 生成A温度控制在50~60℃,理由是
生成A温度控制在50~60℃,理由是___________ 。
(3)写出以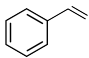 为原料合成E的化学方程式
为原料合成E的化学方程式___________ 。
(4)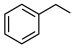 分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有
分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有___________ 种同分异构体。
(5)已知:R―Br R―OH(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为
R―OH(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为___________ 。若最终有机产物是间硝基苯酚,则F的结构简式为___________ 。
(6)C物质的结构简式为___________ 。
(7)反应③的反应条件为___________ ,反应③和④的顺序能否对调?请说明理由___________ 。
(8)反应②的副产物D与A互为同分异构体,写出生成D的化学方程式:___________ 。
已知:① (苯胺,弱碱性,易被氧化)
(苯胺,弱碱性,易被氧化)
②苯的同系物能被酸性高锰酸钾氧化,如:
 (R和
(R和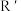 代表烃基)
代表烃基)I.用苯作为原料制备一系列化合物的转化关系图。
(1)
 中所含官能团的电子式为
中所含官能团的电子式为 分子中最多有
分子中最多有(2)由
 生成A温度控制在50~60℃,理由是
生成A温度控制在50~60℃,理由是(3)写出以
 为原料合成E的化学方程式
为原料合成E的化学方程式(4)
 分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有
分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有(5)已知:R―Br
 R―OH(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为
R―OH(R表示烃基),苯酚易被氧化。苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯为原料有以下合成路线,则G的结构简式为
(6)C物质的结构简式为
(7)反应③的反应条件为
(8)反应②的副产物D与A互为同分异构体,写出生成D的化学方程式:
您最近一年使用:0次
名校
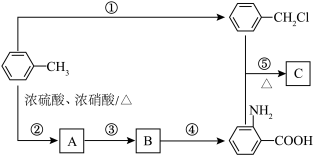
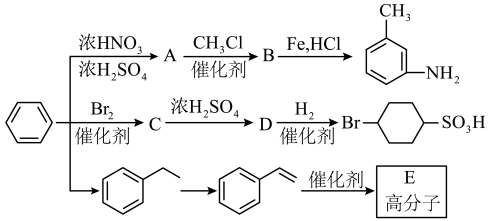
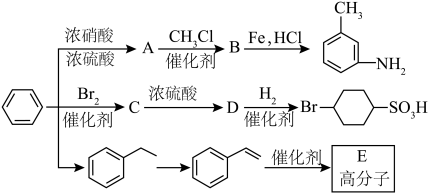
4 . 以下是用苯作为原料制备一系列化合物的转化关系图。
(1)A中碳、氮原子杂化轨道类型是___________ ,B的名称为___________ 。
(2)比较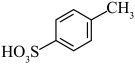 和D的酸性强弱:
和D的酸性强弱:___________ (用结构简式表示),由D生成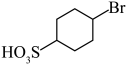 的反应类型为
的反应类型为___________ 。
(3)由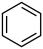 生成A的化学反应方程式为
生成A的化学反应方程式为___________ 。
(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以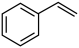 为原料合成E的化学反应方程式:
为原料合成E的化学反应方程式:___________ 。化合物F的分子式为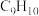 ,和
,和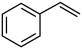 互为同系物,F的可能结构有
互为同系物,F的可能结构有___________ 种,其中一种核磁共振氢谱有五组吸收峰,且峰面积之比为3∶2∶2∶1∶2,写出其结构简式:___________ (任写一种)。
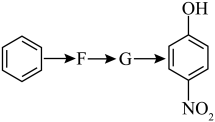
(5)已知: (R表示烃基);
(R表示烃基);
苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响。
根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为___________ 。
已知:
(1)A中碳、氮原子杂化轨道类型是
(2)比较
 和D的酸性强弱:
和D的酸性强弱: 的反应类型为
的反应类型为(3)由
 生成A的化学反应方程式为
生成A的化学反应方程式为(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以
 为原料合成E的化学反应方程式:
为原料合成E的化学反应方程式: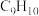 ,和
,和 互为同系物,F的可能结构有
互为同系物,F的可能结构有(5)已知:
 (R表示烃基);
(R表示烃基);苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响。
根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
您最近一年使用:0次
名校
5 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。

利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。

从简约性、准确性考虑,最适宜的方案是_______ (填编号)。
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
2022-07-29更新
|
1157次组卷
|
3卷引用:浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题
浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题湖北省华中师范大学第一附属中学2021-2022学年高一上学期期末考试化学试题(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
名校
解题方法
6 . 六氟锑酸钠( )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含 、
、 和
和 、
、 、CuO等)合成六氟锑酸钠的工艺流程如图所示:
、CuO等)合成六氟锑酸钠的工艺流程如图所示:

已知:① 的性质与
的性质与 类似;②
类似;② 可溶于
可溶于 溶液;③
溶液;③ 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:
(1)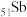 在元素周期表中的位置是
在元素周期表中的位置是___________ ,属于___________ 区元素。
(2)“碱浸、还原”时, 发生反应的离子方程式为
发生反应的离子方程式为___________ ;若 与
与 反应计量关系为
反应计量关系为 ,则氧化物为
,则氧化物为___________ 。
(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的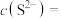
___________ [结果保留两位有效数字,常温下, ,
, ]。
]。
(4)“转化”时控温约80℃的原因是___________ 。
(5)“氟化”中发生的反应化学方程式为___________ 。
(6)氟锑酸化学式为 ,酸性比纯硫酸要强
,酸性比纯硫酸要强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成
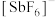 ,
, 离子的空间构型为
离子的空间构型为___________ 。
 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等。中南大学的杨天足教授提出了一种水溶液中由锑白(主要含 、
、 和
和 、
、 、CuO等)合成六氟锑酸钠的工艺流程如图所示:
、CuO等)合成六氟锑酸钠的工艺流程如图所示:
已知:①
 的性质与
的性质与 类似;②
类似;② 可溶于
可溶于 溶液;③
溶液;③ 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:(1)
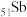 在元素周期表中的位置是
在元素周期表中的位置是(2)“碱浸、还原”时,
 发生反应的离子方程式为
发生反应的离子方程式为 与
与 反应计量关系为
反应计量关系为 ,则氧化物为
,则氧化物为(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入
 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的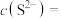
 ,
, ]。
]。(4)“转化”时控温约80℃的原因是
(5)“氟化”中发生的反应化学方程式为
(6)氟锑酸化学式为
 ,酸性比纯硫酸要强
,酸性比纯硫酸要强 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成
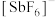 ,
, 离子的空间构型为
离子的空间构型为
您最近一年使用:0次
名校
解题方法
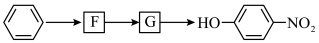
7 . 以下是用苯作为原料制备一系列化合物的转化关系图。
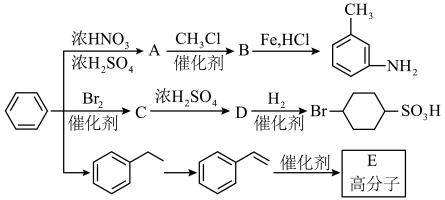
已知: 。
。
回答下列问题:
(1)C中所含官能团名称为_______ 。
(2)由D生成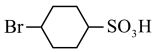 的反应类型为
的反应类型为_______ 。
(3)由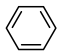 生成A的化学反应方程式为
生成A的化学反应方程式为_______ 。
(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以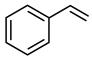 为原料合成E的化学反应方程式
为原料合成E的化学反应方程式_______ 。
(5) 分子中最多有
分子中最多有_______ 个原子共面。
(6)D分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有_______ 种同分异构体。
(7)已知: (R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
(R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为_______ 。

已知:
 。
。 回答下列问题:
(1)C中所含官能团名称为
(2)由D生成
 的反应类型为
的反应类型为(3)由
 生成A的化学反应方程式为
生成A的化学反应方程式为(4)E具有优良的绝热、绝缘性能,可用作包装材料和建筑材料,写出以
 为原料合成E的化学反应方程式
为原料合成E的化学反应方程式(5)
 分子中最多有
分子中最多有(6)D分子中苯环上的任意两个氢原子被氯原子取代后,得到的二氯代物有
(7)已知:
 (R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
(R表示烃基),苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响,根据上述转化关系,若以苯环为原料有以下合成路线,则F的结构简式为
您最近一年使用:0次
2023-04-13更新
|
335次组卷
|
2卷引用:湖南省多校联考2022-2023学年高二下学期期中考试化学试题
解题方法
8 . 铜碘杂化团簇化合物具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:SbCl3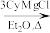 SbCy3(Cy代表—C6H11)
SbCy3(Cy代表—C6H11)

(1)已知Sb的原子序数为51,它在元素周期表中的位置是第五周期第ⅤA族,属于___ (填“s”、“p”、“d”或“ds”)区元素。
(2)SbCy3只能与一个Cu+配位的原因是___ 。
(3)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是___ 晶体,预测SbCl3的VSEPR模型名称为___ 。
(4)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及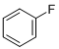 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是___ , ___ 。
(5)已知上述铜硬杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式___ ,设阿伏加德罗常数的值为NA,已知SbCy3的相对分子质量是371,则该铜碘杂化团簇的密度___ g/cm3。
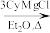 SbCy3(Cy代表—C6H11)
SbCy3(Cy代表—C6H11)
(1)已知Sb的原子序数为51,它在元素周期表中的位置是第五周期第ⅤA族,属于
(2)SbCy3只能与一个Cu+配位的原因是
(3)已知SbCl3(三氯化锑)是易挥发的物质,由此判断SbCl3是
(4)Et2O(即CH3CH2OCH2CH3,乙醚)中氧原子以及
 中碳原子的杂化类型分别是
中碳原子的杂化类型分别是(5)已知上述铜硬杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇分子,该团簇的化学式
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D、E是五种短周期主族元素,已知:
①B是地壳中含量最多的金属元素;
②A、B、E在同一周期,在该周期所有主族元素中,A的原子半径最大,E的原子半径最小;
③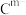 、
、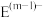 具有相同的电子层结构;
具有相同的电子层结构;
④热稳定性: 。
。
根据上述信息回答下列问题:
(1)D在元素周期表中的位置为_________ 。
(2)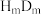 的电子式为
的电子式为_________ 。
(3)A、B、C、D四种元素的简单离子半径由大到小的顺序为_________ (用离子符号表示,下同)。
(4)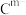 、
、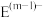 的还原性强弱顺序为
的还原性强弱顺序为_________ 。
(5)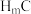 与C元素的具有漂白性的氧化物反应的化学方程式为
与C元素的具有漂白性的氧化物反应的化学方程式为_________ 。
(6)在A、B、C、E形成的单质中,符合下列转化关系的是_________ (填元素符号)。

(7)镓(Ga)与B同主族且相邻,性质相似。金属镓在半导体材料等领域具有重要应用。下列有关镓和镓的化合物说法正确的是_________(填字母)。
①B是地壳中含量最多的金属元素;
②A、B、E在同一周期,在该周期所有主族元素中,A的原子半径最大,E的原子半径最小;
③
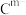 、
、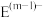 具有相同的电子层结构;
具有相同的电子层结构;④热稳定性:
 。
。根据上述信息回答下列问题:
(1)D在元素周期表中的位置为
(2)
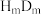 的电子式为
的电子式为(3)A、B、C、D四种元素的简单离子半径由大到小的顺序为
(4)
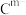 、
、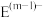 的还原性强弱顺序为
的还原性强弱顺序为(5)
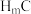 与C元素的具有漂白性的氧化物反应的化学方程式为
与C元素的具有漂白性的氧化物反应的化学方程式为(6)在A、B、C、E形成的单质中,符合下列转化关系的是

(7)镓(Ga)与B同主族且相邻,性质相似。金属镓在半导体材料等领域具有重要应用。下列有关镓和镓的化合物说法正确的是_________(填字母)。
A.一定条件下, 可溶于盐酸,但不能溶于氢氧化钠溶液 可溶于盐酸,但不能溶于氢氧化钠溶液 |
B.常温下, 可与水剧烈反应放出氢气 可与水剧烈反应放出氢气 |
C. 可由 可由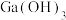 受热分解得到 受热分解得到 |
D.一定条件下, 可与 可与 溶液反应生成盐 溶液反应生成盐 |
您最近一年使用:0次
解题方法
10 . 从铝土矿废料“赤泥”(主要成分为Al2O3、Fe2O3、TiO2、Sc2O3)中提钪与TiO2的一种工艺如下:
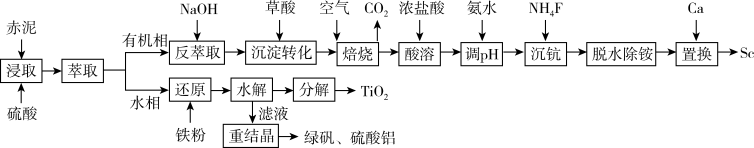
已知:该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH值如下表:
(1)钪为21号元素,该元素在元素周期表中的位置是_______ 。
(2)“沉淀转化”过程中,需加入过量的草酸,其原因是_______ 。
(3)“焙烧”过程中,生成Sc2O3的化学方程式为_______ 。
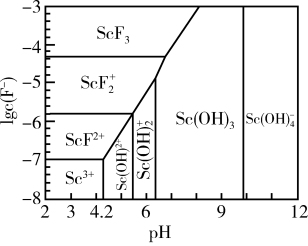
(4)常温下,三价Sc的几种存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。已知c(F-)=1×10-5,“调pH”过程中控制pH=4.0,则调节pH值后三价Sc的存在形式为_______ (填化学式)。
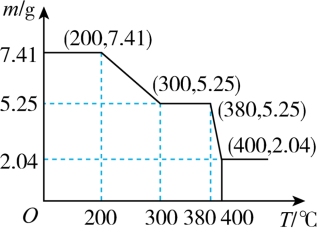
(5)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,某固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟,400℃以上质量不再改变。则a=_______ (填数字)。
(6)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O的离子方程式为_______ ;应控制溶液的pH值为_______ 。

已知:该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH值如下表:
| 离子 | Fe2+ | Fe3+ | Al3+ | TiO2+ |
| 开始沉淀pH | 7.0 | 1.9 | 3.0 | 0.3 |
| 完全沉淀pH | 9.0 | 3.2 | 4.7 | 2.0 |
(1)钪为21号元素,该元素在元素周期表中的位置是
(2)“沉淀转化”过程中,需加入过量的草酸,其原因是
(3)“焙烧”过程中,生成Sc2O3的化学方程式为
(4)常温下,三价Sc的几种存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。已知c(F-)=1×10-5,“调pH”过程中控制pH=4.0,则调节pH值后三价Sc的存在形式为

(5)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,某固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟,400℃以上质量不再改变。则a=

(6)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O的离子方程式为
您最近一年使用:0次



