名校
1 . 乳酸亚铁晶体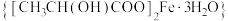 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
Ⅰ.制备碳酸亚铁:装置如图所示。
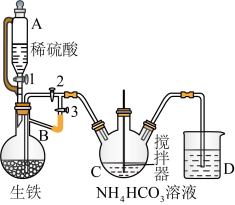
(1)仪器C的名称是_______ 。
(2)该实验使用生铁比纯铁更好,原因为_______ 。
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是_______ ,然后关闭活塞1,打开活塞2,关闭活塞3,此后,C装置溶液中有沉淀生成,并有大量气泡冒出,则C中发生反应的离子方程式为_______ 。
Ⅱ.制备乳酸亚铁。
(4)向纯净的 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式_______ 。为防止乳酸亚铁变质,在上述体系中还应加入适量_______ 。反应结束后,将所得溶液隔绝空气低温浓缩、降温结晶、过滤、洗涤、干燥,得乳酸亚铁晶体。
Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用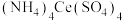 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的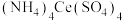 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为_______ (保留三位有效数字,以质量分数表示)。
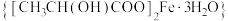 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。Ⅰ.制备碳酸亚铁:装置如图所示。

(1)仪器C的名称是
(2)该实验使用生铁比纯铁更好,原因为
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁。
(4)向纯净的
 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用
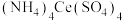 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的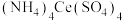 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
2022-12-07更新
|
103次组卷
|
2卷引用:河北省衡水市冀州区第一中学2020-2021学年高三上学期期末考试化学试题
名校
2 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效消灭新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂,但其稳定性较差,可转化为NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:

已知:(Ⅰ)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(Ⅱ)饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。
(1)步骤1中,生成C1O2的离子方程式是_______ ,通入空气的作用是_________ 。
(2)方法1中,反应的离子方程式是_________________ ,利用方法1制NaClO2时,温度不能超过20 ℃,可能的原因是______ 。
(3)方法2中,将ClO2通入电解槽的阴极室,饱和NaCl溶液加入电解槽的阳极室,电解一段时间后,可得到产品,写出电解时阴极的电极反应式________________ 。
(4)步骤3中从NaClO2溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________ ;④低于60 ℃干燥,得到成品。
(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a g样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用b mol·L−1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为c mL(已知:I2+2 =2I−+
=2I−+ )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为_____ 。(用含a、b、c的代数式表示)。在滴定操作正确无误的情况下,测得结果偏高,可能的原因是_______________ (用离子方程式和文字表示)。

已知:(Ⅰ)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(Ⅱ)饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。
(1)步骤1中,生成C1O2的离子方程式是
(2)方法1中,反应的离子方程式是
(3)方法2中,将ClO2通入电解槽的阴极室,饱和NaCl溶液加入电解槽的阳极室,电解一段时间后,可得到产品,写出电解时阴极的电极反应式
(4)步骤3中从NaClO2溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③
(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a g样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用b mol·L−1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为c mL(已知:I2+2
 =2I−+
=2I−+ )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为
您最近一年使用:0次
2021-11-12更新
|
429次组卷
|
3卷引用:河北省唐山市第一中学2021-2022学年高三上学期期中考试化学试题
解题方法
3 . 无水四氯化锡( )可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
)可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):

有关信息如下表:
回答下列问题:
(1)仪器A的名称为_______ ,仪器A中发生反应的离子方程式为_______ 。
(2)将装置如图连接好之后,首先应进行的操作为_______ ,而后慢慢滴入浓盐酸,待观察到丁装置中充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量并继续加热丁装置。
(3)戊装置中球形冷凝管的冷水进口为_______ (填“a”或“b”)。
(4)己装置中碱石灰的作用是_______ 。
(5) 和
和 的反应产物可能会有
的反应产物可能会有 和
和 ,为防止产品中带入
,为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在_______ ~_______  范围内。
范围内。
(6)为了确认丁装置中有 生成,可选用以下_______(填标号)检验。
生成,可选用以下_______(填标号)检验。
(7)碘氧化法滴定分析产品中 (Ⅱ)的含量。准确称取
(Ⅱ)的含量。准确称取 产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用
产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用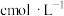 碘标准溶液滴定。实验中达到滴定终点的颜色变化为
碘标准溶液滴定。实验中达到滴定终点的颜色变化为_______ ,若此时消耗碘标准溶液 ,则产品中
,则产品中 (Ⅱ)的质量分数为
(Ⅱ)的质量分数为_______ (用字母表示)。
 )可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
)可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
有关信息如下表:
| 化学式 |  |  |  |
熔点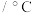 | 232 | 246 |  |
沸点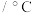 | 2260 | 652 | 114 |
| 其他性质 | 银白色固体金属 | 无色晶体, (Ⅱ)易被 (Ⅱ)易被 、 、 等氧化成 等氧化成 (Ⅳ) (Ⅳ) | 无色液体,易水解 |
(1)仪器A的名称为
(2)将装置如图连接好之后,首先应进行的操作为
(3)戊装置中球形冷凝管的冷水进口为
(4)己装置中碱石灰的作用是
(5)
 和
和 的反应产物可能会有
的反应产物可能会有 和
和 ,为防止产品中带入
,为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在 范围内。
范围内。(6)为了确认丁装置中有
 生成,可选用以下_______(填标号)检验。
生成,可选用以下_______(填标号)检验。| A.稀盐酸 | B.酸性高锰酸钾溶液 |
C.加入少量含有 的 的 溶液 溶液 | D. 稀溶液 稀溶液 |
 (Ⅱ)的含量。准确称取
(Ⅱ)的含量。准确称取 产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用
产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用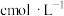 碘标准溶液滴定。实验中达到滴定终点的颜色变化为
碘标准溶液滴定。实验中达到滴定终点的颜色变化为 ,则产品中
,则产品中 (Ⅱ)的质量分数为
(Ⅱ)的质量分数为
您最近一年使用:0次
2021-11-05更新
|
199次组卷
|
3卷引用:河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三上学期期中考试化学试题
名校
解题方法
4 . 四水合磷酸锌 [Zn3(PO4)2·4H2O,摩尔质量为457 g·mol-1,难溶于水] 是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:
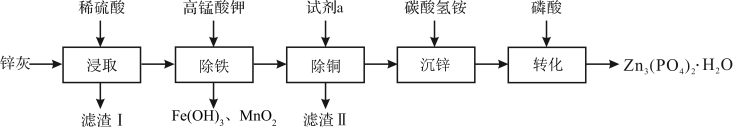
已知:①6NH4HCO3 + 3ZnSO4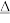 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
②ZnCO3·2Zn(OH)2·H2O + 2H3PO4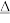 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑
③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
(1)滤渣Ⅰ的主要成分为_______ ;试剂a为_______ ;
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为_______ ;
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括_______ 和干燥。
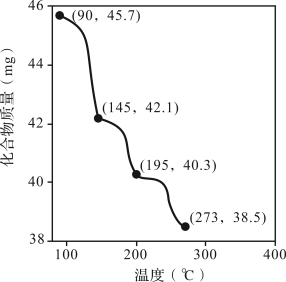
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。
(5)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验:(已知:Zn2+与H2Y2−按1:1反应;杂质不反应。)
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为_______ ;产品中Zn3(PO4)2·4H2O的质量分数为_______ 。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是_______ 。
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡

已知:①6NH4HCO3 + 3ZnSO4
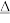 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑②ZnCO3·2Zn(OH)2·H2O + 2H3PO4
 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
| Fe3+ | Fe2+ | Cu2+ | Zn2+ | |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 | 5.7 |
| 完全沉淀时的pH | 3.7 | 9.0 | 6.7 | 8.1 |
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。

| A.90~145℃ | B.145~195℃ | C.195~273℃ | D.>273℃ |
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
您最近一年使用:0次
2021-09-16更新
|
672次组卷
|
3卷引用:河北正定中学2022届高三第二次月考化学试题
名校
解题方法
5 . 试剂级NaCl可用海盐(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO 等杂质)为原料制备。制备流程简图如图。
等杂质)为原料制备。制备流程简图如图。

(1)焙炒海盐的目的是_______ 。
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
(3)操作X为_______ 。
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
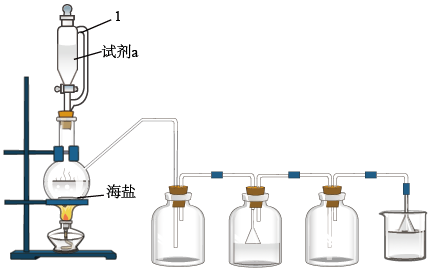
①试剂a为_______ 。
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原是_______ 。
(5)已知:CrO +Ba2+=BaCrO4↓(黄色);CrO
+Ba2+=BaCrO4↓(黄色);CrO +3Fe2++8H+=Cr3++3Fe3++4H2O;设计实验测定NaCl产品中SO
+3Fe2++8H+=Cr3++3Fe3++4H2O;设计实验测定NaCl产品中SO 的含量,填写表格。
的含量,填写表格。
 等杂质)为原料制备。制备流程简图如图。
等杂质)为原料制备。制备流程简图如图。
(1)焙炒海盐的目的是
(2)根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | BaCl2溶液 | SO |
| 步骤2 | ||
| 步骤3 |
(4)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①试剂a为
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原是
(5)已知:CrO
 +Ba2+=BaCrO4↓(黄色);CrO
+Ba2+=BaCrO4↓(黄色);CrO +3Fe2++8H+=Cr3++3Fe3++4H2O;设计实验测定NaCl产品中SO
+3Fe2++8H+=Cr3++3Fe3++4H2O;设计实验测定NaCl产品中SO 的含量,填写表格。
的含量,填写表格。| 操作 | 现象 | 目的/结论 | |
| ① | 称取样品m1g,加水溶解,加盐酸调至弱酸性,滴加过量c1mol•L﹣1BaCl2溶液V1mL | 稍显浑浊 | 目的: |
| ② | 继续滴加过量c2mol•L﹣1K2CrO4溶液V2mL | 产生黄色沉淀 | 目的:沉淀过量的Ba2+。 |
| ③ | 过滤洗涤,滴加少许指示剂于滤液中,用c3mol•L﹣1FeSO4溶液滴定至终点,消耗FeSO4溶液V3mL |  | 结论:SO 的质量分数为 的质量分数为 |
您最近一年使用:0次
名校
解题方法
6 . 工业上用 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
(1) Ca(ClO)2中Cl元素的化合价是___________ ;工业上将氯气制成漂白粉的主要目的是___________ 。工业上制成漂白粉的化学方程式:___________ 。
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
(3)浸泡衣物时加入漂粉精(有效成分Ca(ClO)2)在空气中放置一段时间漂白效果更好,请用化学方程式解释原因:___________ 。
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是___________ 。
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②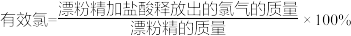 。
。
若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为___________ (计算结果保留一位小数)。
 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:(1) Ca(ClO)2中Cl元素的化合价是
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
| A.生石灰 | B.漂白粉 |
| C.NaOH | D. |
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②
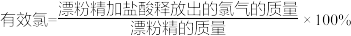 。
。若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为
您最近一年使用:0次
名校
7 . 氯化亚铜(CuCl)可用作有机合成催化剂、杀菌剂、媒染剂、脱色剂等,用途广泛,回答下列问题:
已知:①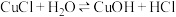
②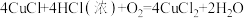
I.实验室采用 还原
还原 的方法制备CuCl,主要流程如图1所示:
的方法制备CuCl,主要流程如图1所示:

(1)上述方法制备CuCl涉及的离子方程式为: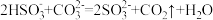 、
、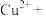
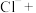
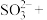 _______=
_______=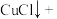
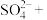
 (配平该离子方程式)
(配平该离子方程式)___________ 。
(2)实验室反应装置中的加热方式采用油浴,不使用热水浴,原因是___________ 。
(3)将CuCl沉淀先用___________ (填字母)洗涤3~5次,再用乙醇边洗涤边进行减压过滤,用乙醇作洗涤剂的目的是___________ 。
a. b.稀
b.稀 c.浓盐酸
c.浓盐酸
II.铈量法测定氯化亚铜(CuCl)的含量
称取0.2500g CuCl试样,置于预先放有50粒玻璃球和10mL 0.5mol/L 溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L
溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L 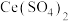 标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
(4)CuCl被 溶液氧化的离子方程式为
溶液氧化的离子方程式为___________ 。
(5)滴定操作中盛放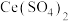 标准溶液使用的仪器是
标准溶液使用的仪器是___________ 。
(6)滴定过程中发生氧化还原反应: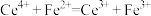 ,计算样品中CuCl质量分数的表达式为
,计算样品中CuCl质量分数的表达式为___________ (用含V的式子表示),
(7)判断下列情况对CuCl含量测定结果的影响(填“偏高”“偏低”或“无影响“)。
①若滴定开始时仰视滴定管刻度读数,则测定结果___________
②若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则定结果___________
已知:①
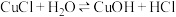
②
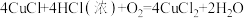
I.实验室采用
 还原
还原 的方法制备CuCl,主要流程如图1所示:
的方法制备CuCl,主要流程如图1所示:
(1)上述方法制备CuCl涉及的离子方程式为:
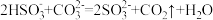 、
、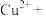
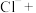
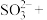 _______=
_______=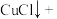
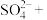
 (配平该离子方程式)
(配平该离子方程式)(2)实验室反应装置中的加热方式采用油浴,不使用热水浴,原因是
(3)将CuCl沉淀先用
a.
 b.稀
b.稀 c.浓盐酸
c.浓盐酸II.铈量法测定氯化亚铜(CuCl)的含量
称取0.2500g CuCl试样,置于预先放有50粒玻璃球和10mL 0.5mol/L
 溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L
溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L 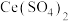 标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,(4)CuCl被
 溶液氧化的离子方程式为
溶液氧化的离子方程式为(5)滴定操作中盛放
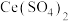 标准溶液使用的仪器是
标准溶液使用的仪器是(6)滴定过程中发生氧化还原反应:
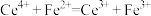 ,计算样品中CuCl质量分数的表达式为
,计算样品中CuCl质量分数的表达式为(7)判断下列情况对CuCl含量测定结果的影响(填“偏高”“偏低”或“无影响“)。
①若滴定开始时仰视滴定管刻度读数,则测定结果
②若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则定结果
您最近一年使用:0次
2021-10-26更新
|
146次组卷
|
2卷引用:河北省秦皇岛市昌黎汇文二中2022届高三9月月考化学试卷
名校
解题方法
8 . 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)加盐酸和Na2SO3浸出过程中氧化剂与还原剂物质的量之比为_______ 。
(2)NaClO3在浸出液中发生反应的离子方程式为_______ 。
(3)加入Na2CO3调pH至5.2,目的是_______ ;萃取剂层含锰元素,则沉淀II的主要成分为_______ 。
(4)操作I包括:将水层加入浓盐酸调整pH为2~3,_______ 、_______ 、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_______ (回答一条原因即可)。

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Co(OH)2 | 7.6 | 9.2 |
| Al(OH)3 | 4.0 | 5.2 |
| Mn(OH)2 | 7.7 | 9.8 |
(2)NaClO3在浸出液中发生反应的离子方程式为
(3)加入Na2CO3调pH至5.2,目的是
(4)操作I包括:将水层加入浓盐酸调整pH为2~3,
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是
您最近一年使用:0次
名校
解题方法
9 . 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:

(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,_______ ;
②_______ ,_______ ,Mg2++2OH-═Mg(OH)2↓;
③OH﹣+CO2= ,CO2+2H2O+AlO
,CO2+2H2O+AlO ═Al(OH)3↓+
═Al(OH)3↓+  ;
;
④_______ 。
(2)该样品中铝的质量分数是_______ 。
(3)第②步中加入NaOH溶液不足时,会使测定结果_______ (填“偏高”、“ 偏低”、“无影响”,下同);第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_______ ;第④步对沉淀灼烧不充分时,会使测定结果_______ 。

(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,
②
③OH﹣+CO2=
 ,CO2+2H2O+AlO
,CO2+2H2O+AlO ═Al(OH)3↓+
═Al(OH)3↓+  ;
;④
(2)该样品中铝的质量分数是
(3)第②步中加入NaOH溶液不足时,会使测定结果
您最近一年使用:0次
名校
10 . 由硫铁矿烧渣(主要成分: 、
、 、
、 和
和 )得到绿矾
)得到绿矾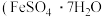 )的流程如下:
)的流程如下:

已知:① 难溶于水。且能还原
难溶于水。且能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。
②金属离子生成氢氧化物沉淀的 见下表:
见下表:
(1)操作Ⅰ需要使用的玻璃仪器有_______ 。
(2)写出“还原”步骤中涉及的离子反应方程式_______ 。
(3)“除铝”与“还原”两步骤_______ (填“能”或“不能”)颠倒,原因是_______ 。
(4)试剂a最好选用下列试剂中的_______(填字母代号),原因是_______。
(5)操作Ⅲ包含3个基本的实验操作,依次是_______ 。制得的绿矾需要减压烘干的原因是_______ 。
(6)测定所得绿矾晶体中铁元素的含量:称取样品mg于锥形瓶中,加水溶解后加稀硫酸酸化,用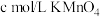 ,溶液滴定至终点,消耗
,溶液滴定至终点,消耗 溶液
溶液 。该晶体中铁的质量分数的表达式为
。该晶体中铁的质量分数的表达式为_______ 。
 、
、 、
、 和
和 )得到绿矾
)得到绿矾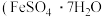 )的流程如下:
)的流程如下:
已知:①
 难溶于水。且能还原
难溶于水。且能还原 ,硫元素被氧化成
,硫元素被氧化成 。
。②金属离子生成氢氧化物沉淀的
 见下表:
见下表:| 金属离子 | 开始沉淀的 | 沉淀完全的 |
 | 1.1 | 3.2 |
 | 3.0 | 5.0 |
 | 5.8 | 8.8 |
(1)操作Ⅰ需要使用的玻璃仪器有
(2)写出“还原”步骤中涉及的离子反应方程式
(3)“除铝”与“还原”两步骤
(4)试剂a最好选用下列试剂中的_______(填字母代号),原因是_______。
| A.热水 | B.氯水 | C.乙醇 | D.饱和食盐水 |
(6)测定所得绿矾晶体中铁元素的含量:称取样品mg于锥形瓶中,加水溶解后加稀硫酸酸化,用
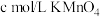 ,溶液滴定至终点,消耗
,溶液滴定至终点,消耗 溶液
溶液 。该晶体中铁的质量分数的表达式为
。该晶体中铁的质量分数的表达式为
您最近一年使用:0次
2021-09-04更新
|
308次组卷
|
4卷引用:河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题



