名校
解题方法
1 . 以高硫铝土矿(主要成分为 、
、 、
、 ,还含少量
,还含少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁 (
(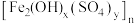 )的工艺流程如图:
)的工艺流程如图: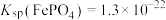 ,
,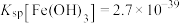 。
。
(1)铁元素位于元素周期表的第______ 周期第______ 族。
(2)①“焙烧”过程会产生 ,足量
,足量 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②用某浓度的 溶液吸收
溶液吸收 的过程中,溶液的
的过程中,溶液的 随吸收时间的关系、尾气中
随吸收时间的关系、尾气中 质量分数与溶液
质量分数与溶液 的关系分别如图所示。
的关系分别如图所示。___________  需要更换
需要更换 溶液。
溶液。
(3)若在实验室“焙烧”,则盛放固体物质的容器名称为___________ ;“碱浸”时应将焙烧渣粉碎后再研磨成细粉,目的是___________ 。
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。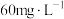 时,可溶性正磷酸盐浓度显著下降的原因为
时,可溶性正磷酸盐浓度显著下降的原因为___________ 。
②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为___________ 。
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取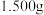 该聚合硫酸铁样品溶于适量硫酸,配成
该聚合硫酸铁样品溶于适量硫酸,配成 溶液
溶液 。
。
b.准确量取 溶液
溶液 ,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液
,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液 。
。
c.用 的酸性
的酸性 溶液滴定溶液
溶液滴定溶液 ,恰好反应完全时消耗酸性
,恰好反应完全时消耗酸性 溶液的体积为
溶液的体积为 。
。
该聚合硫酸铁样品中铁的含量___________ (填“已达到”或“未达到”)一等品质指标要求。
 、
、 、
、 ,还含少量
,还含少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁 (
(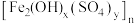 )的工艺流程如图:
)的工艺流程如图: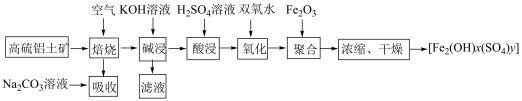
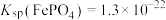 ,
,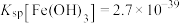 。
。(1)铁元素位于元素周期表的第
(2)①“焙烧”过程会产生
 ,足量
,足量 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②用某浓度的
 溶液吸收
溶液吸收 的过程中,溶液的
的过程中,溶液的 随吸收时间的关系、尾气中
随吸收时间的关系、尾气中 质量分数与溶液
质量分数与溶液 的关系分别如图所示。
的关系分别如图所示。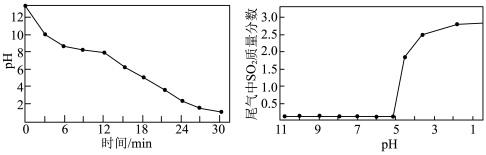
 需要更换
需要更换 溶液。
溶液。(3)若在实验室“焙烧”,则盛放固体物质的容器名称为
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。
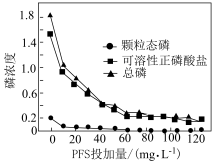
 时,可溶性正磷酸盐浓度显著下降的原因为
时,可溶性正磷酸盐浓度显著下降的原因为②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取
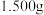 该聚合硫酸铁样品溶于适量硫酸,配成
该聚合硫酸铁样品溶于适量硫酸,配成 溶液
溶液 。
。b.准确量取
 溶液
溶液 ,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液
,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液 。
。c.用
 的酸性
的酸性 溶液滴定溶液
溶液滴定溶液 ,恰好反应完全时消耗酸性
,恰好反应完全时消耗酸性 溶液的体积为
溶液的体积为 。
。该聚合硫酸铁样品中铁的含量
您最近一年使用:0次
2023-12-20更新
|
99次组卷
|
2卷引用:河北省保定市部分高中2023-2024学年高三上学期12月期中化学试题
名校
2 . 工业中测定铁矿石中铁的含量,目前以氯化亚锡—三氯化钛还原三价铁,再用重铬酸钾滴定法为主。
已知:
回答下列问题:
(1)由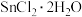 配制氯化亚锡(SnCl2)溶液时,需加入
配制氯化亚锡(SnCl2)溶液时,需加入_____ 。
(2)在1000℃下,利用氢气还原四氯化钛(TiCl4)制备三氯化钛(TiCl3)的装置如图所示。
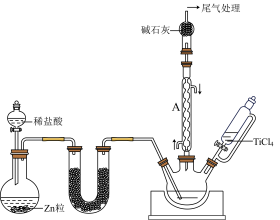
①U形管中可填充的药品为_____ (填字母)。
a.浓硫酸 b.碱石灰 c.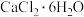 d.五氧化二磷
d.五氧化二磷
仪器A的名称是_____ ,利用本实验中制备氢气的装置,还可以制备硫化氢、氨气、二氧化碳、二氧化硫气体中的_____ 种气体(填字母)。
A.1 B.2 C.3 D.4
②三颈瓶应选用石英材质,不能用普通玻璃材质的原因为_____ 。
③安装好实验装置进行实验,实验步骤如下:检查装置的气密性后,加入药品;打开分液漏斗的活塞,_____ (按正确的顺序填入下列步骤的字母)。
a.打开恒压滴液漏斗,加入TiCl4,加热至1000℃,反应一段时间
b.收集气体,检验纯度
c.关闭分液漏斗的活塞
d.停止加热,冷却
(3)铁矿石铁含量的测定,步骤如下:
Ⅰ、取0.4000g铁矿石样品,加入5mL盐酸,趁热滴加氯化亚锡至溶液变为浅黄色。
Ⅱ、向上述溶液中滴加4滴Na2WO4溶液,然后滴加TiCl3溶液充分还原 ,当
,当 还原完全时,
还原完全时, 过量与
过量与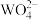 生成蓝色
生成蓝色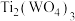 ,再滴加稀K2Cr2O7溶液至蓝色消失,除去过量的
,再滴加稀K2Cr2O7溶液至蓝色消失,除去过量的 。
。
Ⅲ、向溶液中加入适量浓硫酸、浓磷酸和硫酸锰溶液(硫酸锰溶液的作用是消除 的影响),加入指示剂二苯胺磺酸铵,用
的影响),加入指示剂二苯胺磺酸铵,用 K2Cr2O7标准溶液滴定至终点,消耗标准溶液10mL(已知:
K2Cr2O7标准溶液滴定至终点,消耗标准溶液10mL(已知: 被还原为
被还原为 )。
)。
①计算样品中铁元素的质量分数为_____ %。
②下列操作将导致样品中含铁量的测定值偏高的是_____ (填字母)。
a.步骤Ⅰ中样品溶解不充分
b.步骤Ⅱ中未加入稀K2Cr2O7溶液
c.步骤Ⅲ中未加入MnSO4溶液
d.步骤Ⅲ中读数时,滴定前平视,滴定后俯视
已知:
| 颜色 | 熔点/℃ | 沸点/℃ | 化学性质 | |
| TiCl3 | 紫色 | 440 | 660 | 遇水强烈水解,强还原性 |
| TiCl4 | 无色 | -25 | 136 | 遇水强烈水解 |
| SnCl2 | 白色 | 37.7 | 623 | 易水解,强还原性 |
(1)由
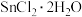 配制氯化亚锡(SnCl2)溶液时,需加入
配制氯化亚锡(SnCl2)溶液时,需加入(2)在1000℃下,利用氢气还原四氯化钛(TiCl4)制备三氯化钛(TiCl3)的装置如图所示。

①U形管中可填充的药品为
a.浓硫酸 b.碱石灰 c.
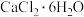 d.五氧化二磷
d.五氧化二磷仪器A的名称是
A.1 B.2 C.3 D.4
②三颈瓶应选用石英材质,不能用普通玻璃材质的原因为
③安装好实验装置进行实验,实验步骤如下:检查装置的气密性后,加入药品;打开分液漏斗的活塞,
a.打开恒压滴液漏斗,加入TiCl4,加热至1000℃,反应一段时间
b.收集气体,检验纯度
c.关闭分液漏斗的活塞
d.停止加热,冷却
(3)铁矿石铁含量的测定,步骤如下:
Ⅰ、取0.4000g铁矿石样品,加入5mL盐酸,趁热滴加氯化亚锡至溶液变为浅黄色。
Ⅱ、向上述溶液中滴加4滴Na2WO4溶液,然后滴加TiCl3溶液充分还原
 ,当
,当 还原完全时,
还原完全时, 过量与
过量与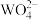 生成蓝色
生成蓝色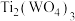 ,再滴加稀K2Cr2O7溶液至蓝色消失,除去过量的
,再滴加稀K2Cr2O7溶液至蓝色消失,除去过量的 。
。Ⅲ、向溶液中加入适量浓硫酸、浓磷酸和硫酸锰溶液(硫酸锰溶液的作用是消除
 的影响),加入指示剂二苯胺磺酸铵,用
的影响),加入指示剂二苯胺磺酸铵,用 K2Cr2O7标准溶液滴定至终点,消耗标准溶液10mL(已知:
K2Cr2O7标准溶液滴定至终点,消耗标准溶液10mL(已知: 被还原为
被还原为 )。
)。①计算样品中铁元素的质量分数为
②下列操作将导致样品中含铁量的测定值偏高的是
a.步骤Ⅰ中样品溶解不充分
b.步骤Ⅱ中未加入稀K2Cr2O7溶液
c.步骤Ⅲ中未加入MnSO4溶液
d.步骤Ⅲ中读数时,滴定前平视,滴定后俯视
您最近一年使用:0次
解题方法
3 . 某样品由 、
、 、
、 组成,实验小组取适量的该样品溶于水配成溶液进行探究。回答下列问题:
组成,实验小组取适量的该样品溶于水配成溶液进行探究。回答下列问题:
(1)样品组成的探究
①检验所配溶液中存在 的方法:
的方法:_______ (要涉及实验操作和实验现象)。
②为了检验样品中所含阴离子,实验小组设计了如下方案,请将实验方案补充完整。

Ⅰ:_______ Ⅱ:_______ Ⅲ:_______
(2)测定 的含量:取
的含量:取 样品溶于水,先滴加足量的
样品溶于水,先滴加足量的 溶液,充分反应后,过滤、洗涤、干燥,得到
溶液,充分反应后,过滤、洗涤、干燥,得到 白色沉淀,将该沉淀与足量的稀盐酸反应产生
白色沉淀,将该沉淀与足量的稀盐酸反应产生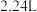 (标准状况)气体。所取样品中
(标准状况)气体。所取样品中 的质量为
的质量为_______ 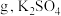 的物质的量为
的物质的量为_______  ,样品中
,样品中 的质量分数为
的质量分数为_______  (保留1位小数)。
(保留1位小数)。
 、
、 、
、 组成,实验小组取适量的该样品溶于水配成溶液进行探究。回答下列问题:
组成,实验小组取适量的该样品溶于水配成溶液进行探究。回答下列问题:(1)样品组成的探究
①检验所配溶液中存在
 的方法:
的方法:②为了检验样品中所含阴离子,实验小组设计了如下方案,请将实验方案补充完整。

Ⅰ:
(2)测定
 的含量:取
的含量:取 样品溶于水,先滴加足量的
样品溶于水,先滴加足量的 溶液,充分反应后,过滤、洗涤、干燥,得到
溶液,充分反应后,过滤、洗涤、干燥,得到 白色沉淀,将该沉淀与足量的稀盐酸反应产生
白色沉淀,将该沉淀与足量的稀盐酸反应产生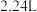 (标准状况)气体。所取样品中
(标准状况)气体。所取样品中 的质量为
的质量为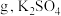 的物质的量为
的物质的量为 ,样品中
,样品中 的质量分数为
的质量分数为 (保留1位小数)。
(保留1位小数)。
您最近一年使用:0次
名校
解题方法
4 . 纯碱在日常生活和工业生产中有着广泛的应用。化工专家侯德榜发明的“侯氏制碱法”为我国纯碱工业和国民经济发展做出了重要贡献。“侯氏制碱法”的反应原理是:
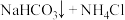 ,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。

请回答下列问题:
(1)在饱和食盐水中应该由先由_____ 管通_____ 、再由_____ 管通_____ 。
(2)将反应后溶液进行_____ ,得到纯碱样品。
(3)经过分析,纯碱样品中可能含有的杂质为NaCl,如何证明含有NaCl,请写出检验方法_____ 。
(4)为了测定纯碱样品中 的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行
的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行_____ (“可行”或“不可行”),若可行,请计算出碳酸钠的质量分数_____(保留小数点后一位)。如果不可行,请写出改进方案:_____ 。
(5)如图为NaCl、 在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为_____ 。


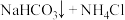 ,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
,实验室先用下图装置模拟“侯氏制碱法”制备纯碱,然后再对纯碱样品进行含量测定和分离提纯。
请回答下列问题:
(1)在饱和食盐水中应该由先由
(2)将反应后溶液进行
(3)经过分析,纯碱样品中可能含有的杂质为NaCl,如何证明含有NaCl,请写出检验方法
(4)为了测定纯碱样品中
 的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行
的质量分数,设计如下实验方案:称取6.0g纯碱样品,加入足量稀盐酸,将产生的气体通入碱石灰中进行吸收,测得碱石灰的质量增加2.4g,进而计算碳酸钠的质量分数。请问该实验方案是否可行(5)如图为NaCl、
 在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
在水中的溶解度曲线。请结合溶解度曲线,分析除去纯碱样品中的氯化钠杂质的具体操作为
您最近一年使用:0次
2024-01-04更新
|
91次组卷
|
2卷引用:河北省石家庄市正定一中、栾城中学、鹿泉区一中等校2023-2024学年高一上学期期中考试化学试题
5 . 防治环境污染,改善生态环境已成为全球共识。十九大报告提出“要像对待生命一样对待生态环境”。回答下列问题:
Ⅰ.大气污染
(1)汽车尾气处理:在汽车排气管上安装催化转化器,将其中的有害气体NO、CO转化为无害气体,反应的化学方程式为___________ 。
(2)工业上消除氮氧化物的污染可用如下反应:
 。
。
反应中还原剂为___________ (填化学式);若反应中消耗1molCH4,则转移电子的物质的量为___________ mol。
Ⅱ.水体污染
(3)过量排放含氮元素的废水,会引起水华等水体污染问题。含有大量 的废水脱氮可以用NaClO氧化法。一定条件下,溶液pH对NaClO去除
的废水脱氮可以用NaClO氧化法。一定条件下,溶液pH对NaClO去除 能力的影响如图所示。
能力的影响如图所示。
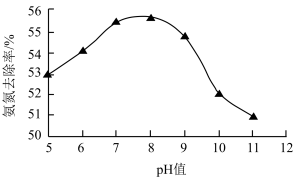
①pH=5时,将NaClO溶液氧化 的离子方程式补充完整:
的离子方程式补充完整:
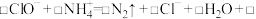
___________
②去除氨氮废水适宜的pH约为___________ 。
(4)测定废水中的氮含量:取ag废水,将所含氮完全转化为NH3,所得NH3用过量的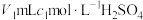 溶液吸收完全,剩余H2SO4用
溶液吸收完全,剩余H2SO4用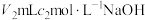 溶液恰好中和,则废水中氮元素的质量分数是
溶液恰好中和,则废水中氮元素的质量分数是___________ 。
Ⅰ.大气污染
(1)汽车尾气处理:在汽车排气管上安装催化转化器,将其中的有害气体NO、CO转化为无害气体,反应的化学方程式为
(2)工业上消除氮氧化物的污染可用如下反应:
 。
。反应中还原剂为
Ⅱ.水体污染
(3)过量排放含氮元素的废水,会引起水华等水体污染问题。含有大量
 的废水脱氮可以用NaClO氧化法。一定条件下,溶液pH对NaClO去除
的废水脱氮可以用NaClO氧化法。一定条件下,溶液pH对NaClO去除 能力的影响如图所示。
能力的影响如图所示。
①pH=5时,将NaClO溶液氧化
 的离子方程式补充完整:
的离子方程式补充完整: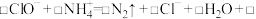
②去除氨氮废水适宜的pH约为
(4)测定废水中的氮含量:取ag废水,将所含氮完全转化为NH3,所得NH3用过量的
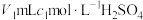 溶液吸收完全,剩余H2SO4用
溶液吸收完全,剩余H2SO4用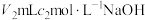 溶液恰好中和,则废水中氮元素的质量分数是
溶液恰好中和,则废水中氮元素的质量分数是
您最近一年使用:0次
名校
6 . 从铜阳极泥(含有 、
、 、
、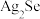 及少量
及少量 等)中分批提取硒、银、铜、金的过程如下:
等)中分批提取硒、银、铜、金的过程如下:
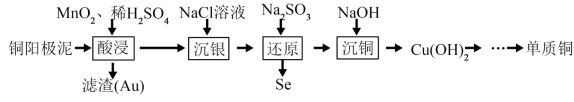
已知:I.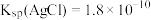 ;
;
Ⅱ. 可与
可与 络合:
络合: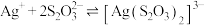
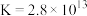 。
。
(1)写出“酸浸”时 溶解的离子方程式:
溶解的离子方程式:______________ 。
(2)“沉银”所得 固体可使用
固体可使用 溶浸,其原理为
溶浸,其原理为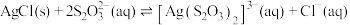 ,请列式计算解释该反应能实现的原因:
,请列式计算解释该反应能实现的原因:______________ 。
(3)酸浸时若用盐酸和 溶液代替
溶液代替 和稀硫酸,可使
和稀硫酸,可使 、
、 转化成
转化成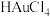 、
、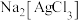 ,写出
,写出 转化成
转化成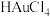 的离子方程式:
的离子方程式:______________ 。
(4)①“沉银”后溶液中含有亚硒酸( ),“还原”工序氧化剂与还原剂的物质的量之比为
),“还原”工序氧化剂与还原剂的物质的量之比为______________ ,“还原”得到的 可用于制备锂硒电池,其具有优异的循环稳定性。
可用于制备锂硒电池,其具有优异的循环稳定性。
②一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为________________ 。
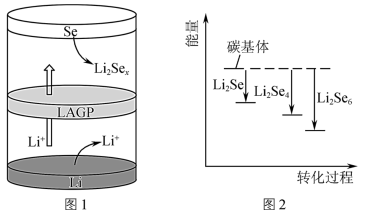
③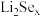 与正极碳基体结合时的能量变化如图2所示,3种
与正极碳基体结合时的能量变化如图2所示,3种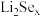 与碳基体的结合能力由大到小的顺序是
与碳基体的结合能力由大到小的顺序是____________ 。
(5)测定某粗硒样品中硒的含量:准确称量0.2000g粗硒样品,用浓 将样品中的
将样品中的 氧化得到;将生成的
氧化得到;将生成的 加入硫酸酸化的
加入硫酸酸化的 溶液中充分反应。用
溶液中充分反应。用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液20.00mL。则粗硒样品中硒的质量分数为
溶液20.00mL。则粗硒样品中硒的质量分数为____________ [已知实验测定原理为 ,
, (未配平)]。
(未配平)]。
 、
、 、
、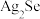 及少量
及少量 等)中分批提取硒、银、铜、金的过程如下:
等)中分批提取硒、银、铜、金的过程如下:
已知:I.
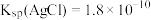 ;
;Ⅱ.
 可与
可与 络合:
络合: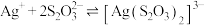
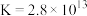 。
。(1)写出“酸浸”时
 溶解的离子方程式:
溶解的离子方程式:(2)“沉银”所得
 固体可使用
固体可使用 溶浸,其原理为
溶浸,其原理为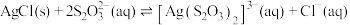 ,请列式计算解释该反应能实现的原因:
,请列式计算解释该反应能实现的原因:(3)酸浸时若用盐酸和
 溶液代替
溶液代替 和稀硫酸,可使
和稀硫酸,可使 、
、 转化成
转化成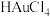 、
、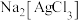 ,写出
,写出 转化成
转化成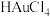 的离子方程式:
的离子方程式:(4)①“沉银”后溶液中含有亚硒酸(
 ),“还原”工序氧化剂与还原剂的物质的量之比为
),“还原”工序氧化剂与还原剂的物质的量之比为 可用于制备锂硒电池,其具有优异的循环稳定性。
可用于制备锂硒电池,其具有优异的循环稳定性。②一种锂硒电池放电时的工作原理如图1所示,正极的电极反应式为

③
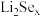 与正极碳基体结合时的能量变化如图2所示,3种
与正极碳基体结合时的能量变化如图2所示,3种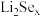 与碳基体的结合能力由大到小的顺序是
与碳基体的结合能力由大到小的顺序是(5)测定某粗硒样品中硒的含量:准确称量0.2000g粗硒样品,用浓
 将样品中的
将样品中的 氧化得到;将生成的
氧化得到;将生成的 加入硫酸酸化的
加入硫酸酸化的 溶液中充分反应。用
溶液中充分反应。用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液20.00mL。则粗硒样品中硒的质量分数为
溶液20.00mL。则粗硒样品中硒的质量分数为 ,
, (未配平)]。
(未配平)]。
您最近一年使用:0次
2023-12-29更新
|
334次组卷
|
4卷引用:河北省部分高中2023-2024学年高三上学期12月期末化学试题
解题方法
7 . 氧钒碱式碳酸铵晶体 [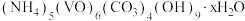 ]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用
]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用 与
与 反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
Ⅰ.制备氧钒碱式碳酸铵晶体的装置和步骤如下。
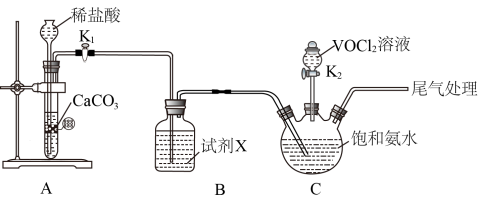
步骤一:按图安装好仪器,添加药品;
步骤二:打开 ,通入足量
,通入足量 ,充分反应后,关闭
,充分反应后,关闭 、打开
、打开 ,向三颈烧瓶中滴加适量
,向三颈烧瓶中滴加适量 溶液;
溶液;
步骤三:C中反应充分进行后,经一系列操作得到产品。
(1)图中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ;试剂X的作用为___________ ; 中V元素的化合价为
中V元素的化合价为___________ 。
(2)步骤二中,通入足量 的作用为
的作用为___________ ;滴加 溶液时,参与反应的
溶液时,参与反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
Ⅱ.组成测定
(3)测定含钒量(杂质不参加反应):准确称量mg产品,用适量稀硫酸溶解后,依次加入稍过量的酸性 溶液、
溶液、 溶液、尿素,充分反应后,用
溶液、尿素,充分反应后,用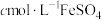 标准溶液滴定(
标准溶液滴定(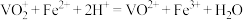 ),达到滴定终点时消耗标准液的体积为VmL。则加入
),达到滴定终点时消耗标准液的体积为VmL。则加入 溶液的作用为
溶液的作用为___________ ;产品中钒元素的质量分数为___________ (用代数式表示)。
(4)测定结晶水含量:称取纯化后的产品4.26g,充分煅烧后,称得生成 的质量为2.184g,则x=
的质量为2.184g,则x=___________ 。
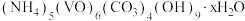 ]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用
]是制备多种光、电、磁材料的中间体,难溶于水,昜被氧化、可用 与
与 反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:
反应制备。科研小组在实验室中对氧钒碱式碳酸铵晶体的制备和组成进行探究。回答下列问题:Ⅰ.制备氧钒碱式碳酸铵晶体的装置和步骤如下。

步骤一:按图安装好仪器,添加药品;
步骤二:打开
 ,通入足量
,通入足量 ,充分反应后,关闭
,充分反应后,关闭 、打开
、打开 ,向三颈烧瓶中滴加适量
,向三颈烧瓶中滴加适量 溶液;
溶液;步骤三:C中反应充分进行后,经一系列操作得到产品。
(1)图中盛放
 溶液的仪器名称为
溶液的仪器名称为 中V元素的化合价为
中V元素的化合价为(2)步骤二中,通入足量
 的作用为
的作用为 溶液时,参与反应的
溶液时,参与反应的 与
与 的物质的量之比为
的物质的量之比为Ⅱ.组成测定
(3)测定含钒量(杂质不参加反应):准确称量mg产品,用适量稀硫酸溶解后,依次加入稍过量的酸性
 溶液、
溶液、 溶液、尿素,充分反应后,用
溶液、尿素,充分反应后,用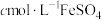 标准溶液滴定(
标准溶液滴定(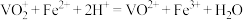 ),达到滴定终点时消耗标准液的体积为VmL。则加入
),达到滴定终点时消耗标准液的体积为VmL。则加入 溶液的作用为
溶液的作用为(4)测定结晶水含量:称取纯化后的产品4.26g,充分煅烧后,称得生成
 的质量为2.184g,则x=
的质量为2.184g,则x=
您最近一年使用:0次
2023-05-20更新
|
257次组卷
|
3卷引用:河北省张家口市2023届高三高考三模化学试题
解题方法
8 . 习近平总书记的“百炼钢做成了绕指柔”折射出我国钢铁工业从“跟跑”向“领跑”的蝶变。铁矿石中含铁量的测定是铁元素提炼的基础和前提。测定铁矿石中的铁含量可采用重铬酸钾法测定,其可分为三氯化钛—重铬酸钾滴定法和氯化亚锡、氯化汞—重铬酸钾滴定法,其流程如下图所示:
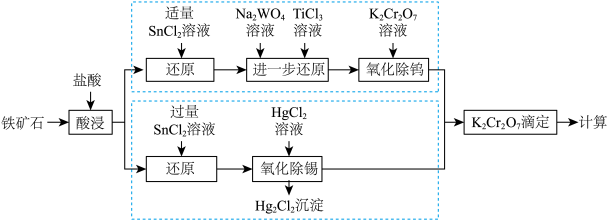
已知:i.氧化性顺序: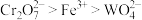 ;
;
ii.氯化汞为弱电解质,具备一定氧化性;
iii.Sn在溶液中的主要存在形式为 和
和 ;
;
iv.五价钨溶液为蓝色。
请回答下列问题:
(1)目前三氯化钛—重铬酸钾滴定法使用率更高,其主要原因为___________ 。
(2)提高“酸浸”速率可采取的措施是___________ 、___________ (任写两种)。
(3)“还原”与“氧化除锡”过程的离子反应方程式分别为___________ 、___________ 。
(4)“ 还原”溶液仍呈浅黄色,而“
还原”溶液仍呈浅黄色,而“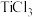 还原”后溶液呈现蓝色,则蓝色溶液中铁元素的主要存在形式为
还原”后溶液呈现蓝色,则蓝色溶液中铁元素的主要存在形式为___________ ,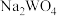 的作用为
的作用为___________ 。
(5)现称取3.0g铁矿石进行溶矿处理,采用三氯化钛—重铬酸钾滴定法,将“氧化除钨”后溶液定容至100mL,每次取20.00mL进行滴定,平行滴定4次,数据如下:
①分析滴定数据,第4组实验数据偏高,分析过程发现滴定操作均规范正确,只是指示剂(二苯胺磺酸钠)滴加时多了几滴,请分析第4组数据异常原因___________ ;(二苯胺磺酸钠作氧化还原指示剂)
②计算该铁矿石中铁的质量分数为___________ (保留两位小数)。

已知:i.氧化性顺序:
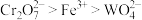 ;
;ii.氯化汞为弱电解质,具备一定氧化性;
iii.Sn在溶液中的主要存在形式为
 和
和 ;
;iv.五价钨溶液为蓝色。
请回答下列问题:
(1)目前三氯化钛—重铬酸钾滴定法使用率更高,其主要原因为
(2)提高“酸浸”速率可采取的措施是
(3)“还原”与“氧化除锡”过程的离子反应方程式分别为
(4)“
 还原”溶液仍呈浅黄色,而“
还原”溶液仍呈浅黄色,而“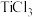 还原”后溶液呈现蓝色,则蓝色溶液中铁元素的主要存在形式为
还原”后溶液呈现蓝色,则蓝色溶液中铁元素的主要存在形式为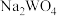 的作用为
的作用为(5)现称取3.0g铁矿石进行溶矿处理,采用三氯化钛—重铬酸钾滴定法,将“氧化除钨”后溶液定容至100mL,每次取20.00mL进行滴定,平行滴定4次,数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗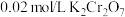 体积/mL 体积/mL | 34.95 | 35.05 | 35.00 | 36.30 |
②计算该铁矿石中铁的质量分数为
您最近一年使用:0次
名校
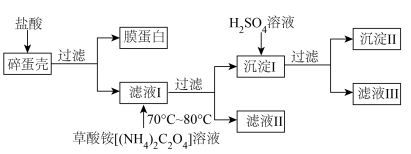
9 . 钙元素以多种形式广泛存在于自然界中,鸡蛋壳中钙的存在形式为CaCO3。为测定鸡蛋壳中钙的含量,课外小组做如下实验:
(1)滤液I与草酸铵反应采用水浴加热的优点是_______ 。
(2)为保证实验精确度,判断沉淀I是否洗涤干净的方法是_______ 。
(3)向沉淀 中加入
中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
(4)用 标准溶液滴定滤液III的过程中,
标准溶液滴定滤液III的过程中, (VII)被还原为
(VII)被还原为 (II),C(III)被氧化为
(II),C(III)被氧化为 。现将滤液III稀释至
。现将滤液III稀释至 ,再取其中的
,再取其中的 溶液,用
溶液,用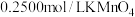 标准溶液滴定。
标准溶液滴定。
①以上操作过程中一定需要下列哪些仪器:_______ (填字母)。_______ 。
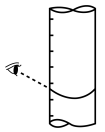
③滴定到终点,静置后如图读取KMnO4标准溶液的体积数值,则测定钙元素含量将_______ (填“偏高”“偏低”或“无影响”)。_______ (保留两位小数)。
(5)如果采用由碳酸钙直接转化为草酸钙进行测定,25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸铵溶液20mL,若有草酸钙沉淀生成,则c的取值范围为_______ (草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9)。
(1)滤液I与草酸铵反应采用水浴加热的优点是
(2)为保证实验精确度,判断沉淀I是否洗涤干净的方法是
(3)向沉淀
 中加入
中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为(4)用
 标准溶液滴定滤液III的过程中,
标准溶液滴定滤液III的过程中, (VII)被还原为
(VII)被还原为 (II),C(III)被氧化为
(II),C(III)被氧化为 。现将滤液III稀释至
。现将滤液III稀释至 ,再取其中的
,再取其中的 溶液,用
溶液,用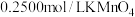 标准溶液滴定。
标准溶液滴定。①以上操作过程中一定需要下列哪些仪器:
③滴定到终点,静置后如图读取KMnO4标准溶液的体积数值,则测定钙元素含量将
| 编号 | 1 | 2 | 3 |
| 蛋壳质量/g | 10.19 | 11.12 | 11.13 |
| KMnO4溶液/mL | 15.28 | 16.72 | 17.72 |
(5)如果采用由碳酸钙直接转化为草酸钙进行测定,25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸铵溶液20mL,若有草酸钙沉淀生成,则c的取值范围为
您最近一年使用:0次
2023-11-26更新
|
224次组卷
|
6卷引用:河北省承德市双滦区实验中学2023-2024学年高三上学期一轮复习联考(三) 化学试题
河北省承德市双滦区实验中学2023-2024学年高三上学期一轮复习联考(三) 化学试题 河北省沧州市泊头市第一中学2023-2024学年高二上学期12月月考化学试题百师联盟2023-2024学年高三上学期一轮复习联考(三)理综试题(全国卷)(已下线)T27-实验综合题(已下线)化学(九省联考考后提升卷,甘肃卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点22 定量分析型实验综合题
10 . 氧钒(IV)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}是制备多种含钒产品和催化剂的基础原料和前驱体。利用纯净的VOCl2制备氧钒(IV)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的装置如图:
(1)装置A中的仪器名称是_____ ,装置C中a玻璃导管的作用是_____ 。
(2)装置B中反应的离子方程式_____ 。
(3)实验开始先关闭K2,_____ (填实验现象),关闭K1、打开K2进行实验。
(4)写出装置C中发生反应的化学方程式_____ 。
(5)下列装置不能代替装置A的是_____ 。_____ ,仪器c的作用是______ 。
(7)测定粗产品中钒的含量,称取2.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解,滴入几滴亚铁氰化钾K4[Fe(CN)6]溶液,用0.2mol/L的Fe2(SO4)3标准溶液进行滴定,滴定终点消耗标准溶液的体积为20.00mL。(假设杂质中不含钒,杂质也不参与反应,滴定反应为:VO2++Fe3++H2O=VO +Fe2++2H+。)
+Fe2++2H+。)
①滴定终点时的现象为_____ 。
②粗产品中钒的质量分数为_____ 。
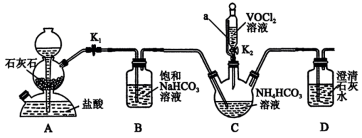
(1)装置A中的仪器名称是
(2)装置B中反应的离子方程式
(3)实验开始先关闭K2,
(4)写出装置C中发生反应的化学方程式
(5)下列装置不能代替装置A的是
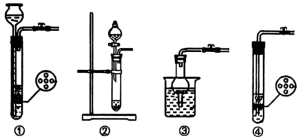

(7)测定粗产品中钒的含量,称取2.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解,滴入几滴亚铁氰化钾K4[Fe(CN)6]溶液,用0.2mol/L的Fe2(SO4)3标准溶液进行滴定,滴定终点消耗标准溶液的体积为20.00mL。(假设杂质中不含钒,杂质也不参与反应,滴定反应为:VO2++Fe3++H2O=VO
 +Fe2++2H+。)
+Fe2++2H+。)①滴定终点时的现象为
②粗产品中钒的质量分数为
您最近一年使用:0次



