解题方法
1 . 回忆氮及其化合物的相关知识,完成下列各题。
(1)氮气的性质是_______
(2)下列气体中,可溶于水的无色气体是_______ ;易液化,遇挥发性酸时冒白烟,而且适宜用作制冷剂的是_______ 。
A. B.NO C.
B.NO C. D.
D.
(3)氨的喷泉实验体现了氨的哪些性质? _______
(4)在实验室里,下列试剂须储存在棕色试剂瓶中的是_______
(5)下列环境问题中,与二氧化氮的排放无关的是_______
(1)氮气的性质是_______
| A.只有氧化性 | B.只有还原性 |
| C.既有氧化性,又有还原性 | D.既没有氧化性,又没有还原性 |
A.
 B.NO C.
B.NO C. D.
D.
(3)氨的喷泉实验体现了氨的哪些性质? _______
| A.还原性 | B.极易溶于水 |
| C.与水反应生成碱性物质 | D.氨气比空气轻 |
| A.浓硝酸 | B.浓盐酸 | C.浓硫酸 | D.氯化钠 |
| A.酸雨 | B.光化学烟雾 | C.白色污染 | D.雾霾 |
您最近一年使用:0次
解题方法
2 . 硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
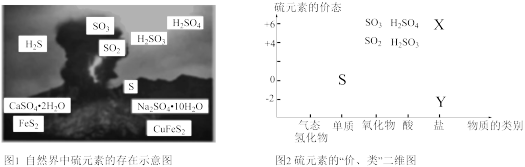
(1)从图1中选择符合图2要求的X、Y代表的物质:X_______ ,Y_______ 。
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
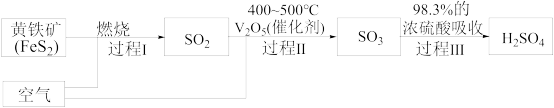
①上述过程中,没有发生氧化还原反应的是_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
②过程Ⅰ的化学反应方程式为_______ 。
③下列对浓硫酸的叙述正确的是_______ (填字母)。
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性
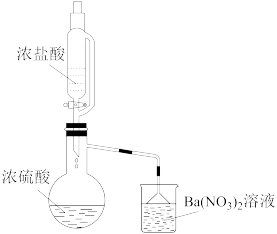
(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是_______ ;烧杯中出现白色沉淀,原因是_______ 。

(1)从图1中选择符合图2要求的X、Y代表的物质:X
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
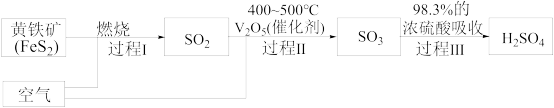
①上述过程中,没有发生氧化还原反应的是
②过程Ⅰ的化学反应方程式为
③下列对浓硫酸的叙述正确的是
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取
 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是

您最近一年使用:0次
3 . 实验室可通过置换反应完成卤素单质活泼性比较的实验。某实验小组设计了装置如图,回答下列问题:
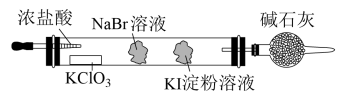
(1)已知:常温下KClO3与浓盐酸反应可制取氯气,反应如下。配平该化学方程式,标出电子转移的方向和数目。
反应①___________KClO3 +___________HCl(浓)=___________KCl + ___________Cl2↑+ ___________H2O___________
该反应中氧化剂为___________ ,被还原的元素是___________ 。
(2)该装置中,吸有KI淀粉溶液的棉球颜色变为___________ 。吸有NaBr溶液的棉球中发生反应的离子方程式为___________ 。
(3)由反应现象能否得出活泼性Br2>I2的结论?回答并说明理由___________ 。
(4)实验室还可通过以下反应制取氯气:
反应② 2KMnO4 +16HCl=2KCl + 2MnCl2 +5Cl2↑+ 8H2O;
反应③ MnO2 +4HCl(浓) MnCl2 +Cl2↑+ 2H2O;
MnCl2 +Cl2↑+ 2H2O;
若要制得相同质量的氯气,反应②和③中电子转移的数目之比为___________ 。
(5)通过反应①~③,比较反应中氧化剂的氧化性强弱___________ ,(用“>”、“<”或“=”连接)说明判断依据:___________ 。
(6)通过反应①~③,可以知道HCl的还原性强弱与___________ 、___________ 等因素有关。

(1)已知:常温下KClO3与浓盐酸反应可制取氯气,反应如下。配平该化学方程式,标出电子转移的方向和数目。
反应①___________KClO3 +___________HCl(浓)=___________KCl + ___________Cl2↑+ ___________H2O
该反应中氧化剂为
(2)该装置中,吸有KI淀粉溶液的棉球颜色变为
(3)由反应现象能否得出活泼性Br2>I2的结论?回答并说明理由
(4)实验室还可通过以下反应制取氯气:
反应② 2KMnO4 +16HCl=2KCl + 2MnCl2 +5Cl2↑+ 8H2O;
反应③ MnO2 +4HCl(浓)
 MnCl2 +Cl2↑+ 2H2O;
MnCl2 +Cl2↑+ 2H2O;若要制得相同质量的氯气,反应②和③中电子转移的数目之比为
(5)通过反应①~③,比较反应中氧化剂的氧化性强弱
(6)通过反应①~③,可以知道HCl的还原性强弱与
您最近一年使用:0次
解题方法
4 . 某化学小组对铁及其化合物的性质、制备进行如下探究。请按要求回答下列问题。
(一) 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液
(1)同学甲探究铁具有还原性,可选择试剂: 粉、
粉、 溶液、
溶液、_______ 。
(2)同学乙为探究 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是_______ ;欲获得更充分证据,此实验操作应该完善为_______ 。
(3)同学丙欲探究 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为_______ 。
(二) 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
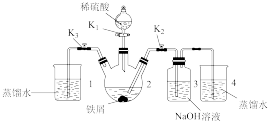
(4)为达到实验目的,需进行的操作:先打开 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再_______ ,_______ ,发现溶液从装置2进入装置3中,关闭 。
。
(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:_______ 。
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ. 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。
①从原子结构解释步骤I很容易发生的原因:_______ 。
②上述过程属于氧化还原反应的步骤为_______ (填序号)。
(7)化学修复过程探究:研究发现, 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。
①加热目的是_______ 。
②检测 洗涤干净与否的操作:
洗涤干净与否的操作:_______ 。
③铁器表面的 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
④修复中 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:_______ 。
(一)
 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液(1)同学甲探究铁具有还原性,可选择试剂:
 粉、
粉、 溶液、
溶液、(2)同学乙为探究
 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是(3)同学丙欲探究
 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为(二)
 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
(4)为达到实验目的,需进行的操作:先打开
 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再 。
。(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ.
 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。①从原子结构解释步骤I很容易发生的原因:
②上述过程属于氧化还原反应的步骤为
(7)化学修复过程探究:研究发现,
 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。①加热目的是
②检测
 洗涤干净与否的操作:
洗涤干净与否的操作:③铁器表面的
 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:④修复中
 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次
5 . 请根据元素周期律、元素周期表的知识解决下列问题。
(1)写出以下元素的元素符号。其单质氧化性最强的元素:______ ,短周期中其单质还原性最强的元素:________ 。
(2)从原子结构的角度说明Cl的得电子能力比S强的原因:___________ 。
(3)已知33As、35Br位于同一周期,请完成下列排序。
①As3-、Br-的还原性:_______ >_______ 。
②H3AsO4、H2SO4、H3PO4的酸性:_______ >_______ >________ 。
(1)写出以下元素的元素符号。其单质氧化性最强的元素:
(2)从原子结构的角度说明Cl的得电子能力比S强的原因:
(3)已知33As、35Br位于同一周期,请完成下列排序。
①As3-、Br-的还原性:
②H3AsO4、H2SO4、H3PO4的酸性:
您最近一年使用:0次
20-21高一上·全国·课时练习
6 . 下列关于盐酸性质的叙述中,正确的是
| A.盐酸极容易挥发又容易分解 |
| B.纯净的盐酸是黄色的液体 |
| C.盐酸有酸性、还原性和氧化性 |
| D.盐酸能导电 |
您最近一年使用:0次
20-21高三下·浙江·阶段练习
名校
解题方法
7 . 下列有关二氧化硫性质说法中,错误的是
| A.具有漂白性,能使品红溶液褪色 |
| B.具有还原性,能使酸性KMnO4溶液褪色 |
| C.具有氧化性,能使滴有酚酞的氨水红色褪去 |
| D.具有酸性氧化物的性质,能使紫色石蕊试液变红 |
您最近一年使用:0次
解题方法
8 . 依据图中硫元素及其化合物的转化关系,回答问题:
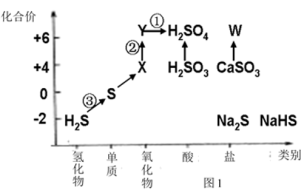
(1)图中,请写出反应①的离子方程式___________ 。
(2)图中,X的化学式为___________ ,从化合价上看,X具有___________ (填数字)
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有___________ (填数字)。
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为___________ mol。也可表示为2H2S+SO2=3S↓+2H2O,当生成1molS时,转移的电子为___________ mol。
(5)SO2可使酸性高锰酸钾溶液褪色,体现了___________ (填数字)
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:___________ 。

(1)图中,请写出反应①的离子方程式
(2)图中,X的化学式为
①氧化性;②还原性
(3)图中,W在医疗上可用作石膏绷带,关于它的用途还有
①在工业上,可来调节水泥的硬化速率 ②在食品中,可用来作营养强化剂
③在美术上,可用来制作各种模型 ④在日常生活中,“卤水点豆腐”
(4)反应③可表示为H2S+Cl2=2HCl+S↓,当生成1molS时,转移的电子为
(5)SO2可使酸性高锰酸钾溶液褪色,体现了
①氧化性;②还原性;③漂白性。
请写出该反应的化学方程式:
您最近一年使用:0次
9 . 甘氨酸亚铁[(H2NCH2COO)2Fe]可有效改善缺铁性贫血,化学兴趣小组的同学设计了如下两个实验:装置1制备碳酸亚铁晶体;装置2制备甘氨酸亚铁。已知:柠檬酸易溶于水,具有较强的酸性和还原性。回答下列问题:

I.碳酸亚铁晶体(FeCO3·nH2O)的制备
(1)实验操作如下:关闭f,打开e,然后关闭活塞a,打开活塞b、c,加入适量稀硫酸反应一段时间后,关闭活塞b、c,打开活塞a,以上操作的目的是___________ ;实验结束后,若装置B中没有出现碳酸亚铁晶体,可能的原因是___________ 。
(2)反应结束后,对装置B中的反应液进行静置、过滤、洗涤、干燥,得到碳酸亚铁晶体。过滤操作过程中用到的玻璃仪器有___________ ;干燥过程中可能有少量碳酸亚铁晶体被氧化为FeOOH,反应的化学方程式为___________ 。
II.甘氨酸亚铁[(H2NCH2COO)2Fe]的制备
实验操作如下:将装置1制取的碳酸亚铁晶体与甘氨酸的水溶液混合加入C中,关闭e,打开f,然后利用E中盐酸和碳酸钙反应生成的气体排尽装置中的空气,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。
(3)仪器h的名称为___________ ;试剂g为___________ (填试剂名称)。
(4)为了提高(H2NCH2COO)2Fe的产率,需要控制C中反应溶液的pH在5.6~6.0之间。若pH过低,(H2NCH2COO)2Fe的产率将降低,其原因为___________ ;滴入柠檬酸溶液的作用除了促进FeCO3的溶解,调节溶液的pH外,还有___________ 。
(5)(H2NCH2COO)2Fe中Fe2+含量的测定:使用电子天平准确称取3.640g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,向其中加入一定量的稀硫酸酸化,用0.05000 mol∙L−1KMnO4;标准溶液滴定至终点(已知滴定过程中只有Fe2+被氧化),消耗KMnO4标准溶液的体积为17.20mL。则产品中Fe2+的质量分数为___________ %(保留1位小数)。

I.碳酸亚铁晶体(FeCO3·nH2O)的制备
(1)实验操作如下:关闭f,打开e,然后关闭活塞a,打开活塞b、c,加入适量稀硫酸反应一段时间后,关闭活塞b、c,打开活塞a,以上操作的目的是
(2)反应结束后,对装置B中的反应液进行静置、过滤、洗涤、干燥,得到碳酸亚铁晶体。过滤操作过程中用到的玻璃仪器有
II.甘氨酸亚铁[(H2NCH2COO)2Fe]的制备
实验操作如下:将装置1制取的碳酸亚铁晶体与甘氨酸的水溶液混合加入C中,关闭e,打开f,然后利用E中盐酸和碳酸钙反应生成的气体排尽装置中的空气,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。
(3)仪器h的名称为
(4)为了提高(H2NCH2COO)2Fe的产率,需要控制C中反应溶液的pH在5.6~6.0之间。若pH过低,(H2NCH2COO)2Fe的产率将降低,其原因为
(5)(H2NCH2COO)2Fe中Fe2+含量的测定:使用电子天平准确称取3.640g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,向其中加入一定量的稀硫酸酸化,用0.05000 mol∙L−1KMnO4;标准溶液滴定至终点(已知滴定过程中只有Fe2+被氧化),消耗KMnO4标准溶液的体积为17.20mL。则产品中Fe2+的质量分数为
您最近一年使用:0次
2021-04-24更新
|
680次组卷
|
8卷引用:押全国卷理综第26题 实验综合-备战2021年高考化学临考题号押题(课标全国卷)
(已下线)押全国卷理综第26题 实验综合-备战2021年高考化学临考题号押题(课标全国卷)(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)安徽省皖南八校2021届高三4月第三次联考理综化学试题(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)山西省太原市第五中学2022届高三下学期5月阶段性检测理综化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
10 . 向煮沸过的NaOH溶液中加入新配制的 溶液,得到白色沉淀,白色沉淀迅速转化为浅灰绿色沉淀,一段时间后变为深灰绿色,最终变为红褐色。
溶液,得到白色沉淀,白色沉淀迅速转化为浅灰绿色沉淀,一段时间后变为深灰绿色,最终变为红褐色。
(1)配制 溶液时往往加入少量铁粉,目的是
溶液时往往加入少量铁粉,目的是___________ (用离子方程式表示)。
(2)白色沉淀最终变为红褐色的化学方程式为___________ 。
(3)煮沸NaOH溶液的目的是___________ 。
某兴趣小组经查阅资料后对浅灰绿色沉淀的形成原因提出如下假设,并设计实验进行验证。
假设I:白色 中部分+2价铁元素被氧化成+3价;
中部分+2价铁元素被氧化成+3价;
假设II:白色 胶状沉淀吸附了
胶状沉淀吸附了 。
。
(4)对假设I进行验证。
(5)对假设II进行验证
该小组同学配制了不同浓度的NaOH溶液(4mol•L-1、6mol•L-1、8mol•L-1)和 溶液(0.1mol•L-1、0.2mol•L-1、0.5mol•L-1),采用与(4)中“步骤1”相同的操作进行实验,对比得出结论,请帮他们完成下表。
溶液(0.1mol•L-1、0.2mol•L-1、0.5mol•L-1),采用与(4)中“步骤1”相同的操作进行实验,对比得出结论,请帮他们完成下表。
(6)某同学对第(5)问试管1得到的浅灰绿色沉淀进行水浴加热,观察到浅灰绿色沉淀变为白色沉淀,并有片状白色沉淀下沉的现象,由此得出实验结论:“假设I不成立,假设II成立”。你认为该判断是否合理?___________ (填“是”或“否”)。请解释产生此现象的原因:___________ 。
 溶液,得到白色沉淀,白色沉淀迅速转化为浅灰绿色沉淀,一段时间后变为深灰绿色,最终变为红褐色。
溶液,得到白色沉淀,白色沉淀迅速转化为浅灰绿色沉淀,一段时间后变为深灰绿色,最终变为红褐色。(1)配制
 溶液时往往加入少量铁粉,目的是
溶液时往往加入少量铁粉,目的是(2)白色沉淀最终变为红褐色的化学方程式为
(3)煮沸NaOH溶液的目的是
某兴趣小组经查阅资料后对浅灰绿色沉淀的形成原因提出如下假设,并设计实验进行验证。
假设I:白色
 中部分+2价铁元素被氧化成+3价;
中部分+2价铁元素被氧化成+3价;假设II:白色
 胶状沉淀吸附了
胶状沉淀吸附了 。
。(4)对假设I进行验证。
| 实验操作 | 实验现象 | 实验结论 | |
| 步骤1 | 向10mL煮沸并冷却后的1mol•L-1NaOH溶液中逐滴加入0.1mol•L-1FeSO4溶液。 | 操作过程中得到白色沉淀,白色沉淀迅速转化为浅灰绿色沉淀 | |
| 步骤2 | 往浅灰绿色沉淀中滴加过量稀硫酸。 | 浅灰绿色沉淀溶解 | |
| 步骤3 | 往步骤2所得溶液中滴加几滴 | 无明显现象 |
该小组同学配制了不同浓度的NaOH溶液(4mol•L-1、6mol•L-1、8mol•L-1)和
 溶液(0.1mol•L-1、0.2mol•L-1、0.5mol•L-1),采用与(4)中“步骤1”相同的操作进行实验,对比得出结论,请帮他们完成下表。
溶液(0.1mol•L-1、0.2mol•L-1、0.5mol•L-1),采用与(4)中“步骤1”相同的操作进行实验,对比得出结论,请帮他们完成下表。| NaOH溶液浓度 | FeSO4溶液浓度 | 实验现象 | 实验结论 | |
| 试管1 | ① | ② | 产生悬浮于液面的白色沉淀 (带有较多浅灰绿色) | ③ |
| 试管2 | ④ | ⑤ | 产生悬浮于液面的白色沉淀 (带有少量浅灰绿色) | |
| 试管3 | 8mol•L-1 | 0.1mol•L-1 | 产生悬浮于液面的白色沉淀,不产生浅灰绿色沉淀。 |
您最近一年使用:0次
2021-11-01更新
|
354次组卷
|
3卷引用:广东省肇庆市2021-2022学年高三上学期第一次统一检测化学试题
广东省肇庆市2021-2022学年高三上学期第一次统一检测化学试题(已下线)第13周 周测卷-备战2022年高考化学周测与晚练(新高考专用)湖南省株洲市第四中学2022-2023学年高三上学期第四次月考化学试题



