名校
1 . 血液里的蛋白质构成胶体分散系,但肾功能衰竭等疾病的患者,血液中会有大量的有害小分子或离子,所以要进行血液透析治疗,该方法的原理与下列哪种操作相同
| A.过滤 | B.渗析 | C.分液 | D.蒸馏 |
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题:
(1)某次滴定前滴定管液面如图所示,读数为___________ mL。

(2)农业常用的三类化肥有①草木灰②Ca(H2PO4)2③NH4NO3,其中能混合施用的是___________ (填序号)。
(3)取等体积物质的量浓度相等的 、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为: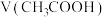
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)常温下,向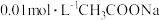 溶液中分别加入
溶液中分别加入 固体、
固体、 固体,则
固体,则 水解平衡移动的情况分别为
水解平衡移动的情况分别为___________ (填“向左移动”“向右移动”或“不移动”,下同)、___________ 。
(5)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是___________(填标号)。
(6)水的电离平衡曲线如下图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,将100℃下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___________ 。

(7)25℃时,将a mol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ (填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(1)某次滴定前滴定管液面如图所示,读数为

(2)农业常用的三类化肥有①草木灰②Ca(H2PO4)2③NH4NO3,其中能混合施用的是
(3)取等体积物质的量浓度相等的
 、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为: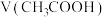
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)常温下,向
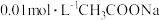 溶液中分别加入
溶液中分别加入 固体、
固体、 固体,则
固体,则 水解平衡移动的情况分别为
水解平衡移动的情况分别为(5)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是___________(填标号)。
| A.c(H+) > c(OH-) | B.c(H+) < c(OH-) |
| C.c(H+)+c(HCN) = c(OH-) | D.c(HCN)+ c(CN-)=0.01mol/L |

(7)25℃时,将a mol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显
您最近一年使用:0次
名校
解题方法
3 . 下列有关实验操作的叙述合理的是
| A.用pH试纸测定溶液的pH时,不需要提前润湿 |
| B.中和反应反应热测定实验中,为防止溅出应将50mL 0.55mol/LNaOH分次缓慢倒入盛有50mL0.50mol/LHCl小烧杯中 |
C.可用如图装置测定过氧化氢分解反应的化学反应速率 |
| D.用pH试纸测定新配制氯水的pH值 |
您最近一年使用:0次
名校
4 . 铁、铝和铜是人类使用最广泛的金属。回答下列问题:
(1)根据电子排布的特点,Al位于元素周期表的__ (填标号,下同),Fe位于元素周期表的__ 。
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为__ ,在元素周期表中位于第__ 周期,基态Cu+的电子排布式为__ 。
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为__ 。
(1)根据电子排布的特点,Al位于元素周期表的
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO
 ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为
您最近一年使用:0次
2022-01-09更新
|
228次组卷
|
2卷引用:辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
5 . 如图所示,烧杯中均为不饱和溶液,通电一段时间后,C池溶液增重6.3g。(C一指石墨电极)

请回答:
(1)X是电源的___________ 极
(2)A池中Fe极___________ (选填“减重”“增重”)___________ g
(3)E池中放出标况下气体___________ L(假设气体不溶于水);F池中析出Ag___________ g
(4)各池溶液pH升高的有___________ (填字母,下同);原溶液浓度变大的有___________ ;原溶液浓度不变的有___________ 。

请回答:
(1)X是电源的
(2)A池中Fe极
(3)E池中放出标况下气体
(4)各池溶液pH升高的有
您最近一年使用:0次
名校
解题方法
6 . 下列有关卤化氢的说法正确的是
| A.键长:H—F>H—Cl>H—Br>H—I |
| B.键能:H—F<H—Cl<H—Br<H—I |
| C.形成共价键的两个原子之间的核间距叫做键长 |
| D.H—F键是p—pσ键 |
您最近一年使用:0次
2021-12-14更新
|
381次组卷
|
5卷引用:辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题
辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题(已下线)第2.1.2讲 键参数——键能、键长与键角-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)安徽省滁州市九校2021-2022学年高二下学期3月月考化学试题新疆昌吉州行知学校2021-2022学年高二下学期第一次月考化学试题(已下线)第03讲 共价键-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
名校
解题方法
7 . 回答下列问题
(1)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇(CH3OH)。
①该法利用CO2制取甲醇的有关化学反应如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH1=-178 kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2(g) = 2 H2O (g) ΔH3=-483.6 kJ·mol-1
由此计算CO (g) +2H2 (g) = CH3OH(g) ΔH=___________ kJ/mol。
②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
2CH3OH(l) + 3O2(g) = 2CO2(g) +4H2O (l) ΔH1=-a kJ·mol-1
2CH3OH(g) + 3O2(g) = 2CO2(g) + 4H2O (l) ΔH1=-b kJ·mol-1
CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O (l) ΔH1=-c kJ·mol-1
CH3OH(l) +O2(g) = CO(g) + 2 H2O (l) ΔH1=-d kJ·mol-1
由此知,a、b、c、d由小到大排序为___________ 。
③将甲醇完全燃烧生成液态水的反应设计成原电池,以KOH为电解质。工作时负极的电极反应式___________ 。
(2)某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:
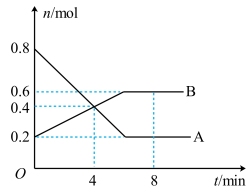
①该反应的化学方程式为___________ 。
②若降低温度,则该反应的正反应速率___________ (填“加快”“减慢”或“不变”,下同),逆反应速率___________ 。
③平衡时A的转化率为___________ 。
④反应达到平衡,此时体系内压强与开始时的压强之比为___________ 。
(1)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇(CH3OH)。
①该法利用CO2制取甲醇的有关化学反应如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH1=-178 kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2(g) = 2 H2O (g) ΔH3=-483.6 kJ·mol-1
由此计算CO (g) +2H2 (g) = CH3OH(g) ΔH=
②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
2CH3OH(l) + 3O2(g) = 2CO2(g) +4H2O (l) ΔH1=-a kJ·mol-1
2CH3OH(g) + 3O2(g) = 2CO2(g) + 4H2O (l) ΔH1=-b kJ·mol-1
CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O (l) ΔH1=-c kJ·mol-1
CH3OH(l) +O2(g) = CO(g) + 2 H2O (l) ΔH1=-d kJ·mol-1
由此知,a、b、c、d由小到大排序为
③将甲醇完全燃烧生成液态水的反应设计成原电池,以KOH为电解质。工作时负极的电极反应式
(2)某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:

①该反应的化学方程式为
②若降低温度,则该反应的正反应速率
③平衡时A的转化率为
④反应达到平衡,此时体系内压强与开始时的压强之比为
您最近一年使用:0次
2021-12-04更新
|
233次组卷
|
2卷引用:辽宁省辽河油田第一高级中学2020-2021学年高一(A部)下学期期中考试化学试题
名校
8 . 按照要求回答下列问题:
(1)乙醇发生催化氧化反应的化学方程式为___________ 。
(2)有机物 CH3CH(C2H5)CH(CH3)2命名___________ (系统命名法)
(3)下列几组物质中,互为同分异构体的是___________ (填字母,下同);互为同系物的是___________ ;互为同素异形体的是___________ 。
A.甲烷与新戊烷 B.氧气和臭氧
C.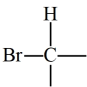 和
和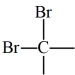 D.35Cl和37Cl
D.35Cl和37Cl
E.CH3CH2OH和CH3OCH3
(4)某仅由碳氢两种元素组成的有机化合物,经测定其相对分子质量为86,含碳量为83.72%,写出其一氯代物有两种的同分异构体的结构简式___________ 。
(1)乙醇发生催化氧化反应的化学方程式为
(2)有机物 CH3CH(C2H5)CH(CH3)2命名
(3)下列几组物质中,互为同分异构体的是
A.甲烷与新戊烷 B.氧气和臭氧
C.
 和
和 D.35Cl和37Cl
D.35Cl和37ClE.CH3CH2OH和CH3OCH3
(4)某仅由碳氢两种元素组成的有机化合物,经测定其相对分子质量为86,含碳量为83.72%,写出其一氯代物有两种的同分异构体的结构简式
您最近一年使用:0次
名校
9 . I.Cl2是一种重要的化工原料,实验室通常用MnO2和浓盐酸制取Cl2。
(1)写出该反应离子方程式:_______ ,若将8.7gMnO2投入足量浓盐酸充分反应,被氧化的HCl的物质的量为_______ mol,转移的电子数目为_______ 。
(2)将H2点燃后,将导管缓慢伸入充满Cl2的集气瓶中,现象为_______ 。将Cl2通入新制的FeCl2溶液中离子反应方程式为_______ 。
II.氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(3)铋在元素周期表中的位置为_______ ,锑的原子序数为_______
(4)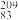 Bi的中子数与质子数的差值为
Bi的中子数与质子数的差值为_______
(5)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性。它可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行化学镀银时,氧化剂与还原剂的物质的量之比为_______ 。
(1)写出该反应离子方程式:
(2)将H2点燃后,将导管缓慢伸入充满Cl2的集气瓶中,现象为
II.氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(3)铋在元素周期表中的位置为
(4)
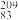 Bi的中子数与质子数的差值为
Bi的中子数与质子数的差值为(5)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性。它可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行化学镀银时,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的有
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
①在周期表中,同周期第ⅡA族和第ⅢA族元素质子数相差可能是1、11或25
②同主族元素从上至下,单质的氧化性逐渐减弱,熔点逐渐降低
③碱性:LiOH>NaOH>KOH>RbOH
④酸性:H2SO4>HClO4>HBrO4>HIO4
⑤卤族元素由上至下,阴离子的还原性增强,单质的颜色加深
⑥碱金属单质物理通性是硬度小,密度小,熔点低
⑦碱金属元素的原子半径和离子半径都随核电荷数的增大而增大
⑧可以利用非金属单质与H2反应的难易程度来证明其元素非金属性的强弱
| A.4个 | B.5个 | C.6个 | D.7个 |
您最近一年使用:0次
2021-12-03更新
|
348次组卷
|
2卷引用:辽宁省辽河油田第一高级中学2020-2021学年高一上学期期末考试化学试题(A部)



