名校
1 . 回答下列问题
(1)现有5种元素A、B、C、D、E,其中有3种金属元素,1种稀有气体元素,其I1~I3分别如下表。
根据表中数据判断其中的金属元素为___________ ,稀有气体元素为___________ ,显正二价的金属元素是___________ 。(填字母)
(2)水分子是H2O而不是H3O,是因为共价键具有___________ 性;水分子的键角为105°,是因为共价键具有___________ 性。
(3)1mol乙酸分子CH3COOH中含有的π键与σ键的数目之比为___________ 。
(4)已知NH5为离子化合物,则1molNH5晶体中含有的共价键数目为___________ 。
(1)现有5种元素A、B、C、D、E,其中有3种金属元素,1种稀有气体元素,其I1~I3分别如下表。
| 元素 | I1/eV | I2/eV | I3/eV |
| A | 13.0 | 23.9 | 40.0 |
| B | 4.3 | 31.9 | 47.8 |
| C | 5.7 | 47.4 | 71.8 |
| D | 7.7 | 15.1 | 80.3 |
| E | 21.6 | 41.1 | 65.2 |
(2)水分子是H2O而不是H3O,是因为共价键具有
(3)1mol乙酸分子CH3COOH中含有的π键与σ键的数目之比为
(4)已知NH5为离子化合物,则1molNH5晶体中含有的共价键数目为
您最近一年使用:0次
2 . 根据表中数据(室温),回答下列问题:
已知氢氟酸、醋酸、次氯酸(HClO)、碳酸的电离常数分别为:
(1)写出以下反应的离子方程式:
①足量的氢氟酸与碳酸钠溶液混合:___________ ;
②少量的CO2通入NaClO溶液:___________ 。
(2)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)___________ mol/L(填精确值), =
=___________ 。
(3)25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,充分混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为___________ 。
(4)室温下pH=9的NaOH溶液和pH=10的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于___________ 。
(5)甲醇与CO可以生成醋酸,常温下将amol/L的醋酸与bmol∙L-1Ba(OH)2溶液以2∶1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO-),则醋酸的电离平衡常数为_______ (用含a和b的代数式表示)。
已知氢氟酸、醋酸、次氯酸(HClO)、碳酸的电离常数分别为:
| HF | Ka=6.8×10-4mol•L-1 |
| CH3COOH | Ka=1.7×10-5mol•L-1 |
| HClO | Ka=2.9×10-8mol•L-1 |
| H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11mol•L-1 |
①足量的氢氟酸与碳酸钠溶液混合:
②少量的CO2通入NaClO溶液:
(2)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)
 =
=(3)25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,充分混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为
(4)室温下pH=9的NaOH溶液和pH=10的CH3COONa溶液,设由水电离产生的OH﹣的物质的量浓度分别为A和B,则A/B等于
(5)甲醇与CO可以生成醋酸,常温下将amol/L的醋酸与bmol∙L-1Ba(OH)2溶液以2∶1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO-),则醋酸的电离平衡常数为
您最近一年使用:0次
3 . 工业废水中含 会污染环境,必须进行处理。某化学兴趣小组设计了三种方案。
会污染环境,必须进行处理。某化学兴趣小组设计了三种方案。
方案1:还原法。
处理工艺流程如下:

(1) 中铬元素的化合价为
中铬元素的化合价为_____ 。
(2)下列溶液中,可替代 的是_____(填选项序号字母)。
的是_____(填选项序号字母)。
(3)常温下, 的
的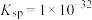 ,当
,当 恰好完全沉淀时(当离子浓度为
恰好完全沉淀时(当离子浓度为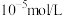 ,可认为离子完全沉淀),溶液的
,可认为离子完全沉淀),溶液的
_____ 。
(4)用离子方程式表示水溶液中 转化为
转化为 的平衡
的平衡_____ ;
方案2:电解法。
下图是以 处理含的酸性废水的电解装置示意图(电极材料分别为铁和石墨)。
处理含的酸性废水的电解装置示意图(电极材料分别为铁和石墨)。

(5)装置中b电极反应式为_____ 。该处理过程中, 被还原成
被还原成 的离子方程式为
的离子方程式为_____ 。若处理 ,电路中转移电子的数目最少为
,电路中转移电子的数目最少为_____ 。
 会污染环境,必须进行处理。某化学兴趣小组设计了三种方案。
会污染环境,必须进行处理。某化学兴趣小组设计了三种方案。方案1:还原法。
处理工艺流程如下:

(1)
 中铬元素的化合价为
中铬元素的化合价为(2)下列溶液中,可替代
 的是_____(填选项序号字母)。
的是_____(填选项序号字母)。A. 溶液 溶液 | B.浓 溶液 溶液 |
C.酸性 溶液 溶液 | D. 溶液 溶液 |
 的
的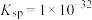 ,当
,当 恰好完全沉淀时(当离子浓度为
恰好完全沉淀时(当离子浓度为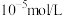 ,可认为离子完全沉淀),溶液的
,可认为离子完全沉淀),溶液的
(4)用离子方程式表示水溶液中
 转化为
转化为 的平衡
的平衡方案2:电解法。
下图是以
 处理含的酸性废水的电解装置示意图(电极材料分别为铁和石墨)。
处理含的酸性废水的电解装置示意图(电极材料分别为铁和石墨)。
(5)装置中b电极反应式为
 被还原成
被还原成 的离子方程式为
的离子方程式为 ,电路中转移电子的数目最少为
,电路中转移电子的数目最少为
您最近一年使用:0次
名校
解题方法
4 . 化学与生产生活、社会发展息息相关,下列说法正确的是
| A.C919大型客机使用的碳纤维材料属于有机高分子材料 |
| B.碘酒、“84”消毒液、75%的酒精、生理盐水都可用于消毒 |
| C.发泡塑料盒不适合于盛放含油较多的食品,可用于微波炉加热 |
| D.战国·曾侯乙编钟属于青铜制品,青铜是我国使用最早的合金 |
您最近一年使用:0次
5 . 下列说法正确的是
①Be与Al在周期表中处于对角线位置,可推出:Be(OH)2+2OH-=BeO +2H2O
+2H2O
②最外层电子数为ns2的元素都在元素化学性质都相似
③充有氖气的霓虹灯管通电时会发出红色光的主要原因,是电子由基态向激发态跃迁
时吸收除红光以外的光线
④某价层电子排布为4d54s1的基态原子,该元素位于周期表中第四周期第ⅠB族
⑤电子云图中的小黑点的疏密程度表示电子在原子核外单位体积内出现概率的大小
①Be与Al在周期表中处于对角线位置,可推出:Be(OH)2+2OH-=BeO
 +2H2O
+2H2O②最外层电子数为ns2的元素都在元素化学性质都相似
③充有氖气的霓虹灯管通电时会发出红色光的主要原因,是电子由基态向激发态跃迁
时吸收除红光以外的光线
④某价层电子排布为4d54s1的基态原子,该元素位于周期表中第四周期第ⅠB族
⑤电子云图中的小黑点的疏密程度表示电子在原子核外单位体积内出现概率的大小
| A.③⑤ | B.①②⑤ | C.②③④ | D.①⑤ |
您最近一年使用:0次
名校
解题方法
6 . 下列实验装置能达到对应实验目、实验结论正确的是
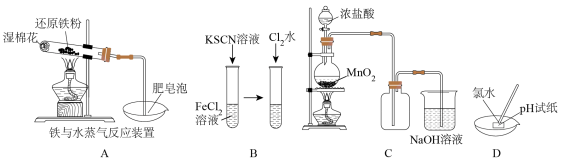

| A.过量铁粉与水蒸气反应后,可用磁铁将剩余铁粉分离出来 |
| B.用图装置操作方法,可检验Fe2+ |
| C.若二氧化锰过量,则盐酸可全部消耗完 |
| D.测新制氯水的pH值 |
您最近一年使用:0次
2023-09-04更新
|
428次组卷
|
2卷引用:辽宁省大连市第八中学2021-2022学年高一上学期12月月考化学试题
名校
7 . 下列有关叙述正确的有几个:
①工业上通常采用铁触媒、400~500℃和10MPa~30Mpa的条件下合成氨。
②等体积、等pH的盐酸和醋酸,分别与等浓度的NaOH反应,醋酸消耗的NaOH体积大。
③为了除去除垢中的CaSO4,可用Na2CO3溶液浸泡水垢,使之转化为疏松、易溶于酸的CaCO3,然后用酸除去。
④将AlCl3溶液加热蒸干并灼烧,所得产物是Al(OH)3
⑤强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
⑥医疗上使用BaSO4作“钡餐”,而不使用BaCO3,与沉淀溶解平衡无关。
⑦反应CaSO4(s)=CaO(s)+SO3(g) ΔH>0在高温下能自发进行
⑧用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
⑨通过压缩体积增大压强,可以提高单位体积内活化分子百分数,从而提高反应速率
⑩在中和热的测定实验中,每组实验至少三次使用温度计。
①工业上通常采用铁触媒、400~500℃和10MPa~30Mpa的条件下合成氨。
②等体积、等pH的盐酸和醋酸,分别与等浓度的NaOH反应,醋酸消耗的NaOH体积大。
③为了除去除垢中的CaSO4,可用Na2CO3溶液浸泡水垢,使之转化为疏松、易溶于酸的CaCO3,然后用酸除去。
④将AlCl3溶液加热蒸干并灼烧,所得产物是Al(OH)3
⑤强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
⑥医疗上使用BaSO4作“钡餐”,而不使用BaCO3,与沉淀溶解平衡无关。
⑦反应CaSO4(s)=CaO(s)+SO3(g) ΔH>0在高温下能自发进行
⑧用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
⑨通过压缩体积增大压强,可以提高单位体积内活化分子百分数,从而提高反应速率
⑩在中和热的测定实验中,每组实验至少三次使用温度计。
| A.3 | B.4 | C.5 | D.6 |
您最近一年使用:0次
名校
解题方法
8 . LiFePO4是新一代理想型正极材料,某科研小组设计由钛磁铁矿(主要成分为FeTiO3,还含有少量MgO和SiO2等杂质)制备LiFePO4的工艺流程图如下:

已知25℃时相关金属离子[co(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
(1)列举滤渣A的一种用途_____ ,请写出滤渣A与NaOH溶液反应的离子方程式_____ 。
(2)为了加快钛磁铁矿酸浸速率,可采取的措施有_______ (任答两条即可)。
(3)写出氧化过程发生的离子方程式:_______ ,氧化需要控制在适当的温度下进行,温度不宜过高的原因是_______ 。
(4)写出“高温煅烧”制备LiFePO4的化学方程式:_______ 。
(5)新一代LiFePO4电池是一种高能量密度、电性能优良的新型电池,其工作原理如图所示,电池反应:LixC6+Li1-xFePO4 LiFePO4+6C。
LiFePO4+6C。

①放电时,正极反应式:_______ 。
②充电时,LixC6电极增重14g时,电路中转移电子数目为_______ 。

已知25℃时相关金属离子[co(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Mg2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 8.9 |
| 沉淀完全的pH | 8.3 | 3.2 | 10.9 |
(1)列举滤渣A的一种用途
(2)为了加快钛磁铁矿酸浸速率,可采取的措施有
(3)写出氧化过程发生的离子方程式:
(4)写出“高温煅烧”制备LiFePO4的化学方程式:
(5)新一代LiFePO4电池是一种高能量密度、电性能优良的新型电池,其工作原理如图所示,电池反应:LixC6+Li1-xFePO4
 LiFePO4+6C。
LiFePO4+6C。
①放电时,正极反应式:
②充电时,LixC6电极增重14g时,电路中转移电子数目为
您最近一年使用:0次
名校
解题方法
9 . “建设生态文明是中华民族永续发展的千年大计”。控制和治理NOx、SO2是解决光化学烟雾、减少酸雨、提高空气质量的有效途径,对构建生态文明有着极为重要的意义。
(1)NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图1所示:

SCR催化化反器中NH3还原NO2的程式为_______ 。
(2)用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
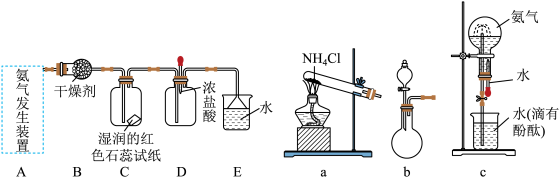
①若氨气的发生装置选择a,则其化学反应方程式为_______ 。
②若氨气的发生装置选择b,则所用的试剂为_______ 和_______ 。
③用c装置做氨气喷泉实验时,如果没有胶头滴管,请写出引发喷泉的简单操作是_______ 。
(3)为探究本地区雾霾中的可溶性粒的成分,某化学研究性小组进行了实验探究。
(查阅资料)粒样品中可能含有 、
、 、
、 、
、 、
、 、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)
、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)

请回答下列问题
①根据上述实验,雾浸取液中一定含有的离子为_______ ;肯定不含的离子为_______ 。
②若气体D遇空气会变成红棕色,则沉淀A中一定含有_______ (填化学式)
(1)NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理如图1所示:

SCR催化化反器中NH3还原NO2的程式为
(2)用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。

①若氨气的发生装置选择a,则其化学反应方程式为
②若氨气的发生装置选择b,则所用的试剂为
③用c装置做氨气喷泉实验时,如果没有胶头滴管,请写出引发喷泉的简单操作是
(3)为探究本地区雾霾中的可溶性粒的成分,某化学研究性小组进行了实验探究。
(查阅资料)粒样品中可能含有
 、
、 、
、 、
、 、
、 、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)
、Cl-、Br-及一种见阳离子M),现进行如下实验(已知AgBr为淡黄色)
请回答下列问题
①根据上述实验,雾浸取液中一定含有的离子为
②若气体D遇空气会变成红棕色,则沉淀A中一定含有
您最近一年使用:0次
名校
解题方法
10 . 下列有关说法不正确的是

| A.图1是科学家制成的用C60作车轮的“纳米汽车”,直径约6到9纳米。用激光笔照射该“纳米汽车”分散在蒸馏水中形成的分系线,光线通过时出现明亮的光路 |
| B.图2中的彩色玻璃是制玻璃过程中加入一些金属氧化物或盐制得的,可用于建筑和装饰 |
| C.图3首次实现在月球背面着陆的“玉兔二号”月球车,其太阳能电池帆板工作时的能量转化过程为:太阳能—化学能一电能 |
| D.图4为中国天眼”,其镜片材料为SiC,具有类似金刚石的结构,硬度大,断裂其中化学键Si-C,需要吸收能量 |
您最近一年使用:0次
2023-01-29更新
|
713次组卷
|
6卷引用:辽宁省沈阳市第二中学2020-2021学年高一下学期期中考试化学试题



