1 . 双极膜由阳离子交换膜、催化剂层和阴离子交换膜组合而成,在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-,将其与阳离子交换膜(阳膜)、阴离子交换膜(阴膜)组合,可有多种应用。
(1)海水淡化:模拟海水淡化,并获得浓盐酸和浓氢氧化钠溶液。双极膜组合电解装置示意图如图。

①X极是___ 极。
②图中双极膜的右侧得到的是___ (填“H+”或“OH-”),电解后在___ 出口可获得较浓的盐酸(填“a”“b”或“c”)。
③电解过程中阳极区溶液中的n(OH-)___ (填“变大”“变小”或“基本不变”)。
(2)新型Zn—CO2水介质电池,为解决环境和能源问题提供了一种新途径。电池示意图如图,电极为金属锌和选择性催化材料。放电时温室气体CO2被转化为储氢物质甲酸等。

①放电时电池负极反应为___ 。
②放电时,1molCO2转化为HCOOH,转移的电子数为___ mol。
③充电时,电池总反应为___ 。
(1)海水淡化:模拟海水淡化,并获得浓盐酸和浓氢氧化钠溶液。双极膜组合电解装置示意图如图。

①X极是
②图中双极膜的右侧得到的是
③电解过程中阳极区溶液中的n(OH-)
(2)新型Zn—CO2水介质电池,为解决环境和能源问题提供了一种新途径。电池示意图如图,电极为金属锌和选择性催化材料。放电时温室气体CO2被转化为储氢物质甲酸等。

①放电时电池负极反应为
②放电时,1molCO2转化为HCOOH,转移的电子数为
③充电时,电池总反应为
您最近一年使用:0次
名校
解题方法
2 . 近日,海外媒体报道称,美国芝加哥伊利诺伊大学的研究人员创造了第一个可用的锂碳氧化物电池(简称为Li—CO2电池),新电池的能量密度约是目前锂离子电池能量密度的7倍,可以帮助纯电动车型大大增加续航能力。该电池的工作原理如图所示。下列说法错误的是
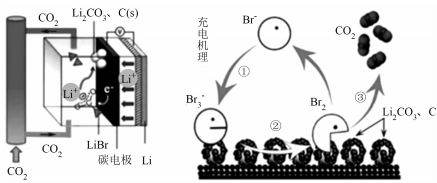

| A.该电池在可再生能源转换和储存方面具有良好的前景 |
| B.放电时,负极反应式为:4Li++4e-+3CO2=2Li2CO3+C |
| C.充电时转化③发生的反应为2Li2CO3+C+2Br2=3CO2↑+4LiBr |
| D.放电时,碳电极上的电势高于Li电极 |
您最近一年使用:0次
2021-12-17更新
|
158次组卷
|
2卷引用:辽宁省名校联盟2021-2022学年高二12月联考化学试题
名校
解题方法
3 . 下列关于金属的腐蚀与防护说法正确的是
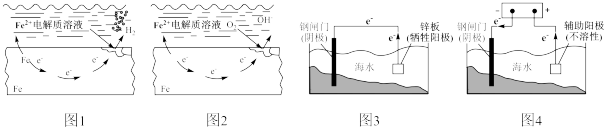
| A.取图1溶液滴加K3[Fe(CN)6]溶液,溶液变蓝 |
| B.图2是钢铁的吸氧腐蚀,在钢铁表面吸附的水膜呈酸性时不会发生 |
| C.图3图4都要采用辅助阳极,用作辅助阳极的金属材料可以相同 |
| D.图3图4辅助阳极的电极反应类型相同 |
您最近一年使用:0次
2021-12-17更新
|
369次组卷
|
4卷引用:辽宁省名校联盟2021-2022学年高二12月联考化学试题
解题方法
4 . 制造尼龙—66的原料己二腈NC(CH2)4CN,传统上以乙炔和甲醛为原料经过很长路线才能合成。近年来将丙烯氰电解阴极加氢生成己二腈的电有机合成法在工业化生产中已经非常成熟。其总反应为:4CH2=CHCN+2H2O=2NC(CH2)4CN+O2↑。下列说法不正确的是
| A.若电解过程有1mol电子转移,理论上阳极生成0.25mol气体 |
| B.阳极电极反应式为:2CH2=CHCN+2H++2e-=NC(CH2)4CN |
| C.很多不能自发进行的氧化还原反应可以通过电解法来实现 |
| D.与传统有机合成相比,电有机合成法反应条件温和、反应试剂纯净且生产效率高 |
您最近一年使用:0次
5 . 在现代工业中,锰及其化合物应用于国民经济的各个领域,其中钢铁工业是最重要的领域,用锰量占90%—95%,主要作为炼铁炼钢过程中的脱氧剂和脱硫剂。在自然界中,锰有II、III、IV及VII价态,对于基态锰原子,下列叙述错误的是
| A.基态锰原子核外电子的运动状态有25种 |
| B.4s电子能量较高,总是在比3s电子离核更远的地方运动 |
| C.电负性比钾高,原子对键合电子的吸引力比钾大 |
| D.锰元素位于周期表的d区 |
您最近一年使用:0次
2021-12-17更新
|
532次组卷
|
2卷引用:辽宁省名校联盟2021-2022学年高二12月联考化学试题
解题方法
6 . 锗是一种呈灰白色的稀有金属,在自然界中的分布极为分散,所以很难看到有独立成矿的锗,一般与含硫化物的铅、锌、铜以及特定的煤炭伴生,提取比较麻烦,产量也不高。如图为工业上利用锗锌矿(主要成分GeO2和ZnS少量Fe2O3)来制备高纯度锗的流程。
已知:1.GeCl4沸点低(83.1℃)易水解,在浓盐酸中溶解度低。
2.GeO2可溶于强碱溶液,生成锗酸盐。

(1)根据元素周期表中位置推测,锗和砷元素最高正价含氧酸的酸性: > (用含氧酸化学式表示)__ 。滤渣2中除含有MgGeO3外,还含有少量__ 。
(2)步骤⑤中加入浓盐酸,发生主要反应的化学方程式为__ ,不用稀盐酸的原因是__ 。
(3)步骤⑥发生反应的化学方程式为__ 。
(4)如表是不同镁化合物对锗回收率的影响,实验中选用MgCl2、MgSO4或MgO作为沉淀剂,以及不同n(Mg)/n(Ge)条件下锗的回收率。
表1不同Mg/Ge摩尔比条件下的错回收率/%
表2不同镁化合物对锗回收率的影响
由表1可知工业上n(Mg)/n(Ge)=__ ,锗的回收率比较理想,由表2可知,MgCl2与MgSO4作为沉淀剂,锗的回收率都比较理想,而MgO的沉淀效果不理想,这可能是因为__ 。
(5)用氢气还原GeO2可制得金属锗。其反应如下:①GeO2+H2=GeO+H2O②GeO+H2=Ge+H2O③GeO2+2H2=Ge+2H2O。反应式③△H=+13728kJ•mol-1,△S=+15600J/(K•mol-1),则还原反应的温度一般控制在__ ℃范围内。【已知GeO在700℃会升华,T(K)=t(℃)+273】
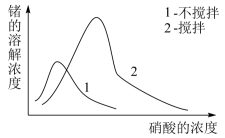
(6)锗的性质与铝相似,锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时锗表面被__ 所致。
已知:1.GeCl4沸点低(83.1℃)易水解,在浓盐酸中溶解度低。
2.GeO2可溶于强碱溶液,生成锗酸盐。

(1)根据元素周期表中位置推测,锗和砷元素最高正价含氧酸的酸性: > (用含氧酸化学式表示)
(2)步骤⑤中加入浓盐酸,发生主要反应的化学方程式为
(3)步骤⑥发生反应的化学方程式为
(4)如表是不同镁化合物对锗回收率的影响,实验中选用MgCl2、MgSO4或MgO作为沉淀剂,以及不同n(Mg)/n(Ge)条件下锗的回收率。
表1不同Mg/Ge摩尔比条件下的错回收率/%
| 水解母液 | n(Mg)/n(Ge) | |||||
| 0 | 0.5 | 1 | 1.5 | 2 | 2.5 | |
| 1# | 65.3 | 92.4 | 95.9 | 98.5 | 99.1 | 99.1 |
| 2# | 57.1 | 90.5 | 94.9 | 98.2 | 98.8 | 98.9 |
| 3# | 41.6 | 87.1 | 93.1 | 97.5 | 98.5 | 98.5 |
表2不同镁化合物对锗回收率的影响
| 镁化合物 | 回收率/% |
| MgCl2 | 98.3 |
| MgSO4 | 98.2 |
| MgO | 85.3 |
由表1可知工业上n(Mg)/n(Ge)=
(5)用氢气还原GeO2可制得金属锗。其反应如下:①GeO2+H2=GeO+H2O②GeO+H2=Ge+H2O③GeO2+2H2=Ge+2H2O。反应式③△H=+13728kJ•mol-1,△S=+15600J/(K•mol-1),则还原反应的温度一般控制在
(6)锗的性质与铝相似,锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时锗表面被

您最近一年使用:0次
解题方法
7 . 全球气候变化对全球人类社会构成重大威胁。政府气候变化专门委员会(IPCC)报告认为,为了避免极端危害,世界必须将全球变暖幅度控制在1.5℃以内。只有全球都在21世纪中叶实现温室气体净零排放,才能有可能实现这一目标。请根据二氧化碳的利用回答下列问题:
(1)CO2催化氢化制甲烷的研究过程如图1:
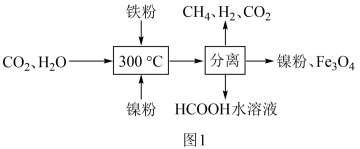
①上述过程中,加入铁粉的作用是__ 。
②HCOOH是CO2转化为CH4的中间体:CO2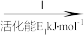 HCOOH
HCOOH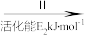 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是__ 。
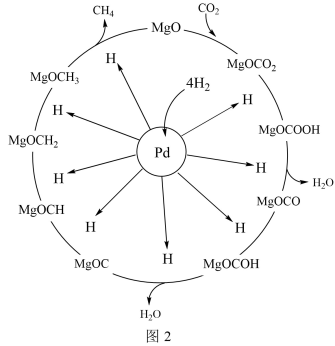
(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为__ 。
(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=__ k正。
②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强__ (填“>”“<”或“=”)T1℃时平衡压强。
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l) MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。
①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显__ 性(填酸,碱,中)。
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g) C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=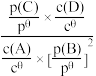 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=__ (计算结果保留两位小数)。
(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:
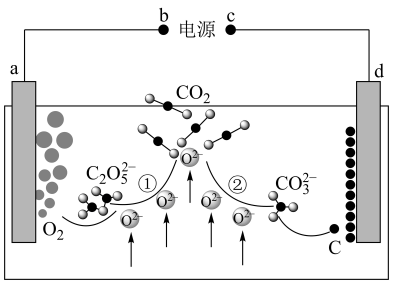
a极的电极反应式为__ 。
(1)CO2催化氢化制甲烷的研究过程如图1:

①上述过程中,加入铁粉的作用是
②HCOOH是CO2转化为CH4的中间体:CO2
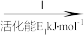 HCOOH
HCOOH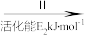 CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,原因是(2)一定条件下,Pd—Mg/SiO2催化剂可使CO2甲烷化从而变废为宝,其反应机理如图2所示,该反应的化学方程式为

(3)CO2加氢还可制备甲酸(HCOOH)。
①温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)
 HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
HCOOH(g) △H=-31.4kJ•mol-1 K=0.8。实验测得:v正=k正c(CO2)•c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=②温度为T2℃时,k正=1.1k逆,则T2℃时平衡压强
(4)N—甲基二乙醇胺(用MDEA表示)水溶液具有吸收能力强、对设备腐蚀小等特点,MDEA吸收CO2的反应可以表示为:MDEA(aq)+CO2(g)+H2O(l)
 MDEAH+(aq)+HCO
MDEAH+(aq)+HCO (aq) △H。
(aq) △H。①已知MDEA中的氮具有一元碱(类似于NH3)的性质,Kb=5.2×10-4,已知H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,推测溶液MDEAHHCO3显
②标准平衡常数Kθ可以表示平衡时各物质的浓度关系:如反应A(aq)+2B(g)
 C(g)+D(aq)的Kθ=
C(g)+D(aq)的Kθ=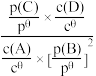 ,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=
,其中cθ=2mol/L,pθ为标准大气压,p(B)、p(C)分别为气体的分压,c为物质的量浓度,T℃时,在刚性密闭容器中有20L2.5mol/L的MDEA溶液,氮气(不参加反应)和二氧化碳混合气体14mol,起始气体总压为pθkPa,充分吸收后,MDEA浓度降低为20L2.2mol/L,二氧化碳的吸收率为60%,忽略反应过程中溶液的体积变化,则反应的标准平衡常数Kθ=(5)设计二氧化碳熔盐捕获及电化学转化装置示意图如图:

a极的电极反应式为
您最近一年使用:0次
名校
8 . 从铜氨废液含[Cu(NH3)3•CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、CO 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图:

已知硫化铜的溶解度小于氢氧化铜的溶解度,下列说法正确的是
 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图:
已知硫化铜的溶解度小于氢氧化铜的溶解度,下列说法正确的是
| A.步骤(Ⅰ)的热空气的作用是将碳元素转化为二氧化碳 |
| B.由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的强,同理,向银氨溶液(主要成分为[Ag(NH3)2]OH)中加入盐酸,可产生白色沉淀 |
| C.步骤(Ⅲ)“沉铜”时,利用Na2S溶液,而不选用NaOH溶液是因为硫化钠廉价易得 |
| D.该流程中没有可以循环利用的物质 |
您最近一年使用:0次
2021-12-16更新
|
378次组卷
|
4卷引用:辽宁省铁岭市六校2021-2022学年高三12月月考化学试题
辽宁省铁岭市六校2021-2022学年高三12月月考化学试题(已下线)二轮拔高卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)辽宁省沈阳市第二中学2022-2023学年高三上学期期中考试化学试题(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编
9 . 实验室合成乙酰苯胺的路线如图(部分反应条件略去),下列说法正确的是
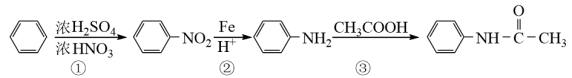
已知:①酰胺键在通常情况下较难水解,在酸或碱的存在下加热时,则可加速反应
②—NH2可结合氢离子
③20℃时乙酰苯胺在乙醇中的溶解度为36.9g,乙酰苯胺在水中的溶解度如表:

已知:①酰胺键在通常情况下较难水解,在酸或碱的存在下加热时,则可加速反应
②—NH2可结合氢离子
③20℃时乙酰苯胺在乙醇中的溶解度为36.9g,乙酰苯胺在水中的溶解度如表:
| 温度/℃ | 25 | 50 | 80 | 100 |
| 溶解度/g | 0.56 | 0.84 | 3.5 | 5.5 |
| A.制备硝基苯时,为了减少苯的挥发和硝酸分解,应用酒精灯小火加热 |
| B.反应②中加入酸的量的多少不会影响乙酰苯胺产率 |
| C.除去乙酰苯胺中的乙酸步骤:水洗→碱洗→水洗,检验乙酸是否除尽的方法是:取最后一次洗涤液用pH试纸测量溶液pH,看pH是否约为7 |
| D.若要得到纯度更高的乙酰苯胺,可通过采用重结晶方法提纯,所用试剂为水 |
您最近一年使用:0次
解题方法
10 . X、Y、Z和W是四种短周期主族元素,原子序数依次增大,X、Z同主族,Y的单质与冷水不反应,可以在二氧化碳中燃烧,X、Z、W可以构成一种物质M(如图所示),下列说法正确的是


| A.利用Y在空气中燃烧可以引发甲烷与氯气的取代反应 |
| B.W和第三周期离子半径最小的元素形成共价化合物,属于弱电解质 |
C.海水中提取Y生产流程如下:海水 Y Y |
| D.将M和AlCl3•6H2O混合加热,可得无水氯化铝 |
您最近一年使用:0次



