解题方法
1 . Cl2、SO2、CO、NO等不能直接排放到大气中,需经过处理进行回收利用,从而达到减排的目的。回答下列问题:
(1)已知S(s)和CO(g)的燃烧热分别是296.0 kJ/mol、283.0 kJ/mol,则反应
 的△H=
的△H=___________ 。
(2)一定条件下,Cl2与NO可化合生成重要的化工原料氯化亚硝酰(NOCl),写出该反应的化学方程式:___________ ;已知NOCl中各原子均满足8电子稳定结构,其电子式为___________ 。
(3)向体积为2L的恒容密闭容器中充入一定量的HCl和O2,发生反应: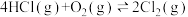
 △H,反应物的转化率与温度(T)的关系如图所示[已知起始时
△H,反应物的转化率与温度(T)的关系如图所示[已知起始时 ,
, 和
和 为平衡转化率]。
为平衡转化率]。

①该反应的△H___________ (填“>”或“<”)0。
②下列关于该反应的说法正确的是___________ (填字母)。
A.曲线a表示HCl的转化率 B.温度越高化学平衡常数越大
C.容器中压强不再改变时,反应达到最大限度 D.该反应只有高温下才能自发进行
③温度低于450℃时,温度升高时HCl和 的转化率增大的原因为
的转化率增大的原因为___________ 。
④若初始时向容器中充入的O2为1 mol,5 min时反应达到平衡,该温度下O2的转化率为20%,则0~5 min内用HCl表示的平均反应速率为___________ ,该反应的平衡常数Kp=___________ [已知:气体分压(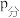 )=气体总压(
)=气体总压(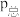 )×体积分数,Kp为以分压表示的平衡常数;平衡时容器内的总压为P0]。
)×体积分数,Kp为以分压表示的平衡常数;平衡时容器内的总压为P0]。
(1)已知S(s)和CO(g)的燃烧热分别是296.0 kJ/mol、283.0 kJ/mol,则反应

 的△H=
的△H=(2)一定条件下,Cl2与NO可化合生成重要的化工原料氯化亚硝酰(NOCl),写出该反应的化学方程式:
(3)向体积为2L的恒容密闭容器中充入一定量的HCl和O2,发生反应:
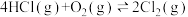
 △H,反应物的转化率与温度(T)的关系如图所示[已知起始时
△H,反应物的转化率与温度(T)的关系如图所示[已知起始时 ,
, 和
和 为平衡转化率]。
为平衡转化率]。
①该反应的△H
②下列关于该反应的说法正确的是
A.曲线a表示HCl的转化率 B.温度越高化学平衡常数越大
C.容器中压强不再改变时,反应达到最大限度 D.该反应只有高温下才能自发进行
③温度低于450℃时,温度升高时HCl和
 的转化率增大的原因为
的转化率增大的原因为④若初始时向容器中充入的O2为1 mol,5 min时反应达到平衡,该温度下O2的转化率为20%,则0~5 min内用HCl表示的平均反应速率为
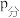 )=气体总压(
)=气体总压(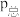 )×体积分数,Kp为以分压表示的平衡常数;平衡时容器内的总压为P0]。
)×体积分数,Kp为以分压表示的平衡常数;平衡时容器内的总压为P0]。
您最近一年使用:0次
2 . 硫代硫酸钠晶体( )不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分
)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分 ,含少量
,含少量 )及纯碱等为原料制备
)及纯碱等为原料制备 的流程如下:
的流程如下:

下列说法正确的是
 )不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分
)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分 ,含少量
,含少量 )及纯碱等为原料制备
)及纯碱等为原料制备 的流程如下:
的流程如下:
下列说法正确的是
A. 作脱氯剂时主要利用其氧化性 作脱氯剂时主要利用其氧化性 |
B.“净化”时加入的试剂X可选用 溶液 溶液 |
| C.“反应”过程中体系pH大小对产品产率无影响 |
D.提纯 时,应先用水洗,再用乙醇洗涤 时,应先用水洗,再用乙醇洗涤 |
您最近一年使用:0次
2021-12-30更新
|
774次组卷
|
5卷引用:辽宁省名校2021-2022学年高三上学期第五次联合考试化学试题
辽宁省名校2021-2022学年高三上学期第五次联合考试化学试题(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题22 新型含硫化合物的制备与性质探究(Na2S2O3 Na2S2O4 Na2S4O6 )-备战2023年高考化学一轮复习考点微专题(已下线)仿真卷05-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
3 . 利用氢氧燃料电池,以镍、铁作电极电解NaOH溶液制备高铁酸钠( ,其在浓碱中稳定存在)的装置如下图所示。已知固体电解质是掺杂了
,其在浓碱中稳定存在)的装置如下图所示。已知固体电解质是掺杂了 的
的 晶体,在高温下能传导
晶体,在高温下能传导 。下列说法正确的是
。下列说法正确的是

 ,其在浓碱中稳定存在)的装置如下图所示。已知固体电解质是掺杂了
,其在浓碱中稳定存在)的装置如下图所示。已知固体电解质是掺杂了 的
的 晶体,在高温下能传导
晶体,在高温下能传导 。下列说法正确的是
。下列说法正确的是
A.电极b反应式为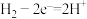 |
B.电极d材料是铁电极,电极反应为 |
C.理论上,固体电解质中每迁移3mol  ,可以制得1mol ,可以制得1mol  |
D.为提高 的产率,应使用阳离子交换膜 的产率,应使用阳离子交换膜 |
您最近一年使用:0次
名校
4 . I.电离平衡常数是衡量弱电解质电离程度的量,已知如表数据(25℃):
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_______ (填序号)
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaClO溶液中通入少量CO2,所发生反应的化学方程式为___________ 。
(3)将相同物质的量浓度的NaClO溶液和Na2CO3溶液等体积混合,各离子浓度关系正确的是___________ (填标号)
a.c(ClO-)>c( )>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]
)>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]
c.c(H+)=2c( )+c(
)+c( )+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c(
)+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c( )
)
II.根据下列化合物:①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl,请回答下列问题:
(4)物质的量浓度相同的①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa五种稀溶液中,水电离的OH-浓度由大到小的顺序为___________ (填序号)。
(5)物质的量浓度相同的⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl六种稀溶液中, 浓度由小到大的顺序为
浓度由小到大的顺序为___________ (填序号)。
(6)已知t℃时,Kw=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___________ 。
III.乙二酸(H2C2O4)俗名草酸,是可溶于水的二元弱酸。
(7)利用滴定原理和装置。可以用0.0500mol·L-1酸性KMnO4溶液滴定某菠菜提取液中草酸的含量。原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
①取待测菠菜提取液2mL于锥形瓶中,并将酸性KMnO4标准溶液装入___________ 中备用。
②滴定终点的判断依据是___________ 。
(8)草酸钙能对血液起抗凝作用。已知正常人体血液中Ca2+含量约为2.5×10-3mol·L-1,则理论上c( )最低为
)最低为___________ 时会生成CaC2O4沉淀。[已知Ksp(CaC2O4)=4.0×10-9]
(9)常温下,用0.200mol/LKOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图所示,
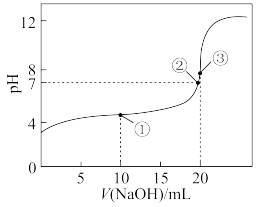
③点所示溶液中:2c( )+2c(
)+2c( )+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为
)+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为___________ 。
| 化学式 | CH3COOH | H2CO3 | HCN | HClO | NH3·H2O |
| 电离常数 | 1.8×10−5 | K1=4.4×10−7 K2=4.7×10−11 | 4.9×10−10 | 3.0×10−8 | 1.8×10−5 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaClO溶液中通入少量CO2,所发生反应的化学方程式为
(3)将相同物质的量浓度的NaClO溶液和Na2CO3溶液等体积混合,各离子浓度关系正确的是
a.c(ClO-)>c(
 )>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]
)>c(H+) b.c(Na+)=3[c(HClO)+c(ClO-)]c.c(H+)=2c(
 )+c(
)+c( )+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c(
)+c(HClO) d.c(HClO)+c(ClO-)=c(H2CO3)+c( )
)II.根据下列化合物:①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl,请回答下列问题:
(4)物质的量浓度相同的①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa五种稀溶液中,水电离的OH-浓度由大到小的顺序为
(5)物质的量浓度相同的⑥(NH4)2SO4⑦CH3COONH4⑧NH4HSO4⑨NH3·H2O⑩NH4Cl六种稀溶液中,
 浓度由小到大的顺序为
浓度由小到大的顺序为(6)已知t℃时,Kw=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=
III.乙二酸(H2C2O4)俗名草酸,是可溶于水的二元弱酸。
(7)利用滴定原理和装置。可以用0.0500mol·L-1酸性KMnO4溶液滴定某菠菜提取液中草酸的含量。原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
①取待测菠菜提取液2mL于锥形瓶中,并将酸性KMnO4标准溶液装入
②滴定终点的判断依据是
(8)草酸钙能对血液起抗凝作用。已知正常人体血液中Ca2+含量约为2.5×10-3mol·L-1,则理论上c(
 )最低为
)最低为(9)常温下,用0.200mol/LKOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图所示,

③点所示溶液中:2c(
 )+2c(
)+2c( )+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为
)+2c(H2C2O4)=c(K+)。点①所示溶液中混合溶液中离子浓度大小关系为
您最近一年使用:0次
名校
解题方法
5 . 按要求完成下列问题。
(1)对于反应2NO(g)+O2(g)⇌2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。
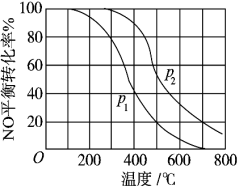
①比较P1、P2的大小关系:P1___________ P2(填“>”、“<”或“=”)。
②该反应的平衡常数K的表达式为___________ ,随温度升高,该反应平衡常数变化的趋势是___________ 。(填“增大”、“减小”或“不变”)。
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g) ΔH>0,已知该反应在2404℃,平衡常数K=6.4×10−3。请回答:
①若该反应是在恒容条件下进行,判断该反应达到平衡的标志为___________ 。
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
②将N2、O2的混合气体充入某密闭容器中,下图变化趋势正确的是___________ 。(填字母)。
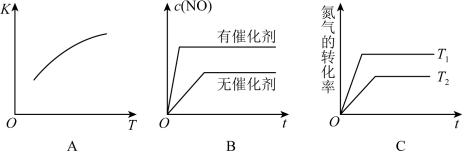
③该温度下,在某时刻测得容器内N2、O2、NO的浓度分别为2.5×10−1mol/L、4.0×10−2mol/L和3.0×10−3mol/L,则此时反应___________ 移动(填“正向”“逆向”或“不”);
(3)已知:N2O4(g)⇌2NO2(g) ∆H=+52.70kJ/mol。
①在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1molN2O4(g),并达新平衡,下列说法正确的___________
a.N2O4(g)的转化率增大 b.新平衡N2O4的百分含量比原平衡大
c.平衡常数K减小 d.新平衡透明容器的气体颜色比原平衡还要深
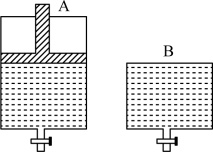
②一定温度下,若将3molN2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入___________ molNO2,达平衡后A、B两容器的NO2百分含量相等。
(1)对于反应2NO(g)+O2(g)⇌2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。

①比较P1、P2的大小关系:P1
②该反应的平衡常数K的表达式为
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g) ΔH>0,已知该反应在2404℃,平衡常数K=6.4×10−3。请回答:
①若该反应是在恒容条件下进行,判断该反应达到平衡的标志为
A.消耗1molN2同时生成1molO2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
②将N2、O2的混合气体充入某密闭容器中,下图变化趋势正确的是

③该温度下,在某时刻测得容器内N2、O2、NO的浓度分别为2.5×10−1mol/L、4.0×10−2mol/L和3.0×10−3mol/L,则此时反应
(3)已知:N2O4(g)⇌2NO2(g) ∆H=+52.70kJ/mol。
①在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1molN2O4(g),并达新平衡,下列说法正确的
a.N2O4(g)的转化率增大 b.新平衡N2O4的百分含量比原平衡大
c.平衡常数K减小 d.新平衡透明容器的气体颜色比原平衡还要深
②一定温度下,若将3molN2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入

您最近一年使用:0次
解题方法
6 . 下列说法正确的是
A.已知 与足量NaOH反应生成 与足量NaOH反应生成 ,则 ,则 为三元酸 为三元酸 |
B.工业上利用反应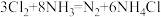 检查氯气管道是否漏气,生成 检查氯气管道是否漏气,生成 有6mol电子转移 有6mol电子转移 |
| C.侯氏制碱法实现了对氨气的循环利用 |
D.向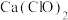 溶液中通入少量 溶液中通入少量 : :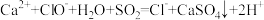 |
您最近一年使用:0次
7 . 中华文化源远流长、博大精深。下列有关蕴含化学知识的说法中,不正确的是
A.“取朴硝(含有 )以温汤溶解,次早结块”,该过程为重结晶 )以温汤溶解,次早结块”,该过程为重结晶 |
| B.《墨子·天志》中记载:“书于竹帛,镂于金石”,其中的“金”指的是金属 |
C.“司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为 |
D.黑火药爆炸过程中发生氧化还原反应,其中氧化剂仅有 |
您最近一年使用:0次
8 . 完成下列问题。
(1)元素a、b、c、d、e的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是

①基态a原子价层轨道表示式:___________ 。
②上述五种元素中电负性最大的是___________ (写元素符号)
③c所在主族元素的氢化物中,其中沸点最高的是(用化学式表示)___________ 。
④向b的最高价氧化物的水溶液中充入过量c的氢化物,写出反应的离子方程式为___________ 。
(2)以NaIO3为原料制备I的方法是:先向NaIO3溶液中加入恰好反应的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为___________ 。
(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)

b)

c)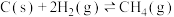

d)

反应a的
___________ (写出一个代数式即可)。
(1)元素a、b、c、d、e的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是

①基态a原子价层轨道表示式:
②上述五种元素中电负性最大的是
③c所在主族元素的氢化物中,其中沸点最高的是(用化学式表示)
④向b的最高价氧化物的水溶液中充入过量c的氢化物,写出反应的离子方程式为
(2)以NaIO3为原料制备I的方法是:先向NaIO3溶液中加入恰好反应的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为
(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)


b)


c)
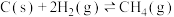

d)


反应a的

您最近一年使用:0次
解题方法
9 . 下列叙述不正确的是
| A.一定条件下BF3可与NH3结合形成NH3·BF3 |
| B.键角:CH4<NH3<H2O |
C. 离子为正四面体结构 离子为正四面体结构 |
D.H3O+、 中均含有配位键 中均含有配位键 |
您最近一年使用:0次
10 . 近年来,我国航空航天事业成果显著,航空航天材料技术快速发展。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。钛在周期表中的位置为___ ,基态钛原子的价层电子排布式为___ 。
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,砷的电负性略___ 镓(填“>”“<”),基态镓原子电子占据最高能级的电子云轮廓图为___ 形。
(3)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的最低能量状态的是___ 。碳在成键时,能将一个2s电子激发进入2p能级而参与成键,写出该激发态原子的核外电子排布式___ 。
A.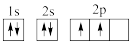 B.
B.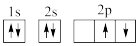
C.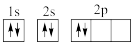 D.
D.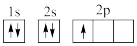
②氧原子的基态原子核外有___ 个未成对电子,有___ 种不同形状的电子云。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。钛在周期表中的位置为
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,砷的电负性略
(3)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的最低能量状态的是
A.
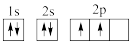 B.
B.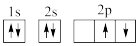
C.
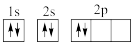 D.
D.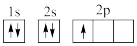
②氧原子的基态原子核外有
您最近一年使用:0次



