名校
解题方法
1 . 化学与人类生产、生活密切相关,下列说法中错误的是
| A.镀锌铁破损后,铁易被腐蚀 |
| B.神舟十一号飞船返回舱表面材料氮化硅属于共价晶体 |
| C.冷敷袋俗称冰袋,成分可以是硝酸铵和水 |
| D.红酒中添加适量SO2可以起到杀菌和抗氧化的作用 |
您最近一年使用:0次
2022-01-13更新
|
617次组卷
|
3卷引用:辽宁省沈阳市2021-2022学年高三上学期教学质量检测(一)化学试卷
辽宁省沈阳市2021-2022学年高三上学期教学质量检测(一)化学试卷(已下线)专项01 化学与STSE-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)广东省信宜市第二中学2021-2022高二下学期开学考试化学试题
名校
2 . 按要求回答下列问题
(1)在无色透明的强酸性溶液中能大量共存的离子组是_______ 。
①.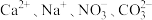
②.
③.
④.
⑤.Fe3+、K+、Cl-、S2-
⑥.Ag+、Na+、 、
、
⑦.Na+、Al3+、 、Cl-
、Cl-
⑧.Ba2+、 、C1-、CH3COO-
、C1-、CH3COO-
(2)①用单线桥表示反应电子转移的方向和数目: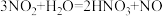 ,被氧化和被还原元素的物质的个数比
,被氧化和被还原元素的物质的个数比_______ 。
②用双线桥表示反应电子转移的方向和数目_______ 。
2Na2O2+2H2O=4NaOH+O2↑
反应每生成1个O2转移的电子数目为_______ 。
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:将这6种物质分别填入下面对应的横线上,组成一个配平 的化学方程式:_______ 。
_______+_______+H2SO4→_______+_______+_______(填化学式)
(1)在无色透明的强酸性溶液中能大量共存的离子组是
①.
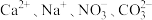
②.

③.

④.

⑤.Fe3+、K+、Cl-、S2-
⑥.Ag+、Na+、
 、
、
⑦.Na+、Al3+、
 、Cl-
、Cl-⑧.Ba2+、
 、C1-、CH3COO-
、C1-、CH3COO-(2)①用单线桥表示反应电子转移的方向和数目:
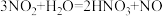 ,被氧化和被还原元素的物质的个数比
,被氧化和被还原元素的物质的个数比②用双线桥表示反应电子转移的方向和数目
2Na2O2+2H2O=4NaOH+O2↑
反应每生成1个O2转移的电子数目为
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:将这6种物质分别填入下面对应的横线上,组成一个
_______+_______+H2SO4→_______+_______+_______(填化学式)
您最近一年使用:0次
名校
解题方法
3 . 诺氟沙星(H)可用于治疗由敏感菌引起的泌尿生殖系统感染、呼吸道感染、胃肠道感染等等。诺氟沙星胶囊不仅治疗效果显著,而且价格实惠,因此受到越来越多的消费者的热捧。一种合成H的路线如图:
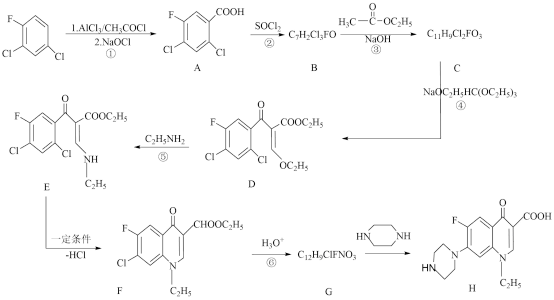
回答下列问题:
(1)反应②的反应类型为______ 。
(2)E中含氧官能团名称为______ 。
(3)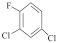 的核磁共振氢谱有
的核磁共振氢谱有______ 组峰;A中最多可以有______ 个原子共平面。
(4)C的结构简式为______ 。
(5)写出反应⑤的化学方程式:______ 。
(6)写出符合下列条件的G的同分异构体的结构简式:______ (任写一种)。
①结构中含有F、Cl原子连接在苯环上;②既有酸性基团又有碱性基团;③能与NaHCO3溶液反应;④能使FeCl3溶液显紫色。
(7)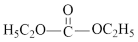 (碳酸二乙酯)俗称DEC,有着广泛用途。已知CCl4+SO3
(碳酸二乙酯)俗称DEC,有着广泛用途。已知CCl4+SO3 COCl2+SO2Cl2,写出以乙烯、四氯化碳等原料合成DEC的路线:
COCl2+SO2Cl2,写出以乙烯、四氯化碳等原料合成DEC的路线:______ (其他无机物任选)。

回答下列问题:
(1)反应②的反应类型为
(2)E中含氧官能团名称为
(3)
 的核磁共振氢谱有
的核磁共振氢谱有(4)C的结构简式为
(5)写出反应⑤的化学方程式:
(6)写出符合下列条件的G的同分异构体的结构简式:
①结构中含有F、Cl原子连接在苯环上;②既有酸性基团又有碱性基团;③能与NaHCO3溶液反应;④能使FeCl3溶液显紫色。
(7)
 (碳酸二乙酯)俗称DEC,有着广泛用途。已知CCl4+SO3
(碳酸二乙酯)俗称DEC,有着广泛用途。已知CCl4+SO3 COCl2+SO2Cl2,写出以乙烯、四氯化碳等原料合成DEC的路线:
COCl2+SO2Cl2,写出以乙烯、四氯化碳等原料合成DEC的路线:
您最近一年使用:0次
名校
4 . 某温度下,向20mL0.15mol•L-1NH4Cl溶液中滴加0.15mol•L-1的AgNO3溶液,该实验使用(NH4)2CrO4作指示剂(已知Ag2CrO4为砖红色沉淀)。滴加过程中,溶液中-lgc(Cl-)与AgNO3溶液体积(V)的关系如图所示。下列说法错误的是


| A.相同温度下,Ksp(Ag2CrO4)一定大于Ksp(AgCl) |
| B.由图可知当恰好达到滴定终点时,Cl-恰好完全沉淀 |
C.已知Ksp(Ag2CrO4)=10-12,a点时,溶液中c(CrO )≥0.01mol•L-1 )≥0.01mol•L-1 |
| D.若用0.075mol•L-1的AgNO3溶液,则a点移至b点;将NH4Cl溶液改为等浓度的NH4Br溶液,则a点移至c点 |
您最近一年使用:0次
2022-01-11更新
|
228次组卷
|
2卷引用:辽宁省凌源市实验中学2021~2022学年高三上学期11月月考化学试题
名校
5 . 血液里的蛋白质构成胶体分散系,但肾功能衰竭等疾病的患者,血液中会有大量的有害小分子或离子,所以要进行血液透析治疗,该方法的原理与下列哪种操作相同
| A.过滤 | B.渗析 | C.分液 | D.蒸馏 |
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)某次滴定前滴定管液面如图所示,读数为___________ mL。

(2)农业常用的三类化肥有①草木灰②Ca(H2PO4)2③NH4NO3,其中能混合施用的是___________ (填序号)。
(3)取等体积物质的量浓度相等的 、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为: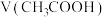
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)常温下,向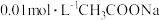 溶液中分别加入
溶液中分别加入 固体、
固体、 固体,则
固体,则 水解平衡移动的情况分别为
水解平衡移动的情况分别为___________ (填“向左移动”“向右移动”或“不移动”,下同)、___________ 。
(5)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是___________(填标号)。
(6)水的电离平衡曲线如下图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,将100℃下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___________ 。

(7)25℃时,将a mol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ (填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(1)某次滴定前滴定管液面如图所示,读数为

(2)农业常用的三类化肥有①草木灰②Ca(H2PO4)2③NH4NO3,其中能混合施用的是
(3)取等体积物质的量浓度相等的
 、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别加入等浓度的NaOH稀溶液至中性,则消耗的NaOH溶液的体积大小关系为: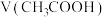
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)常温下,向
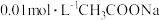 溶液中分别加入
溶液中分别加入 固体、
固体、 固体,则
固体,则 水解平衡移动的情况分别为
水解平衡移动的情况分别为(5)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是___________(填标号)。
| A.c(H+) > c(OH-) | B.c(H+) < c(OH-) |
| C.c(H+)+c(HCN) = c(OH-) | D.c(HCN)+ c(CN-)=0.01mol/L |

(7)25℃时,将a mol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显
您最近一年使用:0次
名校
解题方法
7 . 下列有关实验操作的叙述合理的是
| A.用pH试纸测定溶液的pH时,不需要提前润湿 |
| B.中和反应反应热测定实验中,为防止溅出应将50mL 0.55mol/LNaOH分次缓慢倒入盛有50mL0.50mol/LHCl小烧杯中 |
C.可用如图装置测定过氧化氢分解反应的化学反应速率 |
| D.用pH试纸测定新配制氯水的pH值 |
您最近一年使用:0次
名校
8 . 铁、铝和铜是人类使用最广泛的金属。回答下列问题:
(1)根据电子排布的特点,Al位于元素周期表的__ (填标号,下同),Fe位于元素周期表的__ 。
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为__ ,在元素周期表中位于第__ 周期,基态Cu+的电子排布式为__ 。
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为__ 。
(1)根据电子排布的特点,Al位于元素周期表的
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO
 ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为
您最近一年使用:0次
2022-01-09更新
|
228次组卷
|
2卷引用:辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题
名校
9 . 雾霾已经成为城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.0kJ/mol;C(s)+ O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:
O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:___ 。
(2)一定条件下进行上述反应,测得CO的平衡转化率与温度、起始投料比m[m=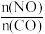 ]的关系如图所示。
]的关系如图所示。
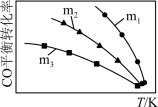
回答下列问题:
①投料比m1、m2、m3中,最大的是___ 。
②随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是___ 。
(3)为研究气缸中NO的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为1mol的氮气和氧气,发生反应N2(g)+O2(g) 2NO(g)。
2NO(g)。
①为减小平衡混合气中NO的体积分数,可采取的措施是___ (填“升高温度”或“降低温度”)。
②对于气缸中NO的生成,化学家提出了如下反应历程:第一步O2 2O慢反应,第二步O+N2
2O慢反应,第二步O+N2 NO+N较快平衡,第三步N+O2
NO+N较快平衡,第三步N+O2 NO+O快速平衡。下列说法正确的是
NO+O快速平衡。下列说法正确的是___ (填序号)。.
A.N、O原子均为该反应的催化剂
B.第一步反应不从N2分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小
D.三步反应的速率都随温度升高而增大
(4)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1,如图是该反应的能量变化图:
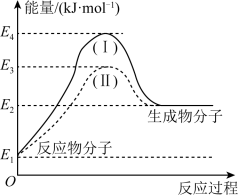
①通过图中信息可判断反应CH3OH(g)+H2O(g)↑=CO2(g)+3H2(g)的ΔH1___ (选填“>”“=”或“<”)0。
②图中途径(II)使用了催化剂。则途径(II)的活化能___ (选填“>”“=”或“<”)途径(I)的活化能。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.0kJ/mol;C(s)+
 O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:
O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:(2)一定条件下进行上述反应,测得CO的平衡转化率与温度、起始投料比m[m=
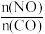 ]的关系如图所示。
]的关系如图所示。
回答下列问题:
①投料比m1、m2、m3中,最大的是
②随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是
(3)为研究气缸中NO的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为1mol的氮气和氧气,发生反应N2(g)+O2(g)
 2NO(g)。
2NO(g)。①为减小平衡混合气中NO的体积分数,可采取的措施是
②对于气缸中NO的生成,化学家提出了如下反应历程:第一步O2
 2O慢反应,第二步O+N2
2O慢反应,第二步O+N2 NO+N较快平衡,第三步N+O2
NO+N较快平衡,第三步N+O2 NO+O快速平衡。下列说法正确的是
NO+O快速平衡。下列说法正确的是A.N、O原子均为该反应的催化剂
B.第一步反应不从N2分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小
D.三步反应的速率都随温度升高而增大
(4)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1,如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)↑=CO2(g)+3H2(g)的ΔH1
②图中途径(II)使用了催化剂。则途径(II)的活化能
您最近一年使用:0次
2022-01-05更新
|
132次组卷
|
3卷引用:辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
10 . 自然界中存在一种天然硅铝酸盐,它们具有筛选分子、吸附、离子交换和催化作用。这种天然物质称为沸石,人工合成的沸石也被称为分子筛。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.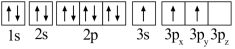 B.
B.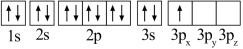
C.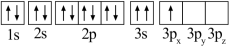 D.
D.
其中能量最低的是_____ (填字母),状态A中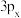 的电子云轮廓图为
的电子云轮廓图为_____ ,状态C电子排布图有错误,主要不符合_____ 。
(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为_____ (填字母),该化合物阴离子的空间构型是___________ 。
A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为___________ ,0.5mol丙烯中含___________ mol 键。
键。
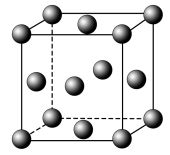
(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为___________ ,铝原子的半径为___________ nm(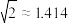 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为___________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
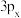 的电子云轮廓图为
的电子云轮廓图为(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在
 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为
 键。
键。(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为
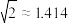 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为 (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
您最近一年使用:0次
2021-12-30更新
|
182次组卷
|
3卷引用:辽宁省名校2021-2022学年高三上学期第五次联合考试化学试题



