1 . 甲烷是目前使用量非常大的一种清洁燃料。
(1)甲烷的电子式为_______ ,空间构型为_____ ,二氯甲烷的结构共有_____ 种。
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:______  填“a”或“b”
填“a”或“b” ,该极的电极反应式是:
,该极的电极反应式是:_______ ,总反应式为_______ 。
(1)甲烷的电子式为
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
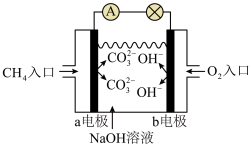
 填“a”或“b”
填“a”或“b” ,该极的电极反应式是:
,该极的电极反应式是:
您最近半年使用:0次
名校
解题方法
2 . 工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为 和
和 ),其反应的化学方程式为
),其反应的化学方程式为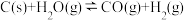 ,请回答下列问题:
,请回答下列问题:
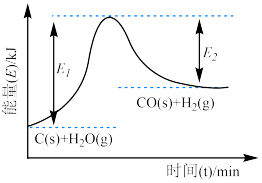
(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是__________。
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是__________。
(3)在体积均为 的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和
的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和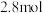 水蒸气,在不同温度下反应的过程如下图所示:
水蒸气,在不同温度下反应的过程如下图所示: 内的平均反应速率
内的平均反应速率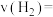
________ 。
②甲容器中,A点正反应速率__________ B点的逆反应速率(填“<”“>”或“=”)。
③反应过程中,两个容器温度:甲__________ 乙(填“<” “>”或“=”)。
④乙容器中C点时, 的物质的量百分数为
的物质的量百分数为__________ 。
(4)在 溶液条件下,以
溶液条件下,以 为原料,可制成一种燃料电池,写出该电池的负极反应式
为原料,可制成一种燃料电池,写出该电池的负极反应式____________________ ,当燃料电池消耗 (标况下)时,正极上有
(标况下)时,正极上有_________ 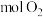 参与反应。
参与反应。
 和
和 ),其反应的化学方程式为
),其反应的化学方程式为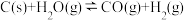 ,请回答下列问题:
,请回答下列问题:(1)上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是__________。
| A.铝粉与氧化铁的反应 | B.氯化铵与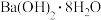 的反应 的反应 |
| C.锌片与稀硫酸的反应 | D.钠与冷水的反应 |
(2)一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是__________。
A.充入 使容器压强增大,提高反应速率 使容器压强增大,提高反应速率 |
B.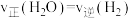 ,说明反应达到平衡状态 ,说明反应达到平衡状态 |
| C.容器中焦炭的质量不再变化,说明反应达到平衡状态 |
D.容器中水蒸气与氢气的体积比为 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
(3)在体积均为
 的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和
的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和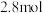 水蒸气,在不同温度下反应的过程如下图所示:
水蒸气,在不同温度下反应的过程如下图所示: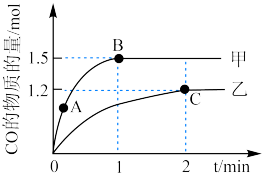
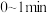 内的平均反应速率
内的平均反应速率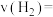
②甲容器中,A点正反应速率
③反应过程中,两个容器温度:甲
④乙容器中C点时,
 的物质的量百分数为
的物质的量百分数为(4)在
 溶液条件下,以
溶液条件下,以 为原料,可制成一种燃料电池,写出该电池的负极反应式
为原料,可制成一种燃料电池,写出该电池的负极反应式 (标况下)时,正极上有
(标况下)时,正极上有 参与反应。
参与反应。
您最近半年使用:0次
2024-04-10更新
|
394次组卷
|
3卷引用:广东省深圳市宝安中学高中部2020-2021学年高一下学期期中考试化学试卷
3 . 按要求填空:

(1)有机物的名称为_______ ,与足量H2反应后所得生成物名称为_______ 。
(2)分子式为C4H8的有机物中,属于烯烃的物质有_______ 种,其中存在顺反异构现象的物质的结构简式为______ 。
(3) 转化为
转化为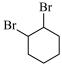 的化学方程式为:
的化学方程式为:______ 。
(4)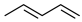 中共面的原子最多有
中共面的原子最多有______ 个,与溴发生加成反应的产物最多有______ 种。

(1)有机物的名称为
(2)分子式为C4H8的有机物中,属于烯烃的物质有
(3)
 转化为
转化为 的化学方程式为:
的化学方程式为:(4)
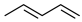 中共面的原子最多有
中共面的原子最多有
您最近半年使用:0次
4 . 研究氮及其化合物的性质具有极为重要的意义。
(1)NOx是汽车尾气中的主要污染物之一、NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_______ ,此反应的氧化产物是_______ ,1molNO2反应转移电子_______ mol。
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,写出实验室用固体加热制取NH3的化学方程式为_______ ,用5.35g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为_______ L。(NH4Cl的摩尔质量为53.5g·mol-1)
(3)实验室可以用铜与稀硝酸制取NO,写出该反应的离子方程式:_______ 。
(4)工业上采用氨氧化法制取硝酸,写出在催化剂作用下氨气与氧气反应的化学方程式:__ 。
(5)工业合成氨原料气氢气通过碳与水蒸气反应制取。已知1mol水蒸气和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ 。写出该反应的热化学方程式______ 。
(1)NOx是汽车尾气中的主要污染物之一、NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,写出实验室用固体加热制取NH3的化学方程式为
(3)实验室可以用铜与稀硝酸制取NO,写出该反应的离子方程式:
(4)工业上采用氨氧化法制取硝酸,写出在催化剂作用下氨气与氧气反应的化学方程式:
(5)工业合成氨原料气氢气通过碳与水蒸气反应制取。已知1mol水蒸气和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ 。写出该反应的热化学方程式
您最近半年使用:0次
名校
5 . 氨能与 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。
(1)基态 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为_______ , 中
中 与
与 间形成的化学键为
间形成的化学键为_______ 。
(2)将 置于
置于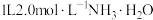 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:
_______ 
_______ 。反应1小时测得溶液中银的总浓度为 ,
, 的溶解速率为
的溶解速率为_______ 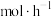 。
。
(3)氨与 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:
(i)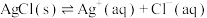
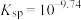
(ii)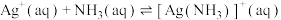
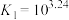
(iii)
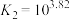
①下列有关说法中,正确的有_______ (填编号)。
A.加少量水稀释,平衡后溶液中 、
、 均减小
均减小
B.随 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大
C.随 增大,
增大, 不变
不变
D.溶液中存在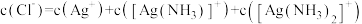
②反应

_______ (用 、
、 、
、 表示)。
表示)。
(4)向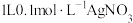 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数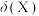 随
随 的变化如图所示。
的变化如图所示。
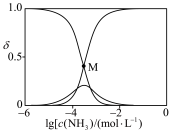
已知溶液中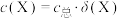 ,
, 。
。
① 点溶液中
点溶液中
_______  。
。
②计算 点溶液中
点溶液中 的转化率
的转化率________ (写出计算过程,已知 )。
)。
 形成配合物
形成配合物 和
和 ,该反应在生产和生活中发挥着重要的作用。
,该反应在生产和生活中发挥着重要的作用。(1)基态
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为 中
中 与
与 间形成的化学键为
间形成的化学键为(2)将
 置于
置于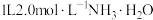 溶液中,通入
溶液中,通入 ,
, 转化为
转化为 的离子方程式为:
的离子方程式为:

 ,
, 的溶解速率为
的溶解速率为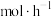 。
。(3)氨与
 形成配合物有助于
形成配合物有助于 溶解。常温下,向
溶解。常温下,向 饱和溶液(含足量
饱和溶液(含足量 固体)中滴加氨水,主要存在以下平衡:
固体)中滴加氨水,主要存在以下平衡:(i)
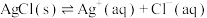
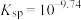
(ii)
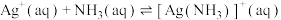
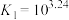
(iii)

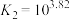
①下列有关说法中,正确的有
A.加少量水稀释,平衡后溶液中
 、
、 均减小
均减小B.随
 增大,反应ⅱ平衡正向移动,
增大,反应ⅱ平衡正向移动, 增大
增大C.随
 增大,
增大, 不变
不变D.溶液中存在
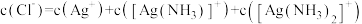
②反应


 、
、 、
、 表示)。
表示)。(4)向
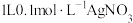 溶液中通入足量
溶液中通入足量 得到澄清溶液(设溶液体积不变),溶液中
得到澄清溶液(设溶液体积不变),溶液中 、
、 、
、 的物质的量分数
的物质的量分数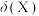 随
随 的变化如图所示。
的变化如图所示。
已知溶液中
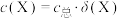 ,
, 。
。①
 点溶液中
点溶液中
 。
。②计算
 点溶液中
点溶液中 的转化率
的转化率 )。
)。
您最近半年使用:0次
2024-04-03更新
|
659次组卷
|
2卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
名校
解题方法
6 . 为研究二氧化硫的性质,某兴趣小组设计如图所示装置进行实验。将少量 溶液缓慢推入
溶液缓慢推入 粉末处,发生反应。下列说法不正确的是
粉末处,发生反应。下列说法不正确的是

 溶液缓慢推入
溶液缓慢推入 粉末处,发生反应。下列说法不正确的是
粉末处,发生反应。下列说法不正确的是
A.气球先变大后变小,体现了 的水溶性 的水溶性 |
B.石蕊试纸变红,说明 溶于水显酸性 溶于水显酸性 |
C.品红溶液褪色,体现了 的还原性 的还原性 |
D.加热褪色后的溶液又变红,说明 与品红生成不稳定的无色物质 与品红生成不稳定的无色物质 |
您最近半年使用:0次
2024-04-03更新
|
413次组卷
|
2卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
解题方法
7 . 下列有关实验操作正确的是
A.在待测液中加入NaOH溶液,加热试管,用玻璃棒粘住湿润的蓝色石蕊试纸放在试管口,试纸变红,说明溶液中含有NH |
| B.稀释浓H2SO4时,应将蒸馏水沿玻璃棒缓慢注入浓H2SO4中 |
C.向溶液中加入盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊,说明溶液中含有CO 或HCO 或HCO |
| D.中和反应反应热的测定主要玻璃仪器有温度计、烧杯、环形玻璃搅拌器,玻璃搅拌器不能用金属制品代替 |
您最近半年使用:0次
8 . 下列叙述不正确的是
| A.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 |
| B.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率 |
| C.化学与人体健康及环境保护息息相关,掩埋废旧电池会造成环境污染,因此要合理处理废旧电池有利于保护环境和资源再利用 |
D.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示),由图可知:雾和霾的分散剂相同,雾霾中含有硝酸铵和硫酸铵, NH3是形成无机颗粒物的催化剂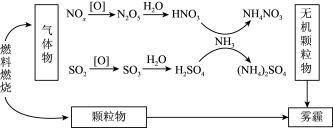 |
您最近半年使用:0次
9 . I.某工业废水中含 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
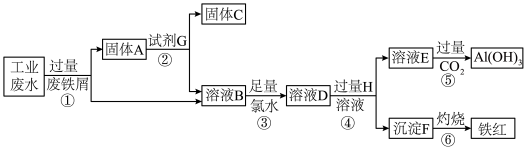
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择_______ (填序号,下同);试剂H是_______ 。
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为_______ ;反应③的离子方程式为_______ 。
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。
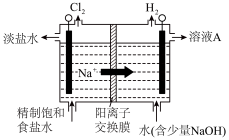
(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应_______ 。
(4)工业常用图装置制备氯气,产生氯气的电极应与电源_______ (选填“正极”或“负极”)相连,发生的电极反应为_______ 。
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应_______ 。
 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。

(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应
(4)工业常用图装置制备氯气,产生氯气的电极应与电源
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应
您最近半年使用:0次
10 . 按要求填空:
(1)将80克NaOH溶解于水中,配成5L溶液,则NaOH的物质的量浓度是
(2)在同温同压下,等质量铝投入足量盐酸和NaOH溶液中,产生气体的体积之比为
(3)某些化学反应可以表示为A+B→C+D+H2O,若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
(4)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为
(5)某+3价阳离子(M3+)含有24个电子,它的质量数为56,该离子核内中子数为
您最近半年使用:0次



