名校
1 . 元素Y最高价氧化物的水化物是强酸,Y的气态氢化物(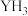 )在水中可形成氢键,其氢键最可能的形式为
)在水中可形成氢键,其氢键最可能的形式为
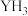 )在水中可形成氢键,其氢键最可能的形式为
)在水中可形成氢键,其氢键最可能的形式为A. | B. |
C.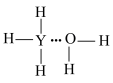 | D.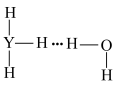 |
您最近一年使用:0次
2024-04-01更新
|
213次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期期末化学试题
名校
2 . 三氯乙酸的结构简式为 ,是有机合成的一种重要中间体。下列有关三氯乙酸的说法正确的是
,是有机合成的一种重要中间体。下列有关三氯乙酸的说法正确的是
 ,是有机合成的一种重要中间体。下列有关三氯乙酸的说法正确的是
,是有机合成的一种重要中间体。下列有关三氯乙酸的说法正确的是| A.难溶于水 | B.所含元素非金属性:Cl>O>C>H |
| C.分子中含有2个π键 | D.分子中碳原子的杂化方式有两种 |
您最近一年使用:0次
名校
3 . 下列有关化学键或微粒间作用力叙述正确的是
| A.共价键均有饱和性和方向性 |
| B.碳碳双键比碳碳单键键能更大,故碳碳双键更稳定 |
| C.离子键的强弱和离子半径及所带电荷有关 |
| D.石英熔化和干冰升华克服的作用力类型相同 |
您最近一年使用:0次
名校
解题方法
4 . 磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)已知 与足量的NaOH溶液反应得到
与足量的NaOH溶液反应得到 ,试推测
,试推测 的结构式为
的结构式为___________ , 和
和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示。这类磷酸根离子的化学式可用通式表示
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示。这类磷酸根离子的化学式可用通式表示___________ (用n代表P原子数)。 中存在
中存在 离子,
离子, 离子的空间结构为
离子的空间结构为___________ ,中心原子的杂化类型为___________ 。
(3)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。该晶体的类型为___________ ,则1号镓原子的坐标为___________ 。晶胞密度为 ,摩尔质量为
,摩尔质量为 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则晶胞中最近的As和Ga原子核间距为
表示,则晶胞中最近的As和Ga原子核间距为___________ nm(列式表示)。
(1)已知
 与足量的NaOH溶液反应得到
与足量的NaOH溶液反应得到 ,试推测
,试推测 的结构式为
的结构式为 和
和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示。这类磷酸根离子的化学式可用通式表示
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示。这类磷酸根离子的化学式可用通式表示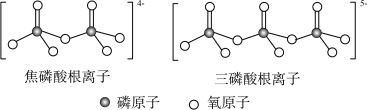
 中存在
中存在 离子,
离子, 离子的空间结构为
离子的空间结构为(3)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。该晶体的类型为
 ,摩尔质量为
,摩尔质量为 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则晶胞中最近的As和Ga原子核间距为
表示,则晶胞中最近的As和Ga原子核间距为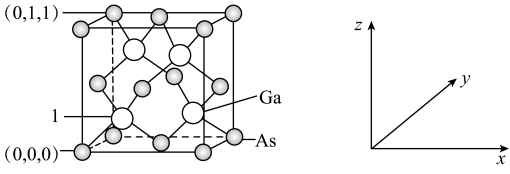
您最近一年使用:0次
2024-03-02更新
|
223次组卷
|
3卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期期末化学试题
5 . W、X、Y、Z、M、Q是原子序数依次递增的前四周期元素,W元素基态原子的三个能级上电子相同,Y元素基态原子核外有8种不同运动状态的电子,Y与Z位于同主族,M是前四周期基态原子核外未成对电子数最多的元素,Q元素位于ds区,常见的化合价有两种。回答下列问题:
(1)X、Z元素符号分别是___________ ,Q元素在周期表的位置是___________ ,M的基态原子的价电子排布式是___________ 。
(2)原子核外电子的运动有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 号表示,称为电子的自旋磁量子数。对于基态的X原子,其价电子自旋磁量子数的代数和为
号表示,称为电子的自旋磁量子数。对于基态的X原子,其价电子自旋磁量子数的代数和为___________ ,基态的X原子最高能级的电子所在原子轨道的轮廓图形为___________ 。
(3)W、X、Y元素第一电离能最大的是___________ (用元素符号表示,下同),电负性最大的是___________ 。
(4)W与Z的化合物共用电子对偏向于Z,举出一个事实,说明Z的非金属性比W强(用化学方程式表示):___________ 。
(5)在较高温度下QY转化成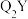 ,从原子结构角度分析
,从原子结构角度分析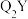 比QY更稳定的原因:
比QY更稳定的原因:___________ 。
(1)X、Z元素符号分别是
(2)原子核外电子的运动有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 号表示,称为电子的自旋磁量子数。对于基态的X原子,其价电子自旋磁量子数的代数和为
号表示,称为电子的自旋磁量子数。对于基态的X原子,其价电子自旋磁量子数的代数和为(3)W、X、Y元素第一电离能最大的是
(4)W与Z的化合物共用电子对偏向于Z,举出一个事实,说明Z的非金属性比W强(用化学方程式表示):
(5)在较高温度下QY转化成
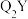 ,从原子结构角度分析
,从原子结构角度分析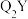 比QY更稳定的原因:
比QY更稳定的原因:
您最近一年使用:0次
名校
解题方法
6 . 一定温度下,在体积为1L的恒容密闭容器中加入1mol CO和1mol NO发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是
N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是

 N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是
N2(g)+2CO2(g),保持温度不变,部分物质的体积分数φ随时间t变化如图所示。下列说法不正确的是
| A.当混合气体的平均摩尔质量不再改变时,该反应达到平衡状态 |
| B.曲线b表示物质的φ-t关系中,正反应速率v(t3)>v(t4) |
| C.曲线b表示的是N2的φ~t关系 |
D.若起始压强为P0,则该反应温度下Kp= (分压=物质的量分数×总压,用含P0的式子表示) (分压=物质的量分数×总压,用含P0的式子表示) |
您最近一年使用:0次
2024-02-27更新
|
304次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 下列说法不正确的是
A.已知KHC2O4溶液中c(HC2O )>c(C2O )>c(C2O )>c(H2C2O4),则c(H+)>c(OH-) )>c(H2C2O4),则c(H+)>c(OH-) |
| B.常温下,体积相等、pH相等的盐酸和氯化铵两溶液,导电能力相同 |
C.向NaHCO3溶液中加入CH3COONa固体,则c(HCO )变大 )变大 |
D.Ca2+、Al3+、S2-、OH-、ClO-、NO 几种离子中,对水的电离平衡无影响的有2种 几种离子中,对水的电离平衡无影响的有2种 |
您最近一年使用:0次
2024-02-27更新
|
288次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高二上学期期末考试化学试题
名校
解题方法
8 . 已知25 ℃时某些酸碱的电离常数见下表,回答下列问题:
(1)25℃将pH=4醋酸和pH=10氨水等体积混合,所得溶液pH___________ 7(填“>”、“<”或“=”);将pH=4醋酸和pH=4氢氟酸混合,则HF的电离程度___________ (填“增大”、“减小”或“不变”)。
(2)将2mol/LCH3COONa溶液与1mol/L盐酸等体积混合,该溶液中各离子浓度由大到小顺序为___________ 。
(3)(NH4)2CO3溶液显___________ 性(填“中”、“酸”或“碱”),写出(NH4)2CO3溶液的质子守恒表达式___________ 。
(4)向TiCl4中加大量水同时加热可制备TiO2·xH2O,写出该反应的化学方程式___________ 。
(5)已知100℃时,0.01 mol/L的NaHSO4溶液中水电离的c(H+)=10-10mol/L,该温度下将pH=5的NaHSO4溶液V1L与pH=8的Ba(OH)2溶液V2L混合,所得溶液pH=7,则V1:V2为___________ (忽略溶液混合时的体积变化)。
| 化学式 | CH3COOH | H2CO3 | HF | NH3·H2O |
| 电离常数 | 1.8×10-5 | Ka1:4.5×10-7、Ka2:4.7×10-11 | 6.3×10-4 | 1.8×10-5 |
(2)将2mol/LCH3COONa溶液与1mol/L盐酸等体积混合,该溶液中各离子浓度由大到小顺序为
(3)(NH4)2CO3溶液显
(4)向TiCl4中加大量水同时加热可制备TiO2·xH2O,写出该反应的化学方程式
(5)已知100℃时,0.01 mol/L的NaHSO4溶液中水电离的c(H+)=10-10mol/L,该温度下将pH=5的NaHSO4溶液V1L与pH=8的Ba(OH)2溶液V2L混合,所得溶液pH=7,则V1:V2为
您最近一年使用:0次
9 . 下列说法正确的是
| A.冰在室温下自动熔化成水,是ΔS<0的过程 |
| B.霓虹灯发光与原子核外电子跃迁有关,属于化学变化 |
| C.任何化学反应的反应热均可以通过实验直接进行测定 |
| D.FeCl3溶液和Fe2(SO4)3溶液分别蒸干,所得固体的成分不同 |
您最近一年使用:0次
解题方法
10 . 五种短周期元素R、W、X、Y、Z原子序数依次增大,请回答下列问题。
(1)Z元素在元素周期表中位置_______ ,R元素简单氢化物的电子式______ 。
(2)R、W、X元素简单离子的半径由大到小的顺序_________ (用离子符号表示)。
(3)下列可作为比较W和X金属性强弱的依据是_______(填序号)。
(4)用一个化学方程式证明Y和Z的非金属性强弱:_______ 。
(5)写出将少量Z单质通入与其紧邻下周期同族元素的无氧酸钾盐溶液中的现象_______ ,该反应离子方程式为_____ 。
| 元素 | R | W | X | Y | Z |
| 描述或性质 | 最高价氧化物对应的水化物与其简单氢化物反应得到离子化合物 | 焰色试验呈黄色 | 最高价氧化物为两性氧化物 | 最高价氧化物对应的水化物是常见的二元强酸 | 最高正价与最低负价之和为+6 |
(1)Z元素在元素周期表中位置
(2)R、W、X元素简单离子的半径由大到小的顺序
(3)下列可作为比较W和X金属性强弱的依据是_______(填序号)。
| A.自然界中的含量 | B.单质与酸反应时失去的电子数 |
| C.单质与水反应置换出氢的难易程度 | D.最高价氧化物对应水化物的碱性强弱 |
(4)用一个化学方程式证明Y和Z的非金属性强弱:
(5)写出将少量Z单质通入与其紧邻下周期同族元素的无氧酸钾盐溶液中的现象
您最近一年使用:0次
2024-02-02更新
|
198次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一上学期期末考试高化学试题



