名校
解题方法
1 . (1)25℃时,将某强酸溶液和某强碱溶液按1∶100的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH之和为___________
(2)常温下,HA的Ka=6.2×10-10,含等物质的量的HA与NaA的混合溶液中,比较c(HA)___________ c(A-)
(3)常温下,某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,需加入___________ ,调节pH=4使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=___________ ,[Fe(OH)3的Ksp=2.6×10-39],过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(4)下表是常温下几种常见弱酸的电离平衡常数:
①若把①CH3COOH、②HClO、③HCO 都看作是酸,则它们的酸性由强到弱的顺序为
都看作是酸,则它们的酸性由强到弱的顺序为_________ (用序号表示)
②常温下,同浓度的①CH3COONa、②NaClO、③NaHCO3溶液,pH由大到小的顺序为_________ (用序号表示)
③向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为___________ 。
(2)常温下,HA的Ka=6.2×10-10,含等物质的量的HA与NaA的混合溶液中,比较c(HA)
(3)常温下,某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,需加入
(4)下表是常温下几种常见弱酸的电离平衡常数:
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH⇌CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO⇌ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3⇌H++  ⇌H++ ⇌H++ | Ka1=4.4×10-7 Ka2=5.61×10-11 |
 都看作是酸,则它们的酸性由强到弱的顺序为
都看作是酸,则它们的酸性由强到弱的顺序为②常温下,同浓度的①CH3COONa、②NaClO、③NaHCO3溶液,pH由大到小的顺序为
③向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为
您最近一年使用:0次
2022-03-19更新
|
134次组卷
|
2卷引用:辽宁省凤城市第一中学2021-2022学年高二上学期12月月考化学试题
名校
解题方法
2 . 请回答下列有关问题。
(1)Fe元素按周期表分区属于___________ 区元素
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是___________ 。
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是___________ 。
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为___________
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ 。
(8)H2O分子的空间构型为___________
(1)Fe元素按周期表分区属于
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是
(3)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(8)H2O分子的空间构型为
您最近一年使用:0次
名校
3 . 下列说法不正确的是
| A.红外光谱图可分析出分子中含有何种化学键或官能团 |
| B.工业上常采用向锅炉中加酸的方法除去硫酸钙水垢 |
| C.工业上,常采用铁触媒催化剂,在400~500℃和10MPa~30MPa的条件下合成氨 |
| D.轮船的船壳吃水线以下常装有一些锌板,这是利用了牺牲阳极法 |
您最近一年使用:0次
2022-03-19更新
|
66次组卷
|
2卷引用:辽宁省凤城市第一中学2021-2022学年高二上学期12月月考化学试题
名校
解题方法
4 . 下列有关金属的性质和钠及其化合物的性质的叙述正确的是
| A.金属都有特殊的金属光泽,具有导电性、导热性和延展性,常温下均为固体 |
| B.碳酸钠俗称小苏打,可与酸反应生成气体,也可用来烘焙糕点 |
| C.过氧化钠中的O呈-1价,在呼吸面具中作供氧剂,与呼出的水蒸气和CO2反应时作氧化剂 |
| D.碳酸钠和碳酸氢钠可相互转化,两者相互转化的反应均为非氧化还原反应 |
您最近一年使用:0次
2022-02-16更新
|
133次组卷
|
2卷引用:辽宁省丹东市凤城市第一中学2021-2022学年高一上学期11月月考化学试题
5 . 完成下列问题。
(1)元素a、b、c、d、e的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是

①基态a原子价层轨道表示式:___________ 。
②上述五种元素中电负性最大的是___________ (写元素符号)
③c所在主族元素的氢化物中,其中沸点最高的是(用化学式表示)___________ 。
④向b的最高价氧化物的水溶液中充入过量c的氢化物,写出反应的离子方程式为___________ 。
(2)以NaIO3为原料制备I的方法是:先向NaIO3溶液中加入恰好反应的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为___________ 。
(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)

b)

c)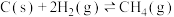

d)

反应a的
___________ (写出一个代数式即可)。
(1)元素a、b、c、d、e的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是

①基态a原子价层轨道表示式:
②上述五种元素中电负性最大的是
③c所在主族元素的氢化物中,其中沸点最高的是(用化学式表示)
④向b的最高价氧化物的水溶液中充入过量c的氢化物,写出反应的离子方程式为
(2)以NaIO3为原料制备I的方法是:先向NaIO3溶液中加入恰好反应的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为
(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)


b)


c)
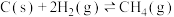

d)


反应a的

您最近一年使用:0次
解题方法
6 . 下列叙述不正确的是
| A.一定条件下BF3可与NH3结合形成NH3·BF3 |
| B.键角:CH4<NH3<H2O |
C. 离子为正四面体结构 离子为正四面体结构 |
D.H3O+、 中均含有配位键 中均含有配位键 |
您最近一年使用:0次
名校
7 . 回答下列问题:
(1)钠及其化合物在生产和生活中有着重要的应用,体现了化学的魅力。按要求写出下列反应的方程式:
①钠与水反应离子方程式:___________ 。
②过氧化钠可用干呼吸面具的供氧剂,其主要反应原理的化学方程式:___________ 。
③氢氧化钠溶液吸收过量的二氧化碳的离子方程式:___________ 。
(2)最初,人们直按用氯水作漂白剂,但因 溶解度不大,而且生成的次氯酸不稳定,难以保存,使用起来不方便。在氯气与水反应原理的基础上,人们将
溶解度不大,而且生成的次氯酸不稳定,难以保存,使用起来不方便。在氯气与水反应原理的基础上,人们将 通入冷的石灰乳中,可以得到一种漂白粉,该反应的化学方程式为
通入冷的石灰乳中,可以得到一种漂白粉,该反应的化学方程式为___________ ,该漂白粉的有效成分是___________ (填名称)。
(3)检验某溶液中含有 的方法是
的方法是___________ ,有关反应的离子方程式___________ 。
(1)钠及其化合物在生产和生活中有着重要的应用,体现了化学的魅力。按要求写出下列反应的方程式:
①钠与水反应离子方程式:
②过氧化钠可用干呼吸面具的供氧剂,其主要反应原理的化学方程式:
③氢氧化钠溶液吸收过量的二氧化碳的离子方程式:
(2)最初,人们直按用氯水作漂白剂,但因
 溶解度不大,而且生成的次氯酸不稳定,难以保存,使用起来不方便。在氯气与水反应原理的基础上,人们将
溶解度不大,而且生成的次氯酸不稳定,难以保存,使用起来不方便。在氯气与水反应原理的基础上,人们将 通入冷的石灰乳中,可以得到一种漂白粉,该反应的化学方程式为
通入冷的石灰乳中,可以得到一种漂白粉,该反应的化学方程式为(3)检验某溶液中含有
 的方法是
的方法是
您最近一年使用:0次
名校
8 . 回答下列问题:
(1)含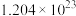 个
个 的
的 溶液中,氯化镁的质量为
溶液中,氯化镁的质量为___________ g。
(2)标准状况下,A气体的密度为1.25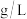 ,B气体相对于氢气的密度为32,11.2LA和B的混合气体质量为17.6g,则A气体的相对分子质量为
,B气体相对于氢气的密度为32,11.2LA和B的混合气体质量为17.6g,则A气体的相对分子质量为___________ ,该混合气体中A和B的体积比为___________ 。
(3)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,该反应可表示为: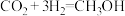
 ,则要减少0.44吨二氧化碳至少需要标准状况下
,则要减少0.44吨二氧化碳至少需要标准状况下 的体积为
的体积为___________  。
。
(4)结晶氯化铝价格便宜应用大,是饮用水、工业用水及游泳池循环水处理的高效廉价絮凝剂。为测定其化学式,现将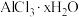 的晶体48.3g溶于水配成250
的晶体48.3g溶于水配成250 溶液,此溶液正好与含0.6
溶液,此溶液正好与含0.6
 的溶液完全作用。由上述数据可知此
的溶液完全作用。由上述数据可知此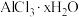 中x的数值是
中x的数值是___________
(5)苏打和小苏打在我们日常生活中用途很广泛。加热13.7g苏打和小苏打的混合物至质量不再变化,剩余固体的质量为10.6g,则此混合物中苏打与小苏打的物质的量之比为___________ 。
(1)含
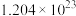 个
个 的
的 溶液中,氯化镁的质量为
溶液中,氯化镁的质量为(2)标准状况下,A气体的密度为1.25
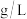 ,B气体相对于氢气的密度为32,11.2LA和B的混合气体质量为17.6g,则A气体的相对分子质量为
,B气体相对于氢气的密度为32,11.2LA和B的混合气体质量为17.6g,则A气体的相对分子质量为(3)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,该反应可表示为:
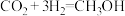
 ,则要减少0.44吨二氧化碳至少需要标准状况下
,则要减少0.44吨二氧化碳至少需要标准状况下 的体积为
的体积为 。
。(4)结晶氯化铝价格便宜应用大,是饮用水、工业用水及游泳池循环水处理的高效廉价絮凝剂。为测定其化学式,现将
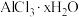 的晶体48.3g溶于水配成250
的晶体48.3g溶于水配成250 溶液,此溶液正好与含0.6
溶液,此溶液正好与含0.6
 的溶液完全作用。由上述数据可知此
的溶液完全作用。由上述数据可知此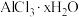 中x的数值是
中x的数值是(5)苏打和小苏打在我们日常生活中用途很广泛。加热13.7g苏打和小苏打的混合物至质量不再变化,剩余固体的质量为10.6g,则此混合物中苏打与小苏打的物质的量之比为
您最近一年使用:0次
9 . 氧化还原反应是化学反应中的三大基本反应之一,自然界中的燃烧反应、呼吸作用、光合作用,生产生活中的化学电池、金属冶炼、火箭发射等等都与氧化还原反应息息相关。研究氧化还原反应,对人类的进步具有极其重要的意义。
(1)用双线桥法表示下列反应电子转移的方向和数目
___________
(2)已知:___________ ___________
___________ ___________
___________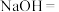 ___________
___________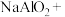 ___________
___________ ___________
___________
①配平方程式___________ 。
②若反应过程中转移5 电子,则生成
电子,则生成 的体积是
的体积是___________ L(标准状况)。
(3) 是一种高效多功能水处理剂,应用前景广阔。一种制备
是一种高效多功能水处理剂,应用前景广阔。一种制备 的方法可用化学方程式表示如下:
的方法可用化学方程式表示如下: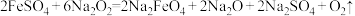 ,该反应中的还原剂是
,该反应中的还原剂是___________ ,还原产物是___________ 。
(4)某容器中发生一个化学反应,反应过程中存在 、
、 、
、 、
、 、
、 、
、 六种物质。在反应过程中测得
六种物质。在反应过程中测得 和
和 的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式
的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式___________ 。

(1)用双线桥法表示下列反应电子转移的方向和数目

(2)已知:___________
 ___________
___________ ___________
___________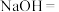 ___________
___________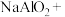 ___________
___________ ___________
___________
①配平方程式
②若反应过程中转移5
 电子,则生成
电子,则生成 的体积是
的体积是(3)
 是一种高效多功能水处理剂,应用前景广阔。一种制备
是一种高效多功能水处理剂,应用前景广阔。一种制备 的方法可用化学方程式表示如下:
的方法可用化学方程式表示如下: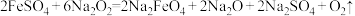 ,该反应中的还原剂是
,该反应中的还原剂是(4)某容器中发生一个化学反应,反应过程中存在
 、
、 、
、 、
、 、
、 、
、 六种物质。在反应过程中测得
六种物质。在反应过程中测得 和
和 的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式
的物质的量随时间变化的曲线如图所示。写出该反应的离子方程式
您最近一年使用:0次
10 . 无水氯化铜通常用作媒染剂、催化剂、杀虫剂等。实验室可用下图装置制取纯净的无水氯化铜。请回答以下问题:
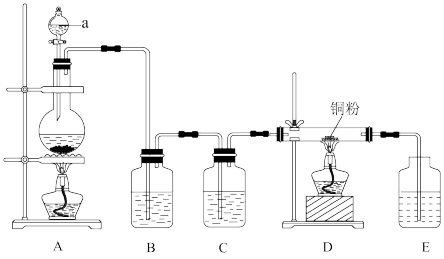
(1)仪器a的名称是___________ ;连接好装置,装药品之前,需要进行的操作是___________ 。
(2)写出圆底烧瓶中发生的化学反应方程式___________ 。
(3)B中盛放的试剂是___________ (填名称),其作用是___________ 。
(4)C装置的作用是___________ 。
(5)E中发生反应的离子方程式是___________ 。

(1)仪器a的名称是
(2)写出圆底烧瓶中发生的化学反应方程式
(3)B中盛放的试剂是
(4)C装置的作用是
(5)E中发生反应的离子方程式是
您最近一年使用:0次
2021-11-21更新
|
167次组卷
|
2卷引用:辽宁省丹东市第二中学沈阳三十一中2021-2022学年高一上学期期中联考化学试题



