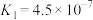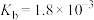(1)25℃时,将某强酸溶液和某强碱溶液按1∶100的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH之和为___________
(2)常温下,HA的Ka=6.2×10-10,含等物质的量的HA与NaA的混合溶液中,比较c(HA)___________ c(A-)
(3)常温下,某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,需加入___________ ,调节pH=4使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=___________ ,[Fe(OH)3的Ksp=2.6×10-39],过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(4)下表是常温下几种常见弱酸的电离平衡常数:
①若把①CH3COOH、②HClO、③HCO 都看作是酸,则它们的酸性由强到弱的顺序为
都看作是酸,则它们的酸性由强到弱的顺序为_________ (用序号表示)
②常温下,同浓度的①CH3COONa、②NaClO、③NaHCO3溶液,pH由大到小的顺序为_________ (用序号表示)
③向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为___________ 。
(2)常温下,HA的Ka=6.2×10-10,含等物质的量的HA与NaA的混合溶液中,比较c(HA)
(3)常温下,某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,需加入
(4)下表是常温下几种常见弱酸的电离平衡常数:
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH⇌CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO⇌ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3⇌H++  ⇌H++ ⇌H++ | Ka1=4.4×10-7 Ka2=5.61×10-11 |
 都看作是酸,则它们的酸性由强到弱的顺序为
都看作是酸,则它们的酸性由强到弱的顺序为②常温下,同浓度的①CH3COONa、②NaClO、③NaHCO3溶液,pH由大到小的顺序为
③向NaClO溶液中通入少量的二氧化碳,发生反应的离子方程式为
更新时间:2022-03-19 17:08:12
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】常温下,有以下四种常见的物质:a. ;b.
;b. ;c.
;c. ;d.
;d. ,已知
,已知
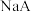 的
的 。回答下列问题:
。回答下列问题:
(1)相同物质的量浓度的a、c、d的溶液的pH由大到的小关系是_______ (用代号表示)。
(2)常温下, 的a溶液与
的a溶液与 的b溶液等体积混合后,溶液中离子浓度由大到小的关系是
的b溶液等体积混合后,溶液中离子浓度由大到小的关系是_______ ,(用离子符号表示)。
(3)常温下,取
 a溶液于锥形瓶中,用
a溶液于锥形瓶中,用 b溶液滴定,滴定过程中,反应体系中HA和
b溶液滴定,滴定过程中,反应体系中HA和 的物质的量分数(
的物质的量分数( )与溶液pH的关系如图所示:
)与溶液pH的关系如图所示:

①向锥形瓶中滴入几滴_______ 作指示剂,判定滴定到终点的依据是_______ ;
②表示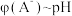 的是曲线
的是曲线_______ (填“I”或“II”):
③M点溶液中:
_______ 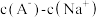 (填“>”“<”或“=”):
(填“>”“<”或“=”):
④根据图中信息,计算该温度下HA的电离常数
_______ (用含a的式子表示)。
 ;b.
;b. ;c.
;c. ;d.
;d. ,已知
,已知
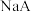 的
的 。回答下列问题:
。回答下列问题:(1)相同物质的量浓度的a、c、d的溶液的pH由大到的小关系是
(2)常温下,
 的a溶液与
的a溶液与 的b溶液等体积混合后,溶液中离子浓度由大到小的关系是
的b溶液等体积混合后,溶液中离子浓度由大到小的关系是(3)常温下,取

 a溶液于锥形瓶中,用
a溶液于锥形瓶中,用 b溶液滴定,滴定过程中,反应体系中HA和
b溶液滴定,滴定过程中,反应体系中HA和 的物质的量分数(
的物质的量分数( )与溶液pH的关系如图所示:
)与溶液pH的关系如图所示:
①向锥形瓶中滴入几滴
②表示
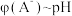 的是曲线
的是曲线③M点溶液中:

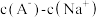 (填“>”“<”或“=”):
(填“>”“<”或“=”):④根据图中信息,计算该温度下HA的电离常数

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知水溶液中 和
和 的关系如图所示:
的关系如图所示:
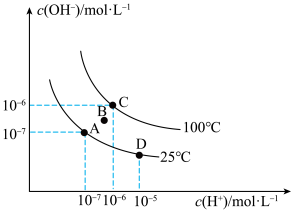
(1)图中B点水的离子积常数___________ 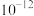 (填>、=或<)。
(填>、=或<)。
(2)从A点到D点,可采取的措施是___________ 。
a.升温b.加入少量盐酸c.降温d.加入少量NaOH
(3)100℃时,pH=2的盐酸中水电离产生的H+浓度为___________  。
。
(4)25℃时,将pH=12的NaOH溶液与pH=3的 溶液混合,若所得混合溶液pH=7,则NaOH溶液与
溶液混合,若所得混合溶液pH=7,则NaOH溶液与 溶液的体积比为
溶液的体积比为___________ 。
 和
和 的关系如图所示:
的关系如图所示:
(1)图中B点水的离子积常数
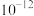 (填>、=或<)。
(填>、=或<)。(2)从A点到D点,可采取的措施是
a.升温b.加入少量盐酸c.降温d.加入少量NaOH
(3)100℃时,pH=2的盐酸中水电离产生的H+浓度为
 。
。(4)25℃时,将pH=12的NaOH溶液与pH=3的
 溶液混合,若所得混合溶液pH=7,则NaOH溶液与
溶液混合,若所得混合溶液pH=7,则NaOH溶液与 溶液的体积比为
溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式___ 。
(2)Na2A的水溶液呈___ 性,原因是(用离子方程式表示):__ 。往Na2A溶液中加入__ 可抑制其水解。
A.NaOH固体 B.氯化铁固体 C.水 D.碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__ mol·L-1。(忽略A2-的水解)
(3)若溶液M由2mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为__ 。
(4)若溶液M由下列三种情况:①0.01mol·L-1的H2A溶液;②0.01mol·L-1的NaHA溶液;③0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为____ ;pH由大到小的顺序为___ 。
(5)若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液 =104,V1与V2的大小关系为:
=104,V1与V2的大小关系为:__ (填“V1>V2”“V1<V2”“V1=V2”或“均有可能”)。
(1)写出酸H2A的电离方程式
(2)Na2A的水溶液呈
A.NaOH固体 B.氯化铁固体 C.水 D.碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为
(3)若溶液M由2mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为
(4)若溶液M由下列三种情况:①0.01mol·L-1的H2A溶液;②0.01mol·L-1的NaHA溶液;③0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为
(5)若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液
 =104,V1与V2的大小关系为:
=104,V1与V2的大小关系为:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】现有下列电解质溶液:① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦ 。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:
。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:
(1) 溶液呈
溶液呈____________ (填“酸性”“碱性”或“中性”),其原因是________________________ 。
(2)上述七种电解质溶液中,既能与盐酸反应又能与烧碱溶液反应的是____________ (填序号)。
(3)常温下,物质的量浓度均为 的④、⑤、⑥、⑦四种溶液,溶液中
的④、⑤、⑥、⑦四种溶液,溶液中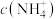 由大到小的顺序为
由大到小的顺序为____________ (填序号)。
(4)向 溶液通入少量的
溶液通入少量的 气体,写出该反应的离子方程式
气体,写出该反应的离子方程式________________________ 。
 ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦ 。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:
。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:化学式 |
|
|
|
|
电离平衡常数 |
|
|
|
|
(1)
 溶液呈
溶液呈(2)上述七种电解质溶液中,既能与盐酸反应又能与烧碱溶液反应的是
(3)常温下,物质的量浓度均为
 的④、⑤、⑥、⑦四种溶液,溶液中
的④、⑤、⑥、⑦四种溶液,溶液中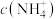 由大到小的顺序为
由大到小的顺序为(4)向
 溶液通入少量的
溶液通入少量的 气体,写出该反应的离子方程式
气体,写出该反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】现有以下浓度均为0.1mol·L-1的溶液:①KNO3溶液②CH3COONa溶液③NH4Cl溶液④NaOH溶液⑤氨水⑥CH3COOH溶液⑦盐酸⑧NaHCO3溶液⑨NaHC2O4溶液;已知常温下相关电离平衡常数如表:
回答下列有关小题:
(1)写出NaHCO3的电离方程式___ ;列出NH 的水解平衡常数表达式Kh(NH
的水解平衡常数表达式Kh(NH )=
)=___ ,计算常温下Kh(NH )=
)=___ 。
(2)②中各离子浓度由大到小的顺序为___ 。
(3)常温下:若将④和⑥混合,并使混合后溶液pH=7,则所需体积V④___ V⑥(填“>”“<”或“=”);若将④和⑦混合,并使混合后溶液pH=12,则V④:V⑦=__ ;将④和⑦等体积混合得w溶液,⑤和⑥等体积混合得Z溶液,混合后溶液pH值W___ Z(填“>”、“<”或“=”,下同);
(4)⑧和⑨混合如果能反应,写出离子反应方程式___ ,如果不能反应,则该小题不填。
| 弱电解质 | CH3COOH | NH3•H2O | H2CO3 | H2C2O4 |
| Ka或Kb | 1.8×10-5 | 1.8×10-5 | Ka1=4.3×10-7 | Ka1=5.6×10-2 Ka2=5.0×10-5 |
(1)写出NaHCO3的电离方程式
 的水解平衡常数表达式Kh(NH
的水解平衡常数表达式Kh(NH )=
)= )=
)=(2)②中各离子浓度由大到小的顺序为
(3)常温下:若将④和⑥混合,并使混合后溶液pH=7,则所需体积V④
(4)⑧和⑨混合如果能反应,写出离子反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】已知:乙二酸(HOOC-COOH,可简写为H2C2O4),俗称草酸,已知:25℃ H2C2O4 K1 = 5.4×10-2,K2 = 5.4×10-5;
(1)已知:25℃ Ka(HF)=3.53×10-4,请写出少量草酸(H2C2O4)与NaF溶液反应的化学方程式:______ 。
(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
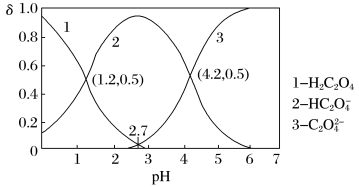
①如果所得溶液溶质为KHC2O4,则该溶液显_______ (填“酸性”、“碱性”或“中性”);
②如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为_______ ;
③当所得溶液pH=2.7时,溶液中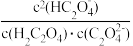 =
=_____________ ;
(3)已知25℃ 草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,通过计算说明能否产生草酸钙沉淀?_______________
(1)已知:25℃ Ka(HF)=3.53×10-4,请写出少量草酸(H2C2O4)与NaF溶液反应的化学方程式:
(2)常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O
 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
①如果所得溶液溶质为KHC2O4,则该溶液显
②如果所得溶液溶质为K2C2O4,则该溶液中各离子浓度由大到小顺序为
③当所得溶液pH=2.7时,溶液中
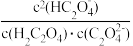 =
=(3)已知25℃ 草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,通过计算说明能否产生草酸钙沉淀?
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)相同温度下等物浓度的下列溶液中,A.NH4C1 B.NH4HCO3C.NH4HSO4D.(NH4)2SO4
① pH值由大到小的顺序是___________________ (用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是___________________ (用对应的字母填写)。
(2)25℃向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。已知该温度下AgCl的Ksp=l.0×l0-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=_____________ 。
②完全沉淀后,溶液的pH=____________ 。
(3)弱酸及其盐在水中存在多种平衡关系。已知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为___________________ 。
②向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =________ 。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1Fe3+和0.26 mol·L-1Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5mol·L-1]而Cu2+不沉淀,则需控制溶液pH的范围为_________ 。[KspCu(OH)2= 2.6×l0-19;KspFe(OH)3= 4×l0-38]
① pH值由大到小的顺序是
② NH4+离子浓度由大到小的顺序是
(2)25℃向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。已知该温度下AgCl的Ksp=l.0×l0-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
(3)弱酸及其盐在水中存在多种平衡关系。已知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为
②向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1Fe3+和0.26 mol·L-1Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5mol·L-1]而Cu2+不沉淀,则需控制溶液pH的范围为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】工业上制备BaCl2的工艺流程图如图:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C (s) 4CO(g) +BaS(s) △H1=+571kJ·mol-1①
4CO(g) +BaS(s) △H1=+571kJ·mol-1①
BaSO4 (s) +2C (s) 2CO2 (g) +BaS(s) △H=+226kJ·mol-1②
2CO2 (g) +BaS(s) △H=+226kJ·mol-1②
(1)反应C(s) +CO2 (g) 2CO (g)的△H=
2CO (g)的△H=_______ kJ·mol-1。
(2)气体用过量NaOH溶液吸收,得到Na2S,在Na2S水溶液中c(Na+)与c (S-2)的关系是_______ 。(填字母)
A.c(Na+ ) =2c(S2-) B.c(Na+) <2c(S2-)
C.c(Na+) >2c(S2-) D.2c(Na+) >c(S2-)
(3)向AgNO3溶液中加入BaCl2和KBr,当两种沉淀共存时,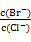 =
=___________ 。
[KSP (AgBr) =5.4×l0-13, Ksp (AgCl) =2.0×10-10]
(4)常温常压下,空气中的CO2溶于水达到平衡时,溶液的pH=5.6,溶液c(H2CO3) =1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3H2CO3-+H+的平衡常数K1=_______ 。(保留两位有效数字)(已知:10-5.60=2.5× 10-6)

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C (s)
 4CO(g) +BaS(s) △H1=+571kJ·mol-1①
4CO(g) +BaS(s) △H1=+571kJ·mol-1①BaSO4 (s) +2C (s)
 2CO2 (g) +BaS(s) △H=+226kJ·mol-1②
2CO2 (g) +BaS(s) △H=+226kJ·mol-1②(1)反应C(s) +CO2 (g)
 2CO (g)的△H=
2CO (g)的△H=(2)气体用过量NaOH溶液吸收,得到Na2S,在Na2S水溶液中c(Na+)与c (S-2)的关系是
A.c(Na+ ) =2c(S2-) B.c(Na+) <2c(S2-)
C.c(Na+) >2c(S2-) D.2c(Na+) >c(S2-)
(3)向AgNO3溶液中加入BaCl2和KBr,当两种沉淀共存时,
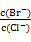 =
=[KSP (AgBr) =5.4×l0-13, Ksp (AgCl) =2.0×10-10]
(4)常温常压下,空气中的CO2溶于水达到平衡时,溶液的pH=5.6,溶液c(H2CO3) =1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3H2CO3-+H+的平衡常数K1=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
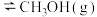
(1)下表所列数据是该反应在不同温度下的化学平衡常数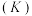
①该反应的平衡常数表达式
______________ ,
__________  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。
②某温度下,将 和
和 充入2L的密闭容器中,充分反应10min后,达到平衡时测得
充入2L的密闭容器中,充分反应10min后,达到平衡时测得 ,则CO的转化率为
,则CO的转化率为____________ ,此时的温度为_________ 。
(2)向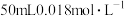 的
的 溶液中加入
溶液中加入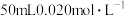 的盐酸,生成沉淀。已知该温度下AgCl的
的盐酸,生成沉淀。已知该温度下AgCl的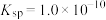 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中
________ 。
②完全沉淀后,溶液的
________ 。

(1)下表所列数据是该反应在不同温度下的化学平衡常数
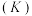
| 温度 | 250℃ | 300℃ | 350℃ |
| K |  |  |  |
①该反应的平衡常数表达式


 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。 ②某温度下,将
 和
和 充入2L的密闭容器中,充分反应10min后,达到平衡时测得
充入2L的密闭容器中,充分反应10min后,达到平衡时测得 ,则CO的转化率为
,则CO的转化率为(2)向
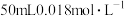 的
的 溶液中加入
溶液中加入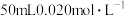 的盐酸,生成沉淀。已知该温度下AgCl的
的盐酸,生成沉淀。已知该温度下AgCl的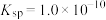 ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:①完全沉淀后,溶液中

②完全沉淀后,溶液的

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Ⅰ.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO

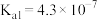
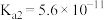

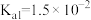
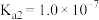
(1)相同浓度的 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ 。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)室温下, 通入NaOH溶液中,在所得溶液中,
通入NaOH溶液中,在所得溶液中,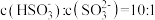 ,则溶液的pH=
,则溶液的pH=_______ 。
II.水在25℃和95℃时电离平衡曲线如图。
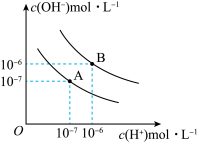
(4)在曲线A所对应的温度下,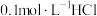 溶液由水电离出来的
溶液由水电离出来的
_______  。
。
(5)在曲线A所对应的温度下, 的下列溶液:①HCl②
的下列溶液:①HCl② ③
③ ④NaOH ⑤
④NaOH ⑤ ,pH由大到小的顺序是
,pH由大到小的顺序是_______ (填序号顺序)。
(6)在曲线A所对应的温度下, 的醋酸与
的醋酸与 的NaOH等体积混合,所得溶液的pH
的NaOH等体积混合,所得溶液的pH_______ 7(填“>”“<”或“=”)。
(7)在曲线B所对应的温度下,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的6,则NaOH溶液与
溶液混合,若所得混合溶液的6,则NaOH溶液与 溶液的体积比为
溶液的体积比为_______ 。
HClO


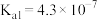
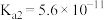

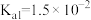
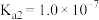
(1)相同浓度的
 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为(2)写出
 的电离方程式
的电离方程式(3)室温下,
 通入NaOH溶液中,在所得溶液中,
通入NaOH溶液中,在所得溶液中,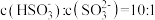 ,则溶液的pH=
,则溶液的pH=II.水在25℃和95℃时电离平衡曲线如图。

(4)在曲线A所对应的温度下,
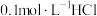 溶液由水电离出来的
溶液由水电离出来的
 。
。(5)在曲线A所对应的温度下,
 的下列溶液:①HCl②
的下列溶液:①HCl② ③
③ ④NaOH ⑤
④NaOH ⑤ ,pH由大到小的顺序是
,pH由大到小的顺序是(6)在曲线A所对应的温度下,
 的醋酸与
的醋酸与 的NaOH等体积混合,所得溶液的pH
的NaOH等体积混合,所得溶液的pH(7)在曲线B所对应的温度下,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的6,则NaOH溶液与
溶液混合,若所得混合溶液的6,则NaOH溶液与 溶液的体积比为
溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】完成下列问题。
(1)化学中,酸的电离平衡常数(Ka)是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
①写出HF的电离方程式:_______ 。
②常温下,浓度相同的三种溶液①NaF、②Na2CO3、③CH3COONa,pH由大到小的顺序是_____ 。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是___________ 。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.100 mol/L的氨水溶液,滴定曲线如图所示(忽略溶液体积的变化,①②填“>”、“<”或“=”)。
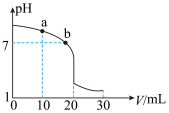
①a点所示的溶液中c(NH3·H2O)_____ c(C1-)。
②b点所示的溶液中c(C1-)_____ c( )。
)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为_____ 。
(1)化学中,酸的电离平衡常数(Ka)是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
| 弱酸 | HF | CH3COOH | H2CO3 | H2S |
| 电离平衡常数 | Ka=7.2×10-4 | Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=9.1×10-8 Ka2=1.1×10-12 |
②常温下,浓度相同的三种溶液①NaF、②Na2CO3、③CH3COONa,pH由大到小的顺序是
③将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.100 mol/L的氨水溶液,滴定曲线如图所示(忽略溶液体积的变化,①②填“>”、“<”或“=”)。

①a点所示的溶液中c(NH3·H2O)
②b点所示的溶液中c(C1-)
 )。
)。③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】碳族元素的物质是化学世界中最庞大的家族,“天问一号”轨道飞行器近距离拍摄了火星北极,看到大量白色冰冻区域, 主要是二氧化碳低温凝结形成的干冰,虽然看起来和地球两极很像,但实际温度却比地球两极冷多了!
(1)已知 25℃时,H2CO3的Ka1=4.2×10-7、Ka2=4.8×10- 11,HCN的Ka=4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为___________ 。
(2)下列关于二氧化碳的说法正确的是___________。
(3)干冰和冰的晶体模型如下图存在差别的本质原因___________ 。___________ 。
(5)金刚石晶体中,每个C被___________ 个六元环共用。
(6)晶体硅和碳化硅熔点较高的是___________ (填化学式)。
(7)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________ 。
(1)已知 25℃时,H2CO3的Ka1=4.2×10-7、Ka2=4.8×10- 11,HCN的Ka=4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为
(2)下列关于二氧化碳的说法正确的是___________。
A.电子式为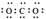 | B.空间填充模型为  |
| C.CO2 是极性分子, 能溶于水 | D.CO2 的水溶液能够导电,但 CO2是非电解质 |
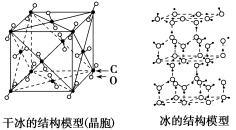
(5)金刚石晶体中,每个C被
(6)晶体硅和碳化硅熔点较高的是
(7)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
您最近一年使用:0次