1 . 下列选项中所描述的关系中物质的量比为2:1的是
| A.NO2与水反应中的氧化剂与还原剂之比 |
| B.H2S与SO2反应中氧化产物与还原产物之比 |
C.CH4(g)+CO2(g) 2CO(g)+2H2(g)平衡时速率υ(正、CH4),υ(逆、CO)之比 2CO(g)+2H2(g)平衡时速率υ(正、CH4),υ(逆、CO)之比 |
| D.氢氧燃料电池工作时,同一时间内正负极消耗的两种气体(同温同压条件下) |
您最近一年使用:0次
2022-09-26更新
|
76次组卷
|
2卷引用:辽宁省沈阳市新民市第一高级中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
2 . 下列有关说法中,正确的组合是
①光导纤维可以将光能转化为电能,是制造光电池的最佳材料
②陶瓷、水泥、金刚砂及所有的玻璃都是硅酸盐产品
③木材、织物浸过水玻璃后具有防腐性能且不易燃烧
④我们把pH<7的雨水称为酸雨
⑤某些氮的氧化物可以造成光化学烟雾
⑥SO2与Cl2通入品红溶液中,品红溶液均褪色但原理不同
⑦加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解,说明溶液中一定有SO
⑧氮的固定指的是将游离态的氮转化为化合态的氮
①光导纤维可以将光能转化为电能,是制造光电池的最佳材料
②陶瓷、水泥、金刚砂及所有的玻璃都是硅酸盐产品
③木材、织物浸过水玻璃后具有防腐性能且不易燃烧
④我们把pH<7的雨水称为酸雨
⑤某些氮的氧化物可以造成光化学烟雾
⑥SO2与Cl2通入品红溶液中,品红溶液均褪色但原理不同
⑦加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解,说明溶液中一定有SO

⑧氮的固定指的是将游离态的氮转化为化合态的氮
| A.①③⑤⑧ | B.②④⑥⑦ | C.③⑤⑥⑧ | D.②④⑤⑦ |
您最近一年使用:0次
名校
3 . 由金、氯、铯三种元素组成的晶体M的晶胞结构如图所示( 为铯,
为铯, 为氯,
为氯, 为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是
为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是

 为铯,
为铯, 为氯,
为氯, 为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是
为金),其中金原子有两种不同的化学环境,形成2种−1价的配离子。设阿伏加德罗常数的值为NA,下列说法错误的是
| A.M的化学式为CsAuCl |
B.金原子形成的两种配离子分别为AuCl 、AuCl 、AuCl |
| C.位于体心的Au处于由Au构成的八面体空隙中 |
D.金晶体(Au)是面心立方堆积,其晶胞参数为408pm,金晶体密度为 g∙cm−3 g∙cm−3 |
您最近一年使用:0次
2022-09-11更新
|
343次组卷
|
2卷引用:辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题
解题方法
4 . 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。回答下列问题:
(1)某模拟“人工树叶”的电化学实验装置如图1所示,该装置能将H2O和CO2转化为O2和丙醇(C3H8O)燃料,所有气体均换算成标准状况下。
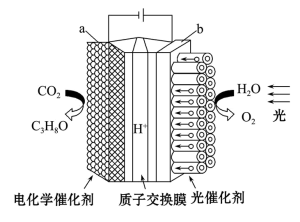
图1
①a电极为电解池的____ (填“阴极”或“阳极”),发生____ (填“氧化”或“还原”)反应。
②b电极上的电极反应式为____ ,每消耗5.6LCO2,同时生成O2的质量为____ g。
(2)利用如图2所示装置从海水中提取CO2,有利于减少温室气体的含量。
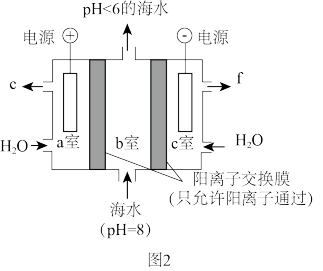
①气体e为____ (填化学式)。
②电解过程中产生的H+通过阳离子交换膜由____ (填“a室→b室”或“b室→a室”);海水中因含有HCO ,使得海水显碱性,写出提取CO2的离子方程式:
,使得海水显碱性,写出提取CO2的离子方程式:____ 。
(3)科学家利用电化学装置可实现CH4和CO2两种分子的耦合转化,其原理如图3所示。若生成的乙烯和乙烷的体积之比为3:4,则消耗CH4和CO2的体积之比为____ 。
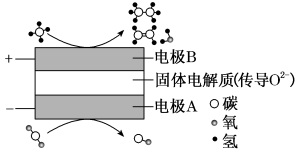
图3
(1)某模拟“人工树叶”的电化学实验装置如图1所示,该装置能将H2O和CO2转化为O2和丙醇(C3H8O)燃料,所有气体均换算成标准状况下。

图1
①a电极为电解池的
②b电极上的电极反应式为
(2)利用如图2所示装置从海水中提取CO2,有利于减少温室气体的含量。

①气体e为
②电解过程中产生的H+通过阳离子交换膜由
 ,使得海水显碱性,写出提取CO2的离子方程式:
,使得海水显碱性,写出提取CO2的离子方程式:(3)科学家利用电化学装置可实现CH4和CO2两种分子的耦合转化,其原理如图3所示。若生成的乙烯和乙烷的体积之比为3:4,则消耗CH4和CO2的体积之比为

图3
您最近一年使用:0次
5 . 室温下,向0.01mol·L-1的CH3COOH溶液中不断加水稀释,其溶液的pH变化如图所示[已知:Ka(CH3COOH)=1.6×10-5,lg2=0.3,电离度= ×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是
×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是

 ×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是
×100%,pH=-lgc(H+),忽略溶液体积和温度的变化],下列说法正确的是
| A.x点的pH为3.2 |
| B.x点与y点CH3COOH的电离平衡常数:Kx>Ky |
| C.室温下,0.01mol·L-1的CH3COOH溶液中,CH3COOH的电离度约为4% |
| D.升高温度,c(H+)增大,Ka的大小保持不变 |
您最近一年使用:0次
2022-09-02更新
|
493次组卷
|
3卷引用:辽宁省葫芦岛市协作校2021-2022学年高二上学期第二次考试化学试题
解题方法
6 . 在装有氯化铜溶液的U形管中,插入两根完全相同的石墨棒(P、R)作为电极,接通直流电源,实验装置如图所示。下列有关说法正确的是


| A.电池工作时,溶液中的Cu2+移向电极R |
| B.当两电极上的质量相差3.2g时,外电路中转移的电子为0.1mol |
| C.电池工作时,外电路中电子的流动方向为a→电极P→氯化铜溶液→电极R→b |
| D.若将湿润的淀粉碘化钾试纸放在电极P处,淀粉碘化钾试纸将变蓝 |
您最近一年使用:0次
7 . 在1L的密闭容器中,加入0.5molCaCO3,发生反应:CaCO3(s)⇌CaO(s)+CO2(g),图中A表示CO2的平衡浓度与温度的关系曲线。

(1)该反应正反应方向为_______ 热反应(填“吸”或“放”),温度为T5℃时,该反应的平衡常数 _______ 。
(2)达到平衡后,保持温度不变,再次通入1molCO2,平衡移动的方向_______ (填“正方向”、“逆方向”或“不”),再次平衡后容器内的压强 _______ (填“增大”、“减小”或“不变”)。
(3)加快该化学反应速率并能增加该反应进行程度的措施:_______ 。(写一种即可)

(1)该反应正反应方向为
(2)达到平衡后,保持温度不变,再次通入1molCO2,平衡移动的方向
(3)加快该化学反应速率并能增加该反应进行程度的措施:
您最近一年使用:0次
8 . 由于化石燃料的大量使用,产生CO2等温室气体随意排放造成的全球变暖,严重地影响到了地球的生态环境和全球气候。因此,研究CO2减排在全球各国具有紧迫而重要的意义。
CaO在自然界存在广泛,作为CO2的吸附剂具有极大的经济优势。
(1)273K时,CaO(s)+CO2(g)=CaCO3(g) △H=﹣178.3kJ·mol﹣1,已知△S=﹣160.45Jmol﹣1·K﹣1,该温度下反应是否能够自发进行?_______ (填“是”或“否”)
(2)实验发现,干燥的二氧化碳和氧化钙几乎不反应,水可以作为该反应的催化剂,利用化学反应方程式解释水的催化机理:_______ 。
CaO在自然界存在广泛,作为CO2的吸附剂具有极大的经济优势。
(1)273K时,CaO(s)+CO2(g)=CaCO3(g) △H=﹣178.3kJ·mol﹣1,已知△S=﹣160.45Jmol﹣1·K﹣1,该温度下反应是否能够自发进行?
(2)实验发现,干燥的二氧化碳和氧化钙几乎不反应,水可以作为该反应的催化剂,利用化学反应方程式解释水的催化机理:
您最近一年使用:0次
名校
9 . 化学与生活息息相关,下 列说法错误的是
| A.碳酸钠可用于去除餐具的油污是利用了盐类水解的原理 |
| B.草木灰和氯化铵不能混合使用是因为二者发生双水解反应 |
| C.冰箱能够保存食物的最主要原因是冰箱可以杀灭细菌 |
| D.打开剧烈摇动后的碳酸饮料产生大量气泡的原因是压强对化学平衡的影响 |
您最近一年使用:0次
2022-09-01更新
|
210次组卷
|
2卷引用:辽宁省沈阳市铁西区重点协作校2021-2022学年高二上学期期中考试化学试题
10 . 钢筋混凝土是一种常见的建筑材料。通常情况下混凝土呈较高碱性环境(pH可大于12),在这种环境下,钢筋表面迅速形成一层氧化铁(γ—Fe2O3)钝化膜,该膜为一种致密、稳定的结构可保护钢筋不被腐蚀。在多种因素作用下,钢筋的钝化膜被破坏而渐渐失去保护作用,导致钢筋锈蚀,危及建筑物结构的安全。已知氯离子的侵蚀作用是钢筋锈蚀的主要原因之一、实验室采用传统Mohr法模拟测定某混凝土中氯离子含量,实验原理:
Ag++Cl—=AgCl↓(白色)Ksp(AgCl)=1.8×10-10
2Ag++CrO =Ag2CrO4(砖红色)Ksp(Ag2CrO4)=1.2×10-12
=Ag2CrO4(砖红色)Ksp(Ag2CrO4)=1.2×10-12
实验过程如下:
①取混凝土约30g,研磨后置于烘箱中加热2小时,取出后放入干燥器冷却至室温。准确称取20.00g,置于锥形瓶中,并准确加入200.0mL蒸馏水,塞紧瓶塞,充分振荡1至2分钟,浸泡24小时。
②将上述试样过滤,准确移取滤液20.00mL置于小锥形瓶中,加2滴酚酞,溶液呈微红色,再用稀硫酸中和至无色后,加铬酸钾指示剂10滴,用cmol/L的标准AgNO3溶液滴至砖红色,记录所消耗的AgNO3体积VmL。
(1)Cl—破坏氧化膜后钢筋腐蚀的负极电极反应式:___________ 。
(2)样品置于干燥器中冷却的原因是___________ 。
(3)准确称取一定质量的样品使用的仪器名称为___________ 。
(4)Mohr法须在中性或弱碱性条件下进行,碱性过强则因___________ 而使测定的Cl—含量结果偏___________ (填“高”或“低”)。当锥形瓶内Cl—恰好沉淀完全时,溶液中CrO 浓度为
浓度为___________ mol/L。
(5)该混凝土样品中氯离子的质量分数为___________ (列出表达式即可)。
Ag++Cl—=AgCl↓(白色)Ksp(AgCl)=1.8×10-10
2Ag++CrO
 =Ag2CrO4(砖红色)Ksp(Ag2CrO4)=1.2×10-12
=Ag2CrO4(砖红色)Ksp(Ag2CrO4)=1.2×10-12实验过程如下:
①取混凝土约30g,研磨后置于烘箱中加热2小时,取出后放入干燥器冷却至室温。准确称取20.00g,置于锥形瓶中,并准确加入200.0mL蒸馏水,塞紧瓶塞,充分振荡1至2分钟,浸泡24小时。
②将上述试样过滤,准确移取滤液20.00mL置于小锥形瓶中,加2滴酚酞,溶液呈微红色,再用稀硫酸中和至无色后,加铬酸钾指示剂10滴,用cmol/L的标准AgNO3溶液滴至砖红色,记录所消耗的AgNO3体积VmL。
(1)Cl—破坏氧化膜后钢筋腐蚀的负极电极反应式:
(2)样品置于干燥器中冷却的原因是
(3)准确称取一定质量的样品使用的仪器名称为
(4)Mohr法须在中性或弱碱性条件下进行,碱性过强则因
 浓度为
浓度为(5)该混凝土样品中氯离子的质量分数为
您最近一年使用:0次



