1 . 苯是一种重要的化工原料,用苯合成药物中间体高分子化合物H的路线如下:
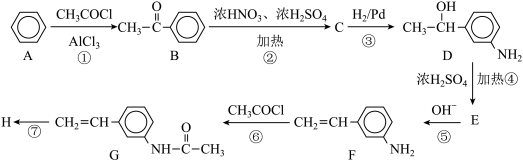
(1)C的结构简式为_________ ,D的分子式为_________ 。
(2)⑥的反应类型为_________ 。
(3)F中含有官能团的名称为_________ 。
(4)下列关于物质D的说法不正确的是_________。
(5)在催化剂、加热、加压条件下⑦的化学方程式_________ 。
(6)C有多种同分异构体,满足下列条件的有_________ 种。写出核磁共振氢谱有4组峰,面积比为1:2:2:2的同分异构体的结构简式_________ 。
①硝基与苯环直接相连
②能发生银镜反应

(1)C的结构简式为
(2)⑥的反应类型为
(3)F中含有官能团的名称为
(4)下列关于物质D的说法不正确的是_________。
| A.与金属Na反应 | B.能使酸性高锰酸钾溶液褪色 |
| C.与FeCl3溶液显紫色 | D.该物质具有两性 |
(6)C有多种同分异构体,满足下列条件的有
①硝基与苯环直接相连
②能发生银镜反应
您最近一年使用:0次
解题方法
2 . 高锰酸钾(KMnO4)被广泛用作氧化剂、消毒剂、水处理剂等。回答下列问题:
(1)基态锰原子的价电子排布式是_________ ,含有_________ 个未成对电子。
(2)高锰酸钾中各元素电负性的大小顺序为_________ 。
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是_________ 。
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是_________ ,其原因是_________ 。过氧化氢中氧原子的杂化方式为_________ 。
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有_________ 个;
②与I距离最近的O形成的空间构型为_________ 。
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为_________ ;
④与I距离最近的钾为_________ nm(已知 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
(1)基态锰原子的价电子排布式是
(2)高锰酸钾中各元素电负性的大小顺序为
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有
②与I距离最近的O形成的空间构型为
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为
④与I距离最近的钾为
 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
您最近一年使用:0次
解题方法
3 . 钛是一种性能非常优越的金属,有着广泛的应用,有人说“21世纪将是钛的世纪”。以金红石矿(主要成分为TiO2,含有少量Al2O3、SiO2、FeO、Fe2O3等杂质)为主要原料,首先反应生成TiCl4,然后再用镁还原得到金属钛,其工艺流程如下:

已知:常温下Fe(OH)3和Fe(OH)2溶度积(Ksp)分别为4.0×10-38和8.0×10-16
请回答下列问题:
(1)加入浓NaOH溶液的目的是_________ 。
(2)镁和氯气主要来源于流程中的某种物质通过电解方法获得,该物质是_________ 。工业生产中需要适当补充该物质,该物质可来源于海水,制备过程如下:向海水中加入石灰乳后,向分离得到的固体中加入过量的盐酸,目的是_________ ,将得到的溶液通过_________ 、冷却结晶操作后得到晶体,在HCl气流中加热晶体即可得到该物质。
(3)高温下,滤渣Y、焦炭和氯气发生反应生成可燃性气体的化学方程式为:_________ 。
(4)工艺流程中稀有气体Ar的作用是_________ 。
(5)为提高原料的利用率,常温下某研究小组向⑤过滤后的滤液中,先加适量的H2O2,再加适量的碱调节溶液的pH至4,过滤后将滤渣加热灼烧,得到了常用的涂料。调节溶液的pH至4时,溶液中金属离子的浓度为_________ mol/L。
(6)TiN具有重要的用途,可在高温下由TiO2与NH3反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体。该反应的化学方程式为_________ 。

已知:常温下Fe(OH)3和Fe(OH)2溶度积(Ksp)分别为4.0×10-38和8.0×10-16
请回答下列问题:
(1)加入浓NaOH溶液的目的是
(2)镁和氯气主要来源于流程中的某种物质通过电解方法获得,该物质是
(3)高温下,滤渣Y、焦炭和氯气发生反应生成可燃性气体的化学方程式为:
(4)工艺流程中稀有气体Ar的作用是
(5)为提高原料的利用率,常温下某研究小组向⑤过滤后的滤液中,先加适量的H2O2,再加适量的碱调节溶液的pH至4,过滤后将滤渣加热灼烧,得到了常用的涂料。调节溶液的pH至4时,溶液中金属离子的浓度为
(6)TiN具有重要的用途,可在高温下由TiO2与NH3反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体。该反应的化学方程式为
您最近一年使用:0次
4 . 2021年4月21日,国家航天局揭晓我国首辆火星车名称——“祝融号”,同时多项拥有自主知识产权的黑科技悉数亮相,以下说法不正确的是
| A.抵抗极热极寒材料——气溶胶:固体分子簇处于纳米量级,密度小,能产生丁达尔现象 |
| B.登陆车轮毂——铝基碳化硅材料:具有高强度、高耐磨性等优良属性,属于新型复合材料 |
| C.深蓝色闪蝶状高光电转化效率太阳翼:晶体硅呈深蓝色,可用于光电池,实现电能获取 |
| D.正十一烷相变集热器:白天正十一烷吸热液化储能,夜间凝固放热,以便给设备控温 |
您最近一年使用:0次
5 . 已知A、B、C、D、E是中学化学中的常见气体,它们都是由1-18号元素组成的单质或化合物,并有如下的信息:
①A气体能使湿润的红色石蕊试纸变蓝;
②B气体通入品红溶液,红色褪去,继续加热,溶液又变红色;
③C气体通入紫色石蕊试液,溶液先变红色,迅速变为无色;
④D为红棕色、有刺激性气味的气体,能和水反应生成无色气体。
⑤E为黄绿色的、有刺激性气味的气体。
试确定它们的化学式:A_____ ,B____ ,C____ ,D____ ,E____ 。
①A气体能使湿润的红色石蕊试纸变蓝;
②B气体通入品红溶液,红色褪去,继续加热,溶液又变红色;
③C气体通入紫色石蕊试液,溶液先变红色,迅速变为无色;
④D为红棕色、有刺激性气味的气体,能和水反应生成无色气体。
⑤E为黄绿色的、有刺激性气味的气体。
试确定它们的化学式:A
您最近一年使用:0次
2022-12-03更新
|
232次组卷
|
2卷引用:吉林江城中学2021-2022学年高三上学期9月月考化学试题
解题方法
6 . 2014年3月8日马航MH370航班失联,引发世人对航空安全的强烈关注。已知该航班客机机型为波音777,使用了钛铝合金材料。钛铝合金属于
| A.混合物 | B.化合物 | C.氧化物 | D.单质 |
您最近一年使用:0次
7 . 铝土矿中的主要成分是Al2O3,还含有少量Fe2O3等杂质。工业上从铝土矿中提取铝的工艺流程如下图所示。
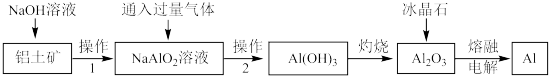
请回答下列问题
(1)“操作1”“操作2”相同,操作的名称为_______ ,实验室进行此项操除使用烧杯外还要使用的玻璃仪器有_______ 。
(2)向 溶液中通入了一种过量气体,这种气体是下列中的
溶液中通入了一种过量气体,这种气体是下列中的_______ (填字母)。
a.HCl b.NH3 c.CO2 d.O2
(3)冶炼铝需要纯度较高的氧化铝,检验得到的氧化铝中不含Fe2O3的化学方法是_______ 。
(4)写出电解熔融氧化铝的方程式_______ 。
请回答下列问题
(1)“操作1”“操作2”相同,操作的名称为
(2)向
 溶液中通入了一种过量气体,这种气体是下列中的
溶液中通入了一种过量气体,这种气体是下列中的a.HCl b.NH3 c.CO2 d.O2
(3)冶炼铝需要纯度较高的氧化铝,检验得到的氧化铝中不含Fe2O3的化学方法是
(4)写出电解熔融氧化铝的方程式
您最近一年使用:0次
名校
8 . 按要求回答下列问题:
(1)用氧化物的形式表示硅酸盐的组成,镁橄榄石(Mg2SiO4)表示为_______ 。
(2)氢氟酸可刻蚀玻璃,反应的化学方程式为_______ 。
(3)将物质的量之比为2:3:4的N2、O2、CO2混合气体通过一定量Na2O2后,气体体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为_______ 。
(4)利用炼铝厂的废料-铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如图,回答下列问题:
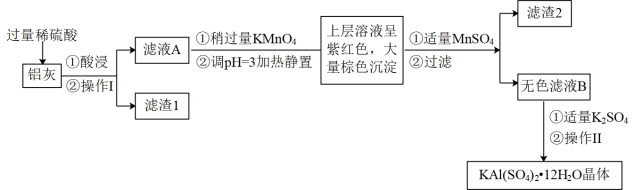
①检验滤液A中是否存在Fe2+的试剂是_______ 。
②若向滤液A中加入过量的NaOH溶液,会观察到先产生沉淀,之后沉淀会部分溶解,沉淀溶解时发生反应的离子方程式是_______ ,过滤将所得沉淀放在空气中久置后,沉淀颜色会加深,这一变化的化学方程式是_______ 。
③在滤液A中加入酸性高锰酸钾,发生反应的离子方程式为(该条件下MnO 转化为Mn2+):
转化为Mn2+):_______ 。
④已知:生成氢氧化物的pH如表所示:
根据流程图所示,在大量棕色沉淀产生后,在上层溶液中又加入适量的MnSO4,继续产生了黑色沉淀,则滤渣2含有的物质是_______ 。
(1)用氧化物的形式表示硅酸盐的组成,镁橄榄石(Mg2SiO4)表示为
(2)氢氟酸可刻蚀玻璃,反应的化学方程式为
(3)将物质的量之比为2:3:4的N2、O2、CO2混合气体通过一定量Na2O2后,气体体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
(4)利用炼铝厂的废料-铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如图,回答下列问题:

①检验滤液A中是否存在Fe2+的试剂是
②若向滤液A中加入过量的NaOH溶液,会观察到先产生沉淀,之后沉淀会部分溶解,沉淀溶解时发生反应的离子方程式是
③在滤液A中加入酸性高锰酸钾,发生反应的离子方程式为(该条件下MnO
 转化为Mn2+):
转化为Mn2+):④已知:生成氢氧化物的pH如表所示:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据流程图所示,在大量棕色沉淀产生后,在上层溶液中又加入适量的MnSO4,继续产生了黑色沉淀,则滤渣2含有的物质是
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)理论研究表明,在101kPa和298K下,HCN(g)=HNC(g)异构化反应过程的能量变化如图所示,计算可得:HCN(g)=HNC(g) ∆H=_______ kJ∙mol−1。HCN与HNC稳定性较强的是_______ 。

(2)已知:HCN的Ka=6.3×10−10,将0.1 mol∙L−1的NaCN溶液与0. 1 mol∙L−1的HCN溶液等体积混合后,溶液中离子浓度从大到小的关系为_______ 。
(3)通过电激发产生HO•和OH-可处理废水中的CN-,其可能的反应机理如图所示。

虚线方框内的过程用语言文字可描述为:_______ ,•O 结合H+生成•O2H,•O2H分解生成O2和H2O2。
结合H+生成•O2H,•O2H分解生成O2和H2O2。
(4)CN在一定条件下可转化成氮的氧化物,氮的氧化物可发生如下反应:
Ⅰ. 2NO(g)+O2 2NO2(g) ΔH<0
2NO2(g) ΔH<0
Ⅱ. 2NO2 N2O4
N2O4
①恒温恒容条件下,对反应Ⅰ,能说明此反应已达平衡状态的是_______
A.NO2的体积分数不变 B.容器内的气体密度不再改变
C.容器内气体压强不再改变 D.混合气体颜色深浅保持不变
②对反应Ⅱ,达到平衡后,升高温度可使体系颜色加深,若在密闭容器中达平衡改变外界条件再次平衡新平衡时,c(NO2)/ c(N2O4)比原平衡大了,则改变的条件可能是_______ 。
A.容器容积和温度不变,充入NO2 B.容器容积和温度不变,充入N2O4
C.容器温度和压强不变,充入N2 D.容器温度和压强不变的,充入N2O4
③反应Ⅱ,正反应速率方程为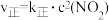 ,逆反应速率方程为
,逆反应速率方程为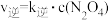 ,其中
,其中 、
、 分别为正、逆反应速率常数。则图中(lgK表示速率常数的对数;
分别为正、逆反应速率常数。则图中(lgK表示速率常数的对数; 表示温度的倒数)所示的①②③④四条斜线中。能表示
表示温度的倒数)所示的①②③④四条斜线中。能表示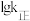 正随
正随 变化的斜线是
变化的斜线是_______ ,图中A、B、C、D四点的纵坐标分别为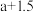 、
、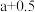 、
、 、
、 ,则在温度
,则在温度 下,某时刻恒容密闭容器中
下,某时刻恒容密闭容器中 、
、 的浓度均为
的浓度均为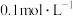 ,此时
,此时
_______  。(填大于、等于或小于)
。(填大于、等于或小于)

(1)理论研究表明,在101kPa和298K下,HCN(g)=HNC(g)异构化反应过程的能量变化如图所示,计算可得:HCN(g)=HNC(g) ∆H=

(2)已知:HCN的Ka=6.3×10−10,将0.1 mol∙L−1的NaCN溶液与0. 1 mol∙L−1的HCN溶液等体积混合后,溶液中离子浓度从大到小的关系为
(3)通过电激发产生HO•和OH-可处理废水中的CN-,其可能的反应机理如图所示。

虚线方框内的过程用语言文字可描述为:
 结合H+生成•O2H,•O2H分解生成O2和H2O2。
结合H+生成•O2H,•O2H分解生成O2和H2O2。(4)CN在一定条件下可转化成氮的氧化物,氮的氧化物可发生如下反应:
Ⅰ. 2NO(g)+O2
 2NO2(g) ΔH<0
2NO2(g) ΔH<0Ⅱ. 2NO2
 N2O4
N2O4①恒温恒容条件下,对反应Ⅰ,能说明此反应已达平衡状态的是
A.NO2的体积分数不变 B.容器内的气体密度不再改变
C.容器内气体压强不再改变 D.混合气体颜色深浅保持不变
②对反应Ⅱ,达到平衡后,升高温度可使体系颜色加深,若在密闭容器中达平衡改变外界条件再次平衡新平衡时,c(NO2)/ c(N2O4)比原平衡大了,则改变的条件可能是
A.容器容积和温度不变,充入NO2 B.容器容积和温度不变,充入N2O4
C.容器温度和压强不变,充入N2 D.容器温度和压强不变的,充入N2O4
③反应Ⅱ,正反应速率方程为
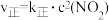 ,逆反应速率方程为
,逆反应速率方程为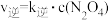 ,其中
,其中 、
、 分别为正、逆反应速率常数。则图中(lgK表示速率常数的对数;
分别为正、逆反应速率常数。则图中(lgK表示速率常数的对数; 表示温度的倒数)所示的①②③④四条斜线中。能表示
表示温度的倒数)所示的①②③④四条斜线中。能表示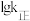 正随
正随 变化的斜线是
变化的斜线是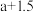 、
、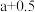 、
、 、
、 ,则在温度
,则在温度 下,某时刻恒容密闭容器中
下,某时刻恒容密闭容器中 、
、 的浓度均为
的浓度均为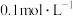 ,此时
,此时
 。(填大于、等于或小于)
。(填大于、等于或小于)
您最近一年使用:0次
名校
10 . 工业上从电解精炼铜的阳极泥中(主要含金、银、铜、硒等贵重金属)回收提取银、金、硒的流程图:
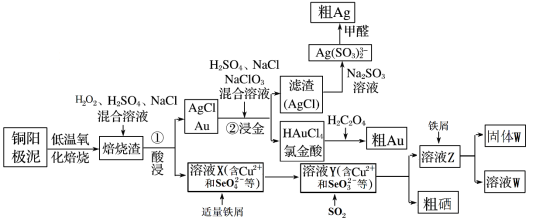
已知:①相同浓度下,SeO 氧化性强于Cu2+
氧化性强于Cu2+
②NaClO3在酸性条件下氧化性强
(1)“焙烧渣”在“①酸浸”时,为了更好酸浸,可采取的一种办法是_______ ,其中银元素发生反应的离子方程式为_______ ;
(2)向溶液X中加入铁屑的作用是_______ ;
(3)氯金酸(HAuCl4)中的Au的化合价为_______ ;
(4)“②浸金”反应中,H2SO4的作用为_______ ;
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为_______
(6)由溶液W制取Fe(OH)3,需先将溶液W_______ ,然后再使溶液中的铁元素沉淀完全,所需溶液的pH最小为_______ 。(已知,常温下,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)

已知:①相同浓度下,SeO
 氧化性强于Cu2+
氧化性强于Cu2+②NaClO3在酸性条件下氧化性强
(1)“焙烧渣”在“①酸浸”时,为了更好酸浸,可采取的一种办法是
(2)向溶液X中加入铁屑的作用是
(3)氯金酸(HAuCl4)中的Au的化合价为
(4)“②浸金”反应中,H2SO4的作用为
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为
(6)由溶液W制取Fe(OH)3,需先将溶液W
您最近一年使用:0次
2022-03-16更新
|
114次组卷
|
2卷引用:吉林省长春市十一高中2021-2022学年高三上学期第二学程考试理综化学试题



