名校
1 . 镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业.回答下列问题:
(1)镓 的原子结构示意图为
的原子结构示意图为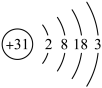 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是_________ .
(2) 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是_____________ (填“共价化合物”或“离子化合物”).
(3)已知 与
与 同周期,
同周期, 与N同主族.
与N同主族.
①用原子结构理论推测, 中
中 元素的化合价为
元素的化合价为____________ ;
②下列事实不能用元素周期律解释的是___________ (填标序号);
a.原子半径: b.热稳定性:
b.热稳定性: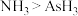
c.碱性: d.酸性:
d.酸性: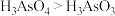
(4) 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产 的工艺如图.
的工艺如图.
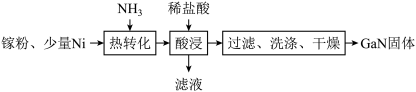
①“热转化”时 转化为
转化为 的化学方程式是
的化学方程式是______________ ;
②“酸浸”操作的目的是_______________ ;
③某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
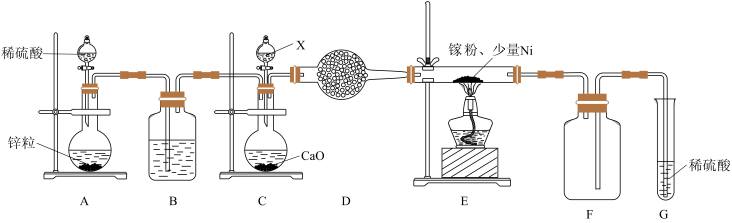
仪器X中的试剂是____________ ;加热前需先通入一段时间的 ,原因是
,原因是____________ ;装置G的作用是___________ .
(1)镓
 的原子结构示意图为
的原子结构示意图为 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是(2)
 的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是
的熔点为1238℃,且熔融状态不导电,据此判断,该化合物是(3)已知
 与
与 同周期,
同周期, 与N同主族.
与N同主族.①用原子结构理论推测,
 中
中 元素的化合价为
元素的化合价为②下列事实不能用元素周期律解释的是
a.原子半径:
 b.热稳定性:
b.热稳定性: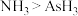
c.碱性:
 d.酸性:
d.酸性: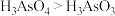
(4)
 是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产
是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中.一种镍催化法生产 的工艺如图.
的工艺如图.
①“热转化”时
 转化为
转化为 的化学方程式是
的化学方程式是②“酸浸”操作的目的是
③某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:

仪器X中的试剂是
 ,原因是
,原因是
您最近一年使用:0次
2021-06-11更新
|
492次组卷
|
3卷引用:河南省郑州市郊县2020-2021高一下学期期中考试化学试题
解题方法
2 . 元素周期表在化学中有举足轻重的地位。请根据提示回答下列问题:
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置_______ 。Fe 分别与硫单质和氯气共热,可以得到两种含铁的二元化合物。请问这两种物质中金属阳离子的未成对电子数之比为_______ 。
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式_______ 。利用铜离子作为中心原子可以形成多种具有良好特性的配合物。我们熟知的是一种深蓝色配合物,向硫酸铜溶液中通入过量氨气,可制备这种深蓝色配合物[Cu(NH3)4]2+。请用适当的化学用语描述该反应过程的实质_______ 。写出[Cu(NH3)4]2+配体的电子式_______ 。
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是_______ 。
(4)CoO 的晶胞如图所示。
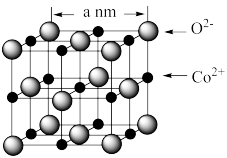
设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为_______ g﹒cm−3(列出计算式即可)
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO 的 VSEPR 模型为
的 VSEPR 模型为_______ ,其中 P 的杂化轨道类型为_______ 。
(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因_______ 。
(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因_______
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因_______ 。
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是
(4)CoO 的晶胞如图所示。

设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO
 的 VSEPR 模型为
的 VSEPR 模型为(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF
 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约 400 |
您最近一年使用:0次
3 . W、X、Y、Z为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为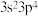 ,X的电离能数据如下表所示。
,X的电离能数据如下表所示。
(1)X在元素周期表中的位置是___________ 。
(2)用电子式表示WZ的形成过程:___________ 。
(3)下列事实能用元素周期律解释的是___________(填字母序号)。
(4)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
i.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为 ,该水化物中的
,该水化物中的 结构有两种断键方式:断
结构有两种断键方式:断 键在水中电离出
键在水中电离出 ;断
;断 键在水中电离出
键在水中电离出 。
。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一、水化物的 结构中,成键原子电负性差异越大,所形成的化学键越容易断裂。
结构中,成键原子电负性差异越大,所形成的化学键越容易断裂。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响 中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈___________ (填“酸”或“碱”)性,依据是___________ 。
②W和X的最高价氧化物对应的水化物中,碱性较强的是___________ (写化学式),结合资料说明理由:___________ 。
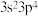 ,X的电离能数据如下表所示。
,X的电离能数据如下表所示。| 电离能 |  |  |  |  |  |
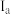 / / | 738 | 1451 | 7733 | 10540 |  |
(2)用电子式表示WZ的形成过程:
(3)下列事实能用元素周期律解释的是___________(填字母序号)。
| A.W可用于制备活泼金属钾 |
B.Y的气态氢化物的稳定性小于 |
C.将Z单质通入 溶液中,溶液变浑浊 溶液中,溶液变浑浊 |
D.Y的氧化物对应的水化物 的酸性比 的酸性比 强 强 |
i.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为
 ,该水化物中的
,该水化物中的 结构有两种断键方式:断
结构有两种断键方式:断 键在水中电离出
键在水中电离出 ;断
;断 键在水中电离出
键在水中电离出 。
。ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一、水化物的
 结构中,成键原子电负性差异越大,所形成的化学键越容易断裂。
结构中,成键原子电负性差异越大,所形成的化学键越容易断裂。①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响
 中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈②W和X的最高价氧化物对应的水化物中,碱性较强的是
您最近一年使用:0次
名校
解题方法
4 . 现以乙烷为主要原料合成化合物G,其合成路线如下图:___________ 。
(2)C的名称是________ ,其官能团名称是_________ ,空间结构是___________ 。
(3)写出B的结构式,并用*标出发生反应②时B的断键位置___________ 。
(4)步骤③的反应类型是___________ ,步骤⑤的反应类型是___________ 。
(5)写出步骤④的化学方程式___________ 。
(6)G由C、H、O三种元素组成,球棍模型如下图,则G的结构简式为___________ 。___________ ,写出H可能的结构简式___________ 。

(2)C的名称是
(3)写出B的结构式,并用*标出发生反应②时B的断键位置
(4)步骤③的反应类型是
(5)写出步骤④的化学方程式
(6)G由C、H、O三种元素组成,球棍模型如下图,则G的结构简式为
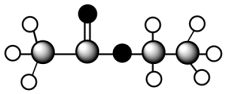
您最近一年使用:0次
2023-06-27更新
|
140次组卷
|
2卷引用:广东省广州市执信中学2020-2021学年高一下学期期中考试化学试题
解题方法
5 . 下图是部分短周期主族元素原子半径与原子序数的关系。
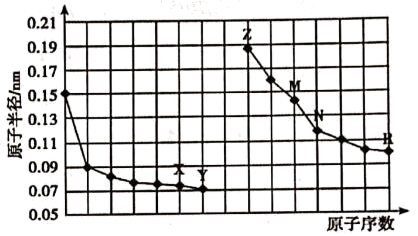
(1)X元素在元素周期表中的位置:___________ 。
(2)Y与Z形成的是___________ 化合物。(填“离子”或“共价”)
(3)上述元素中,最高价氧化物的水化物碱性最强的是___________ (填化学式)。
(4)下列关于元素及其化合物性质的判断中,正确的是___________ (填序号)
A.元素Z最外层只有1个电子,而M最外层有3个电子,所以金属性:
B.可通过Z与W的单质与水反应的剧烈程度的实验,判断金属性
C.Z、M、R三种元素的简单离子半径的大小: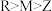
D.X、Y两种元素的气态氢化物的稳定性:
(5)某小组为证明N和R的非金属性强弱,设计实验方案如下,取N的最高价含氧酸正盐溶液,滴加含R的某溶液,通过观察实验现象来证明,其化学方程式为___________ 。

(1)X元素在元素周期表中的位置:
(2)Y与Z形成的是
(3)上述元素中,最高价氧化物的水化物碱性最强的是
(4)下列关于元素及其化合物性质的判断中,正确的是
A.元素Z最外层只有1个电子,而M最外层有3个电子,所以金属性:

B.可通过Z与W的单质与水反应的剧烈程度的实验,判断金属性

C.Z、M、R三种元素的简单离子半径的大小:
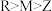
D.X、Y两种元素的气态氢化物的稳定性:

(5)某小组为证明N和R的非金属性强弱,设计实验方案如下,取N的最高价含氧酸正盐溶液,滴加含R的某溶液,通过观察实验现象来证明,其化学方程式为
您最近一年使用:0次
6 . 乳酸是生命体新陈代谢过程中产生的一种常见有机酸,也是一种重要化工原料,被广泛应用于食品、制药及绿色材料等生产领域。乳酸及其衍生物的转化关系如图所示。
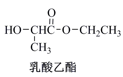



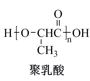
请回答下列问题:
(1)乳酸的分子式为___ ;乳酸分子中有两个含氧官能团,其中一个是羟基,另一个含氧官能团的名称是___ 。
(2)乳酸易溶于水,是因为乳酸能与水形成___ 键。乳酸可用于清除水垢,是因为它具有___ 性。
(3)聚乳酸的结构简式中,n代表聚合度,n值越大,聚乳酸的平均相对分子质量___ (填“越大”或“越小”)。
(4)化合物A的结构简式为___ ,其核磁共振氢谱有___ 组(个)吸收峰;化合物A与乳酸反应的类型是___ 反应。
(5)写出以乳酸为原料(其它试剂任选),经过两步化学反应制备丙烯酸甲酯(CH2=CHCOOCH3)的合成路线___ 。





请回答下列问题:
(1)乳酸的分子式为
(2)乳酸易溶于水,是因为乳酸能与水形成
(3)聚乳酸的结构简式中,n代表聚合度,n值越大,聚乳酸的平均相对分子质量
(4)化合物A的结构简式为
(5)写出以乳酸为原料(其它试剂任选),经过两步化学反应制备丙烯酸甲酯(CH2=CHCOOCH3)的合成路线
您最近一年使用:0次
7 . 从钒铬锰矿渣(主要成分为 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
(1)Cr元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数[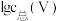 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中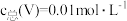 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。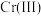 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为_______ ;在该条件下滤液B中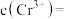
_______  【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: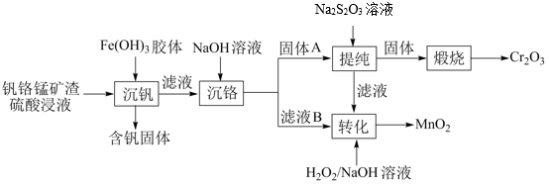
 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:(1)Cr元素位于元素周期表第
(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数[
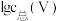 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中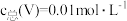 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为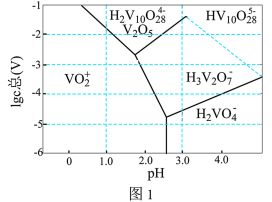
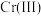 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为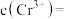
 【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近一年使用:0次
2021-09-13更新
|
10907次组卷
|
15卷引用:辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题
辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题2021年新高考辽宁化学高考真题2021年辽宁高考化学试题变式题11-19(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)05 无机化工流程题(5) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
8 . 已知:A~H均为短周期元素,它们的化合价与原子序数的关系如图甲。图乙表示部分元素的单质及化合物的转化关系,n、q、t是由两种元素组成的化合物,m是D的常见单质,p为H的单质,常温常压下r是淡黄色固体。


请回答下列问题:
(1)F元素在周期表中的位置为___________ ,E、H两种元素组成___________ 化合物(填写“离子”“共价”),A、C、D三种元素能形成的含有离子键和共价键的化合物,其化学式为___________ 。
(2)D、E、G、H元素的简单离子半径由大到小的顺序为(写化学式)___________ 。
(3)用电子式表达n的形成过程___________ 。
(4)在溶液中,反应②的化学方程式是___________ ,该反应证明元素原子得到电子能力的强弱顺序是___________ 。
(5)A和D形成的18电子分子的物质与A和G形成的18电子分子的物质在溶液中按物质的量比4∶1反应的化学方程式为___________ 。


请回答下列问题:
(1)F元素在周期表中的位置为
(2)D、E、G、H元素的简单离子半径由大到小的顺序为(写化学式)
(3)用电子式表达n的形成过程
(4)在溶液中,反应②的化学方程式是
(5)A和D形成的18电子分子的物质与A和G形成的18电子分子的物质在溶液中按物质的量比4∶1反应的化学方程式为
您最近一年使用:0次



