名校
解题方法
1 . 碘是人体所需的微量元素之一,使用加碘盐是为缺碘地区人群补碘的重要方式。某化学兴趣小组对碘盐中的含碘物质进行了成分探究。
【猜想预测】
(1)预测1:食盐中加入的含碘物质是碘化钾(KI)。
预测2:___________
预测3:食盐中加入的含碘物质是碘化钾(KI)和碘酸钾(KIO3)。
【实验探究】
可选试剂:碘盐溶液、0.5 mol/LKI溶液、稀硫酸、新制氯水、淀粉溶液。
查阅资料:KIO3在酸性条件下具有较强氧化性,可以与具有较强还原性的物质发生反应。
(2)甲同学基于预测,运用实验室提供的试剂,设计了如下实验,请补全表格:
【实验反思】
Ⅰ、乙同学认为使用Na2S溶液也可以验证该预测,因此设计了实验3如下:
查阅资料:同浓度下,S2-的还原性强于I-。
(3)试推测实验3中溶液未变蓝的可能原因___________ 。
Ⅱ、丙同学使用酸化的溶液进行了食盐中碘元素含量的测定,具体步骤如下:
查阅资料:根据中华人民共和国国家标准(GB26878-2011),在食用盐中加入碘强化剂后,食用盐产品(碘盐)中碘含量的平均水平(以碘元素计)为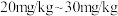 。
。
(4)用天平称量100 g某食盐样品于烧杯中,加入一定量的蒸馏水溶解,该烧杯中的KIO3与过量KI溶液完全反应后,经测定,生成的碘单质为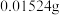 。则该样品中碘含量(以碘元素计)为
。则该样品中碘含量(以碘元素计)为___________ 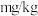 ,符合国家标准。
,符合国家标准。
【猜想预测】
(1)预测1:食盐中加入的含碘物质是碘化钾(KI)。
预测2:
预测3:食盐中加入的含碘物质是碘化钾(KI)和碘酸钾(KIO3)。
【实验探究】
可选试剂:碘盐溶液、0.5 mol/LKI溶液、稀硫酸、新制氯水、淀粉溶液。
查阅资料:KIO3在酸性条件下具有较强氧化性,可以与具有较强还原性的物质发生反应。
(2)甲同学基于预测,运用实验室提供的试剂,设计了如下实验,请补全表格:
| 实验编号 | 实验操作 | 实验现象 | 解释与结论 |
| 实验1 | 步骤1:取2 mL碘盐溶液,加入2 mL稀硫酸,滴加1滴淀粉溶液。 步骤2:在上述溶液中滴加1 mL新制氯水。 | 步骤1证明预测3不正确;步骤2证明预测1不正确 | |
| 实验2 | 步骤1:取 滴加1滴淀粉溶液。 步骤2:取2 mL碘盐溶液,加入上一步配制的检验试剂。 | 步骤1中溶液不变蓝色,步骤2中溶液变为蓝色 | 步骤1可排除空气带来的干扰;步骤2反应的离子方程式为 结论:预测2正确。 |
【实验反思】
Ⅰ、乙同学认为使用Na2S溶液也可以验证该预测,因此设计了实验3如下:
查阅资料:同浓度下,S2-的还原性强于I-。
| 实验编号 | 加入试剂或操作 | 实验现象 |
| 实验3 | 取2 mL碘盐溶液,滴加1滴淀粉溶液,再滴加1 mL0.5 mol/LNa2S溶液。 | 溶液未变蓝 |
Ⅱ、丙同学使用酸化的溶液进行了食盐中碘元素含量的测定,具体步骤如下:
查阅资料:根据中华人民共和国国家标准(GB26878-2011),在食用盐中加入碘强化剂后,食用盐产品(碘盐)中碘含量的平均水平(以碘元素计)为
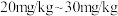 。
。(4)用天平称量100 g某食盐样品于烧杯中,加入一定量的蒸馏水溶解,该烧杯中的KIO3与过量KI溶液完全反应后,经测定,生成的碘单质为
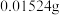 。则该样品中碘含量(以碘元素计)为
。则该样品中碘含量(以碘元素计)为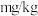 ,符合国家标准。
,符合国家标准。
您最近一年使用:0次
名校
解题方法
2 . 某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成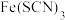 ,
,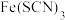 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成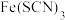 ,
,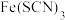 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次
2021-11-07更新
|
1003次组卷
|
4卷引用:北京市一零一中2021-2022学年高一上学期期中考试化学试题
名校
3 . 已知高锰酸钾固体在室温下能将浓盐酸氧化,发生反应: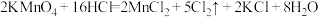
(1)标明上述化学方程式电子转移方向和数目___________ 。
(2)在该反应中,被还原的元素是_______ ,浓盐酸体现了_______ 性质(选填字母编号),氧化剂与还原剂的物质的量之比为______ 。
A.酸性B.碱性C.氧化性D.还原性
(3)产生0.1mol ,则转移的电子数目为
,则转移的电子数目为___________ 。
(4)下列装置中,可用作该反应的气体发生装置的是(选填字母编号)________ 。
A.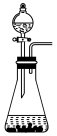 B.
B. C.
C.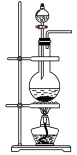
(5)用上述方法制得的氯气中含有杂质,可依次用如图洗气装置净化。装置D中应盛放_____ ,装置E中可盛放______ (均选填字母编号)

A.浓硫酸 B.NaOH溶液 C.饱和食盐水 D.固体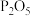 E.碱石灰
E.碱石灰
(6)氯气可用排空气法收集,在下图装置F中画出导管的正确位置______ 。装置G中盛放为NaOH溶液,作用是______ ,并写出反应的离子方程式________ 。
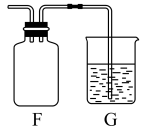
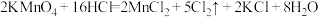
(1)标明上述化学方程式电子转移方向和数目
(2)在该反应中,被还原的元素是
A.酸性B.碱性C.氧化性D.还原性
(3)产生0.1mol
 ,则转移的电子数目为
,则转移的电子数目为(4)下列装置中,可用作该反应的气体发生装置的是(选填字母编号)
A.
 B.
B. C.
C.
(5)用上述方法制得的氯气中含有杂质,可依次用如图洗气装置净化。装置D中应盛放

A.浓硫酸 B.NaOH溶液 C.饱和食盐水 D.固体
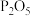 E.碱石灰
E.碱石灰(6)氯气可用排空气法收集,在下图装置F中画出导管的正确位置

您最近一年使用:0次
2021-11-08更新
|
231次组卷
|
2卷引用:上海市南洋模范中学2021-2022学年高一上学期期中考试化学试题
解题方法
4 . 生活处处离不开化学。阅读材料,完成各题:
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式___________ 。
(2)病人同时患有胃溃疡,此时最宜服用___________ (填“小苏打片”或“胃舒平”),发生反应的化学方程式为___________ 。
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是___________ 剂。
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式
(2)病人同时患有胃溃疡,此时最宜服用
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
5 . 含硫化合物的转化如下图所示,回答下列问题:

(1)酸雨的
_______ (填“>”“<”或“=”)5.6。
(2)黄铁矿的主要成分为 ,硫元素的化合价是:
,硫元素的化合价是:_______ 。
(3)C物质的化学式为_______ ,D物质的化学式为_______ 。
(4)写出A→B的化学方程式_______ 。
(5)某同学设计如下实验检验浓硫酸与木炭加热条件下反应的生成物:
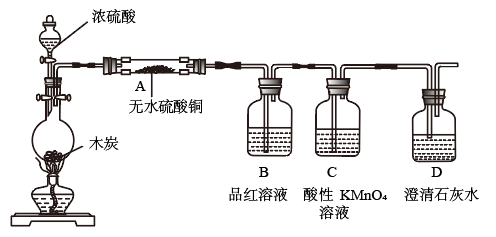
①A中的无水硫酸铜由白色变蓝色,证明生成物中有_______ 。
②D中的现象是:_______ ,证明生成物中有_______ 。
③B中品红溶液褪色,证明 具有
具有___ ;C中的酸性 溶液褪色证明
溶液褪色证明 具有
具有____ 。(以上两空填“氧化性”、“还原性”或“漂白性”)

(1)酸雨的

(2)黄铁矿的主要成分为
 ,硫元素的化合价是:
,硫元素的化合价是:(3)C物质的化学式为
(4)写出A→B的化学方程式
(5)某同学设计如下实验检验浓硫酸与木炭加热条件下反应的生成物:

①A中的无水硫酸铜由白色变蓝色,证明生成物中有
②D中的现象是:
③B中品红溶液褪色,证明
 具有
具有 溶液褪色证明
溶液褪色证明 具有
具有
您最近一年使用:0次
名校
解题方法
6 . 生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量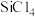 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)
(1)流程①焦炭体现了___________ (填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________ 。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________ 。
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________ (填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________ (填试剂名称);装置C中的烧瓶需要加热,其目的是___________ 。
(5)反应一段时间后,装置D中观察到的现象是___________ 。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________ ,该流程中能够循环利用的物质是___________ 。

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量
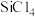 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)(1)流程①焦炭体现了
(2)流程③提纯SiHCl3的操作是
(3)流程④的化学反应为置换反应,写出其化学方程式:
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是
(5)反应一段时间后,装置D中观察到的现象是
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
名校
7 . I.化学学科作为一门基础自然科学,为推动人类文明和社会进步做出了重要贡献,作为中学生要学好它,需要大家准确掌握化学基本概念和研究方法。
(1)下列是某同学对中学常见的物质进行分类的列表:
上表中某一组分类中有一处错误,请指出其错误的物质_______ (填化学式);已知 在空气易被氧化变质,请结合教材中有关
在空气易被氧化变质,请结合教材中有关 的性质,请写出它与
的性质,请写出它与 反应的化学方程式
反应的化学方程式_______ 。
(2)胶体是一类重要的分散系,它和溶液的本质区别是_______ ,实验室中制备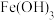 胶体的化学反应方程式为
胶体的化学反应方程式为_______ 。
(3)高铁酸钾( )是一种新型、高效、多功能绿色水处理剂,比
)是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入 至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(
至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(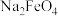 )的反应体系中有六种数粒:
)的反应体系中有六种数粒: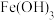 、
、 、
、 、
、 、
、 、
、 。
。
①写出并配平制高铁酸钠的离子反应方程式:_______ 。
②每生成 转移
转移_______  电子,若反应过程中转移了
电子,若反应过程中转移了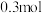 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为_______  。
。
Ⅱ.已知还原性: ,氧化性:
,氧化性:
(4)请写出向 溶液中滴加少量
溶液中滴加少量 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为_______ 。
(5)在 溶液中滴加过量
溶液中滴加过量 溶液,待反应完全后,推测溶液中的还原产物为
溶液,待反应完全后,推测溶液中的还原产物为_______ (填化学式)。
(6)向含 的溶液中逐滴加入
的溶液中逐滴加入 溶液。加入
溶液。加入 物质的量和析出
物质的量和析出 单质的物质的量的关系曲线如下图所示,写出反应过程中与
单质的物质的量的关系曲线如下图所示,写出反应过程中与 段曲线对应的离子方程式
段曲线对应的离子方程式_______ ;当溶液中 与
与 的物质的量之比为
的物质的量之比为 时,加入的
时,加入的 为
为_______  。
。

(1)下列是某同学对中学常见的物质进行分类的列表:
| 强电解质 | 弱电解质 | 盐 | 酸性氧化物 | 碱性氧化物 | |
| 第一组 |  |  |  |  |  |
| 第二组 |  |  |  |  |  |
| 第三组 |  | 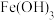 |  |  |  |
上表中某一组分类中有一处错误,请指出其错误的物质
 在空气易被氧化变质,请结合教材中有关
在空气易被氧化变质,请结合教材中有关 的性质,请写出它与
的性质,请写出它与 反应的化学方程式
反应的化学方程式(2)胶体是一类重要的分散系,它和溶液的本质区别是
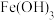 胶体的化学反应方程式为
胶体的化学反应方程式为(3)高铁酸钾(
 )是一种新型、高效、多功能绿色水处理剂,比
)是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入 至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(
至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(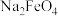 )的反应体系中有六种数粒:
)的反应体系中有六种数粒: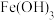 、
、 、
、 、
、 、
、 、
、 。
。①写出并配平制高铁酸钠的离子反应方程式:
②每生成
 转移
转移 电子,若反应过程中转移了
电子,若反应过程中转移了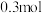 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。Ⅱ.已知还原性:
 ,氧化性:
,氧化性:
(4)请写出向
 溶液中滴加少量
溶液中滴加少量 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(5)在
 溶液中滴加过量
溶液中滴加过量 溶液,待反应完全后,推测溶液中的还原产物为
溶液,待反应完全后,推测溶液中的还原产物为(6)向含
 的溶液中逐滴加入
的溶液中逐滴加入 溶液。加入
溶液。加入 物质的量和析出
物质的量和析出 单质的物质的量的关系曲线如下图所示,写出反应过程中与
单质的物质的量的关系曲线如下图所示,写出反应过程中与 段曲线对应的离子方程式
段曲线对应的离子方程式 与
与 的物质的量之比为
的物质的量之比为 时,加入的
时,加入的 为
为 。
。
您最近一年使用:0次
解题方法
8 . 硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
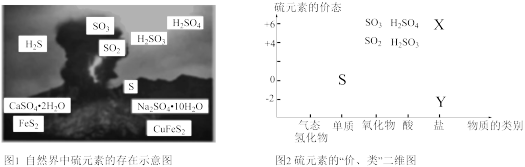
(1)从图1中选择符合图2要求的X、Y代表的物质:X_______ ,Y_______ 。
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
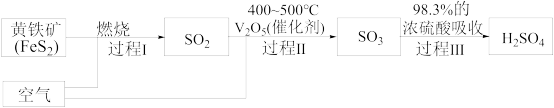
①上述过程中,没有发生氧化还原反应的是_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
②过程Ⅰ的化学反应方程式为_______ 。
③下列对浓硫酸的叙述正确的是_______ (填字母)。
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性
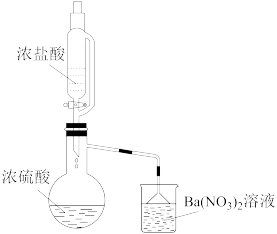
(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是_______ ;烧杯中出现白色沉淀,原因是_______ 。

(1)从图1中选择符合图2要求的X、Y代表的物质:X
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
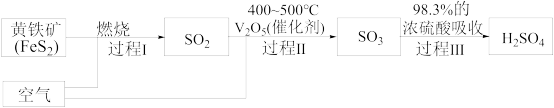
①上述过程中,没有发生氧化还原反应的是
②过程Ⅰ的化学反应方程式为
③下列对浓硫酸的叙述正确的是
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取
 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是

您最近一年使用:0次
名校
解题方法
9 . 某学习小组探究 的性质:
的性质:
(1)【观察】描述其颜色、状态:___________ 。
(2)【预测性质】从元素化合价来看, 中氧元素显
中氧元素显___________ 价,它具有的性质是___________ (填“氧化性”“还原性”或“氧化性和还原性”)。
(3)【设计实验】探究 和
和 反应情况
反应情况
取少量 粉末于试管,加入适量蒸馏水,产生气泡,用一根带火星的木条放在试管口,观察到木条复燃。振荡试管,使固体全部溶解,不再产生气泡时,将溶液分装甲、乙两支试管。向甲试管中撒少量
粉末于试管,加入适量蒸馏水,产生气泡,用一根带火星的木条放在试管口,观察到木条复燃。振荡试管,使固体全部溶解,不再产生气泡时,将溶液分装甲、乙两支试管。向甲试管中撒少量 粉末,又产生气泡;向乙试管中滴几滴酚酞溶液,溶液变红色,立即褪色。
粉末,又产生气泡;向乙试管中滴几滴酚酞溶液,溶液变红色,立即褪色。
①一般认为, 和
和 反应过程分两步:
反应过程分两步:
第一步, ;第二步,
;第二步,___________ (补充化学方程式)。
②为了进一步证明上述反应过程真实性,取少量粉末于试管,加入蒸馏水,使固体全部溶解,不再产生气泡时滴加几滴稀硫酸酸化的淀粉 溶液,若
溶液,若___________ (填实验现象),则证明结论成立。(已知:淀粉溶液遇 变蓝色。)
变蓝色。)
(4)【归纳总结】根据 和
和 反应生成
反应生成 和
和 ,
, 完全反应,参与反应的氧化剂质量为
完全反应,参与反应的氧化剂质量为___________ 。
(5)【问题与讨论】通过上述探究,你认为实验室保存 注意什么问题?答:
注意什么问题?答:______ 。
 的性质:
的性质:(1)【观察】描述其颜色、状态:
(2)【预测性质】从元素化合价来看,
 中氧元素显
中氧元素显(3)【设计实验】探究
 和
和 反应情况
反应情况取少量
 粉末于试管,加入适量蒸馏水,产生气泡,用一根带火星的木条放在试管口,观察到木条复燃。振荡试管,使固体全部溶解,不再产生气泡时,将溶液分装甲、乙两支试管。向甲试管中撒少量
粉末于试管,加入适量蒸馏水,产生气泡,用一根带火星的木条放在试管口,观察到木条复燃。振荡试管,使固体全部溶解,不再产生气泡时,将溶液分装甲、乙两支试管。向甲试管中撒少量 粉末,又产生气泡;向乙试管中滴几滴酚酞溶液,溶液变红色,立即褪色。
粉末,又产生气泡;向乙试管中滴几滴酚酞溶液,溶液变红色,立即褪色。①一般认为,
 和
和 反应过程分两步:
反应过程分两步:第一步,
 ;第二步,
;第二步,②为了进一步证明上述反应过程真实性,取少量粉末于试管,加入蒸馏水,使固体全部溶解,不再产生气泡时滴加几滴稀硫酸酸化的淀粉
 溶液,若
溶液,若 变蓝色。)
变蓝色。)(4)【归纳总结】根据
 和
和 反应生成
反应生成 和
和 ,
,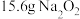 完全反应,参与反应的氧化剂质量为
完全反应,参与反应的氧化剂质量为(5)【问题与讨论】通过上述探究,你认为实验室保存
 注意什么问题?答:
注意什么问题?答:
您最近一年使用:0次
解题方法
10 . 某化学小组对铁及其化合物的性质、制备进行如下探究。请按要求回答下列问题。
(一) 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液
(1)同学甲探究铁具有还原性,可选择试剂: 粉、
粉、 溶液、
溶液、_______ 。
(2)同学乙为探究 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是_______ ;欲获得更充分证据,此实验操作应该完善为_______ 。
(3)同学丙欲探究 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为_______ 。
(二) 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
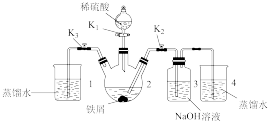
(4)为达到实验目的,需进行的操作:先打开 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再_______ ,_______ ,发现溶液从装置2进入装置3中,关闭 。
。
(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:_______ 。
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ. 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。
①从原子结构解释步骤I很容易发生的原因:_______ 。
②上述过程属于氧化还原反应的步骤为_______ (填序号)。
(7)化学修复过程探究:研究发现, 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生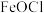 。将铁器浸没在盛有
。将铁器浸没在盛有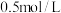
 、
、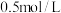
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。
①加热目的是_______ 。
②检测 洗涤干净与否的操作:
洗涤干净与否的操作:_______ 。
③铁器表面的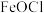 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
④修复中 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:_______ 。
(一)
 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液(1)同学甲探究铁具有还原性,可选择试剂:
 粉、
粉、 溶液、
溶液、(2)同学乙为探究
 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是(3)同学丙欲探究
 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为(二)
 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
(4)为达到实验目的,需进行的操作:先打开
 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再 。
。(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ.
 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。①从原子结构解释步骤I很容易发生的原因:
②上述过程属于氧化还原反应的步骤为
(7)化学修复过程探究:研究发现,
 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生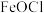 。将铁器浸没在盛有
。将铁器浸没在盛有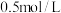
 、
、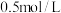
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。①加热目的是
②检测
 洗涤干净与否的操作:
洗涤干净与否的操作:③铁器表面的
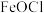 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:④修复中
 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次



