1 . 下表中对离子方程式的评价合理的是
| 选项 | 化学反应及其离子方程式 | 评价 |
| A |  溶液与 溶液与 溶液反应: 溶液反应: | 正确 |
| B | 向碳酸镁浊液中加入足量稀盐酸: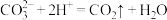 | 错误,碳酸镁不应写成离子形式 |
| C | 铁与稀盐酸反应: | 正确 |
| D | 向 溶液中加入 溶液中加入 溶液: 溶液: | 正确 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 完成下列小题
(1)已知:①2H2(g)+O2(g)=2H2O(l) △H1=-571.6kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H2=-1451.0kJ/mol,
则CO2(g)+3H2(g)=CH3OH(l)+H2O(l)的反应热△H=_____ 。
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g) CH3OH(g) △H<0,已知该反应中CO的转化率
CH3OH(g) △H<0,已知该反应中CO的转化率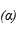 与温度(T)、压强(P)的关系如图所示:
与温度(T)、压强(P)的关系如图所示:
①P1_____ P2填(“ ”“
”“ ”“
”“ ”)。
”)。
②在不改变反应物用量情况下,既减小化学反应速率,又提高CO的转化率,可采取的措施是_____ (答出两条措施)。
(3)在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如下图所示: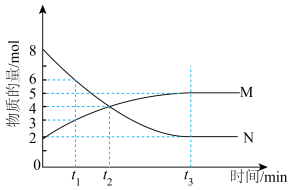
①比较t2时刻,正逆反应速率大小V正_____ V逆(填“ ”、“
”、“ ”、“
”、“ ”)
”)
②若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:_____ 。
③t3时刻化学反应达到平衡时反应物的转化率为_____ 。
④该条件下的平衡常数K=_____ 。
(1)已知:①2H2(g)+O2(g)=2H2O(l) △H1=-571.6kJ/mol
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H2=-1451.0kJ/mol,
则CO2(g)+3H2(g)=CH3OH(l)+H2O(l)的反应热△H=
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)
 CH3OH(g) △H<0,已知该反应中CO的转化率
CH3OH(g) △H<0,已知该反应中CO的转化率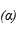 与温度(T)、压强(P)的关系如图所示:
与温度(T)、压强(P)的关系如图所示:
①P1
 ”“
”“ ”“
”“ ”)。
”)。②在不改变反应物用量情况下,既减小化学反应速率,又提高CO的转化率,可采取的措施是
(3)在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如下图所示:

①比较t2时刻,正逆反应速率大小V正
 ”、“
”、“ ”、“
”、“ ”)
”)②若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:
③t3时刻化学反应达到平衡时反应物的转化率为
④该条件下的平衡常数K=
您最近一年使用:0次
解题方法
3 . 实验室用下列方法测定某水样中O2的含量。
(1)实验原理:用如图1所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_____ 。MnO(OH)2中Mn元素的化合价是_____ 。再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6.
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是_____ ;
②用注射器抽取某水样20.00mL从A处注入锥形瓶;
③再分别从A处注入适量NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡。该步操作的目的是_____ ;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及适量的硫酸溶液;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴淀粉指示剂;
⑧用0.005mol·L-1Na2S2O3滴定至终点。滴定达到终点的现象是_____ 。
(3)数据分析
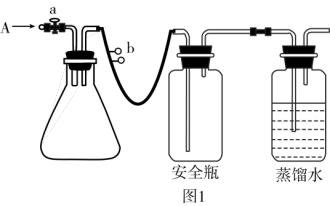
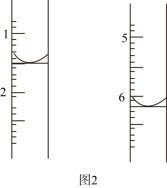
①若滴定过程中消耗的Na2S2O3标准溶液体积如图2所示。则此水样中氧(O2)的含量为_____ (单位:mg·L-1)。
②滴定前若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将_____ (填“偏大”、“偏小”或“不变”)。
③实验中加入适量的H2SO4使溶液pH控制在合适范围。其原因是_____ 。
(1)实验原理:用如图1所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为

(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是
②用注射器抽取某水样20.00mL从A处注入锥形瓶;
③再分别从A处注入适量NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡。该步操作的目的是
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及适量的硫酸溶液;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴淀粉指示剂;
⑧用0.005mol·L-1Na2S2O3滴定至终点。滴定达到终点的现象是
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积如图2所示。则此水样中氧(O2)的含量为

②滴定前若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将
③实验中加入适量的H2SO4使溶液pH控制在合适范围。其原因是
您最近一年使用:0次
解题方法
4 . 燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。下面是以葡萄糖为燃料的微生物燃料电池结构示意图:
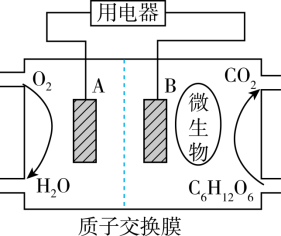
(1)A为生物燃料电池的_____ (填“正”或“负”)极。
(2)正极反应式为_____ 。
(3)放电过程中,H+由_____ 极区向_____ 极区迁移(填“正”或“负”)。
(4)在电池反应中,每消耗0.1mol氧气,理论上生成二氧化碳的质量是_____ 。

(1)A为生物燃料电池的
(2)正极反应式为
(3)放电过程中,H+由
(4)在电池反应中,每消耗0.1mol氧气,理论上生成二氧化碳的质量是
您最近一年使用:0次
解题方法
5 . 下列离子方程式不正确的是
A.溴水中通入SO2气体:Br2+SO2+2H2O=2H++ +2HBr +2HBr |
B.用盐酸和淀粉KI溶液检验加碘盐中的IO :IO :IO +5I-+6H+=3I2+3H2O +5I-+6H+=3I2+3H2O |
C.NaHCO3溶液中加入稀盐酸: +H+=CO2↑+H2O +H+=CO2↑+H2O |
D.NaHCO3溶液与足量的Ba(OH)2溶液混合: |
您最近一年使用:0次
13-14高三下·山东青岛·阶段练习
名校
解题方法
6 . 反应mA(g)+nB(g) pC(g)的速率和平衡图像如下,下列判断正确的是
pC(g)的速率和平衡图像如下,下列判断正确的是
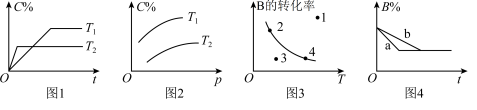
 pC(g)的速率和平衡图像如下,下列判断正确的是
pC(g)的速率和平衡图像如下,下列判断正确的是
| A.图1中,T1<T2,该反应正反应为吸热反应 |
| B.图3中,表示反应速率v正>v逆的是点3 |
| C.图2中,该反应m+n<p |
| D.图4中,若m+n=p,则a曲线一定使用了催化剂 |
您最近一年使用:0次
2024-01-11更新
|
165次组卷
|
97卷引用:云南省昭通市盐津县第二中学2023-2024学年高二上学期期末考试化学试题
云南省昭通市盐津县第二中学2023-2024学年高二上学期期末考试化学试题河北省唐山市开滦第一中学2022-2023学年高二上学期期末考试化学试题甘肃天祝藏族自治县第一中学2022-2023学年高二上学期1月期末考试化学试题四川省内江市第六中学2022-2023学年高二下学期入学考试化学试题 (已下线)第七章 化学反应速率与化学平衡 第44练 化学反应速率、平衡的常规图像湖北省十堰市部分重点中学2022-2023学年高二下学期3月联考化学试题新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题四川省双流中学2023-2024学年高二上学期10月月考化学试题广东省深圳市盐田高级中学2023-2024高二上学期期中考试化学试题山东省青岛第三中学2023-2024学年高二上学期期中考试化学试卷广东省广州市第八十九中学2023-2024学年高二上学期10月月考化学试题四川省仪陇中学校2023-2024学年高二上学期10月月考化学试题四川省成都列五中学2023-2024学年高二上学期10月月考化学试题(已下线)广西“贵百河”2023-2024学年高二上学期12月份联考化学试题山东省泰安市2023-2024学年高二上学期第四次调研测试化学试题(已下线)2014届山东省青岛市高三3月统一质量检测理综化学试卷2016届辽宁省五校协作体高三上学期期初考试化学试卷2015-2016学年安徽省六安一中高二上第一阶段测化学试卷2015-2016学年黑龙江大庆市铁人中学高一下期中化学试卷2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷2015-2016学年辽宁庄河高中高二下期末化学试卷2017届辽宁省铁岭市协作体高三第三次联考化学试卷2016-2017学年陕西西安中学高二平行班上期中化学卷江西省宜春市上高二中2017-2018学年高二第一次月考化学试题云南省玉溪市玉溪一中2017-2018学年高二上学期第二次月考化学试题河南省滑县第二高级中学2017-2018学年高二12月月考化学试题河南省中原名校(即豫南九校)2017-2018学年高二上学期第三次联考化学试题宁夏银川一中2017-2018学年高二上学期期末考试化学试题辽宁省大连市普兰店区第二中学2017-2018学年高二上学期期末考试化学试题黑龙江省伊春中学2017-2018学年高二化学上学期期末考试试题【校级联考】江西省南昌市八一中学、洪都中学七校2018-2019学年高二上学期期中考试化学试题【全国百强校】山东省济南第一中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 期末学业测评(二)【全国百强校】四川省雅安市雅安中学2018-2019学年高二上学期期中考试化学试题辽宁省大连市第一〇三中学2018-2019学年高二上学期期中考试化学试题【全国百强校】福建省三明市第一中学2019届高三上学期第二次月考化学试题江西省奉新县第一中学2019-2020学年高二上学期第一次月考化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题福建省福建师范大学附属中学2019-2020学年高二上学期期中考试化学(选考)试题广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题2019年秋高三化学复习强化练习—— 化学反应速率及化学平衡山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题新疆昌吉市教育共同体2019-2020学年高二年级上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)甘肃省张掖市2019—2020学年高二上学期期末学业水平质量检测化学试题山东省滕州市第一中学2019-2020学年高一下学期第一次月考化学试题山东省潍坊市安丘市实验中学2019-2020学年高一下学期期中考试化学试题河北省承德市第一中学2019-2020学年高一下学期第4次周测化学试题河北省保定市2019-2020学年高二下学期期中考试化学试题江西省宜春市樟树市滨江中学2018-2019学年高二上学期第一次月考化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期开学考试化学试题河北省石家庄市第二中学2019-2020学年高一7月期末考试百分练习化学试题河北省石家庄市第二中学2019-2020高一下期末考试化学模拟试题(三)吉林省东北师范大学附属中学2020届高三上学期第二次模拟考试化学试题江西省赣州市赣县区第三中学2020-2021学年高二上学期强化训练(一)化学试题云南省昆明师范专科学校附属中学2020-2021学年高二上学期期中考试化学试题广东省广州市广东实验中学2020-2021学年高二上学期月考化学试题福建省永安市第一中学2020-2021学年高二上学期期中考试化学试题江西省靖安中学2020-2021学年高二上学期第一次月考化学试题四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期期中考试化学试题陕西省泾阳县2020-2021学年高二上学期期中考试化学试题山东省济南市历城第一中学2021-2022学年高二上学期10月月考化学试题(已下线)第七单元 化学反应速率与化学平衡(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)吉林省长春市希望高中2021-2022学年高二上学期期中考试化学试题吉林省长春市十一高中2021-2022学年高二上学期期中考试化学试题江西省丰城中学 2021-2022 学年高三上学期第四次段考化学试题(尖子重点班)新疆昌吉州2021-2022学年高二上学期期末考试化学试题福建省南平高级中学2021-2022学年高三上学期12月月考化学试题河北省盐山中学2021-2022学年高二12月月考化学试题安徽省亳州市第一中学2021-2022学年高二上学期第二次月考化学试题甘肃省永昌县第一高级中学2021-2022学年高二上学期期末考试化学试题江西省山江湖协作体2021-2022学年高二上学期联考(统招班)化学试题吉林省吉林市第一中学2021-2022学年高一下学期(平行班)期中考试化学试题陕西省西安市西航一中2021-2022学年高二上学期期末考试化学试题浙江省杭州市浙江大学附属中学2021-2022学年高二上学期期末考试化学试题天津市汇文中学2022-2023学年高二上学期第二次阶段性测试化学试题广东省珠海市斗门区第一中学2022-2023学年高二上学期第一次考试化学试题山东省青岛第二中学2022-2023学年高二上学期10月月考化学试题广东省江门市新会华侨中学2022-2023学年高二上学期期中考试化学试题四川省成都外国语学校2022-2023学年高二上学期期中考试化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题河南郑州外国语学校2022-2023学年高三上学期调研考试2化学试题重庆市南川中学2022-2023学年高二上学期第一学月考试化学试题广东省珠海市斗门第一中学2022-2023学年高二上学期期中考试化学试题广东省梅州市兴宁市沐彬中学2022-2023学年高二上学期第二次月考化学试题吉林省乾安县第七中学2021-2022学年高二上学期第一次质量检测化学试题广东省深圳市第七高级中学2021-2022学年高二上学期期中考试化学试题吉林省四平市第一高级中学2022-2023学年高三上学期第三次月考化学试题内蒙古自治区包头市第九中学2022-2023学年高二上学期期末考试化学试题广东省大湾区2022-2023学年高二上学期期末联考化学试题河南省郑州外国语学校2022-2023学年高三上学期12月月考化学试题贵州省龙里中学2022-2023学年高二上学期11月期中考试化学试题北京市第一七一中学2022-2023学年高二上学期期中考试化学试题山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题
解题方法
7 . “氰化提金”产生的废水中含有一定量的 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:
25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
(1)常温下,将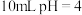 的HCN溶液加水稀释至1000mL,溶液的pH
的HCN溶液加水稀释至1000mL,溶液的pH_____ 6(填“>”“<”或“=”)。
(2)常温下,pH相等的NaCN和 溶液相比,浓度较大的是
溶液相比,浓度较大的是_____ (填化学式)溶液。
(3)常温下,在 溶液中加入
溶液中加入 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是_____ 。
(4)HCN的电子式是_____ 。
 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
| 酸 | HCN |  |
| Ka | Ka=6.2×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
 的HCN溶液加水稀释至1000mL,溶液的pH
的HCN溶液加水稀释至1000mL,溶液的pH(2)常温下,pH相等的NaCN和
 溶液相比,浓度较大的是
溶液相比,浓度较大的是(3)常温下,在
 溶液中加入
溶液中加入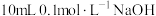 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是(4)HCN的电子式是
您最近一年使用:0次
名校
8 .  为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是A.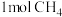 与 与 的混合气体中含氢原子数为 的混合气体中含氢原子数为 |
B.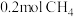 含电子数为 含电子数为 |
C. 完全转化为氢氧化铁胶体,生成 完全转化为氢氧化铁胶体,生成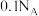 个胶粒 个胶粒 |
D.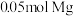 在空气中完全燃烧生成 在空气中完全燃烧生成 和 和 ,转移电子个数为 ,转移电子个数为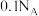 |
您最近一年使用:0次
2024-01-07更新
|
129次组卷
|
2卷引用:云南省昭通市等4地2023-2024学年高二上学期12月月考化学试题
解题方法
9 . 海洋是一个巨大的化学资源宝库,其中钠元素和氯元素是海洋中含量较高的元素。生活中也有很多含钠、含氯的化合物。请结合所学化学知识,回答下列问题:
(1)过氧化钠可以在潜水艇和消防员的呼吸面具中作为氧气来源。若只考虑过氧化钠与二氧化碳反应,每生成1mol氧气,反应转移电子数约为___________ 。
(2)①现实验室需要480mL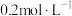 的
的 溶液,某同学用
溶液,某同学用 固体配制该物质的量浓度的溶液。应用托盘天平称取
固体配制该物质的量浓度的溶液。应用托盘天平称取 固体
固体_______ g。配制 溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、
溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、_______ 。
②如图所示是 溶液配制的过程:
溶液配制的过程:
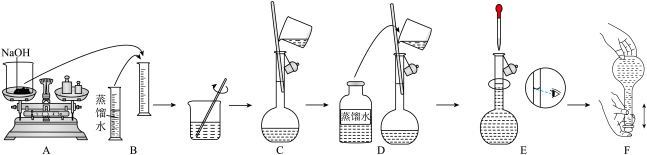
观察图示判断,其中不正确的操作有_______ (填序号)。
③实验时遇到下列情况,会导致溶液物质的量浓度偏低的是_______ (填序号)。
A.容量瓶内壁附有水珠而未干燥处理 B.称量使用的砝码已生锈
C.溶解时使用的烧杯及玻璃棒未洗涤 D.称量时间过长,固体部分已潮解
E.定容时仰视刻度线 F.摇匀后发现液面低于刻度线后未做处理
(3)纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。现将0.01mol 和0.01mol
和0.01mol  混合并配成溶液,向溶液中滴加
混合并配成溶液,向溶液中滴加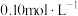 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成 的物质的量的关系的是___________(填序号)。
的物质的量的关系的是___________(填序号)。
(4)若称取16.8g纯净的 固体,充分加热后,剩余固体的质量为10.6g。如果把剩余的固体全部加入100mL
固体,充分加热后,剩余固体的质量为10.6g。如果把剩余的固体全部加入100mL 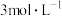 的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度
的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度___________ (设溶液的体积变化及盐酸的挥发忽略不计)。
(1)过氧化钠可以在潜水艇和消防员的呼吸面具中作为氧气来源。若只考虑过氧化钠与二氧化碳反应,每生成1mol氧气,反应转移电子数约为
(2)①现实验室需要480mL
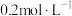 的
的 溶液,某同学用
溶液,某同学用 固体配制该物质的量浓度的溶液。应用托盘天平称取
固体配制该物质的量浓度的溶液。应用托盘天平称取 固体
固体 溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、
溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、②如图所示是
 溶液配制的过程:
溶液配制的过程:
观察图示判断,其中不正确的操作有
③实验时遇到下列情况,会导致溶液物质的量浓度偏低的是
A.容量瓶内壁附有水珠而未干燥处理 B.称量使用的砝码已生锈
C.溶解时使用的烧杯及玻璃棒未洗涤 D.称量时间过长,固体部分已潮解
E.定容时仰视刻度线 F.摇匀后发现液面低于刻度线后未做处理
(3)纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。现将0.01mol
 和0.01mol
和0.01mol  混合并配成溶液,向溶液中滴加
混合并配成溶液,向溶液中滴加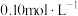 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成 的物质的量的关系的是___________(填序号)。
的物质的量的关系的是___________(填序号)。A.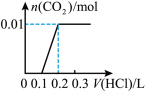 | B.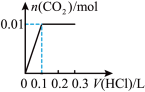 |
C.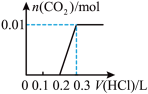 | D.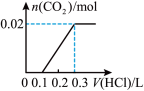 |
(4)若称取16.8g纯净的
 固体,充分加热后,剩余固体的质量为10.6g。如果把剩余的固体全部加入100mL
固体,充分加热后,剩余固体的质量为10.6g。如果把剩余的固体全部加入100mL 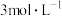 的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度
的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度
您最近一年使用:0次
2024-01-05更新
|
62次组卷
|
2卷引用:云南省昭通市市直中学联考2023-2024学年高一上学期第二次月考化学试题
10 . 化学在生产、生活中起着重要的作用:
① 的金属活泼性强,可用于制作铝金属制品
的金属活泼性强,可用于制作铝金属制品
② 胶体具有吸附性,可用于净水
胶体具有吸附性,可用于净水
③氕( )与核污水中的放射性元素氚(
)与核污水中的放射性元素氚(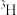 )互为同素异形体
)互为同素异形体
④维生素 可用作水果罐头的抗氧化剂是由于其具有还原性
可用作水果罐头的抗氧化剂是由于其具有还原性
⑤大力发展风能发电与实现“碳达峰、碳中和”理念相违背
⑥用盐酸除铁锈,是因为 溶于水后,其溶液显碱性
溶于水后,其溶液显碱性
其中叙述正确的个数有
①
 的金属活泼性强,可用于制作铝金属制品
的金属活泼性强,可用于制作铝金属制品②
 胶体具有吸附性,可用于净水
胶体具有吸附性,可用于净水③氕(
 )与核污水中的放射性元素氚(
)与核污水中的放射性元素氚(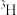 )互为同素异形体
)互为同素异形体④维生素
 可用作水果罐头的抗氧化剂是由于其具有还原性
可用作水果罐头的抗氧化剂是由于其具有还原性⑤大力发展风能发电与实现“碳达峰、碳中和”理念相违背
⑥用盐酸除铁锈,是因为
 溶于水后,其溶液显碱性
溶于水后,其溶液显碱性其中叙述正确的个数有
| A.1项 | B.2项 | C.3项 | D.4项 |
您最近一年使用:0次
2024-01-05更新
|
76次组卷
|
2卷引用:云南省昭通市市直中学联考2023-2024学年高一上学期第二次月考化学试题



