名校
1 . 甲、乙、丙、丁四种物质之间的转化关系如下所示,则下列说法错误的是
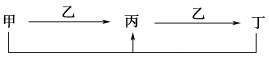
| A.若甲是C,则乙可能是O2 | B.若甲是NaOH溶液,则乙可能是SO2 |
| C.若甲是H2S,则乙可能是O2 | D.若甲是Fe,则乙可能是Cl2 |
您最近一年使用:0次
2024-01-15更新
|
209次组卷
|
18卷引用:第3课时 不同价态含硫物质的转化
第3课时 不同价态含硫物质的转化课中-5.1.3 不同价态含硫物质的转化-人教2019必修第二册安徽省淮北师范大学附属实验中学2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省安庆市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省合肥市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题贵州省贵阳清镇北大培文学校2022-2023学年高一下学期3月月考化学试题山东省泰安市新泰第一中学老校区2023-2024学年高一上学期第三次月考化学试题2015-2016学年贵州省遵义航天中学高一下3月月考化学卷安徽省宣城市郎溪县郎溪中学2018-2019学年高二上学期返校考化学试题安徽省马鞍山市和县2020-2021学年高一上学期期中联考化学试题福建省三明市第一中学2020-2021学年高一下学期开学考试化学试题(已下线)【浙江新东方】高中化学20210429—009【2021】【高一下】福建省武平县第一中学2020-2021学年高一上学期第二次阶段考试(实验班)化学试题(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河南省开封市五县联考2023-2024学年高一下学期3月月考化学试题
名校
解题方法
2 . 下列物质的检验中,其结论一定正确的是
A.向某溶液中加入 溶液,产生白色沉淀,加入稀 溶液,产生白色沉淀,加入稀 后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有 后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有 |
B.向某溶液中加入盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有 或 或 |
C.取少量久置的 样品于试管中加水溶解,若加足量盐酸时有气体产生,再加 样品于试管中加水溶解,若加足量盐酸时有气体产生,再加 溶液时有白色沉淀产生,则说明 溶液时有白色沉淀产生,则说明 样品已部分被氧化 样品已部分被氧化 |
D.将某气体通入品红溶液中,品红溶液褪色,该气体一定是 |
您最近一年使用:0次
2024-01-15更新
|
371次组卷
|
20卷引用:5.1.2 硫酸、含硫化合物的相互转化——同步学习必备知识
(已下线)5.1.2 硫酸、含硫化合物的相互转化——同步学习必备知识(已下线)第四章 非金属及其化合物 第21练 硫酸 含硫物质的转化西安市第八十三中学2022-2023学年高一下学期第一次月考化学试题(已下线)专题01 硫及其化合物的性质及转化(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)四川省达州市达川区2022-2023学年高一下学期4月期中考试化学试题江西省宜春市宜丰中学2022-2023学年高一下学期3月月考化学试题2016届甘肃省兰州第一中学高三9月月考化学试卷2017届河北省望都中学高三8月月考化学试卷2017届天津一中高三上第一次月考化学试卷2017届甘肃省兰州一中高三上学期9月月考化学试卷上海市十二校2016届高三3月联考化学试题甘肃省兰州市第二十七中学2022届高三上学期8月月考化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题江西省丰城市第九中学2022-2023学年高三上学期入学考化学试题上海市上海中学2023-2024学年高一上学期期末考试化学试卷湖北省襄阳市第一中学2023-2024学年高一下学期3月月考化学试题天津市滨海新区田家炳中学2023-2024学年高一下学期第一次月考化学试题山东省济宁市微山县第二中学2023-2024学年高一下学期第一次月考化学试题河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
9-10高三·湖北黄冈·阶段练习
名校
解题方法
3 . 已知:①相同温度下的溶解度为 ,
,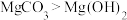 ;②溶解并电离出
;②溶解并电离出 的能力为
的能力为 。则下列离子方程式错误的是
。则下列离子方程式错误的是
 ,
,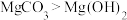 ;②溶解并电离出
;②溶解并电离出 的能力为
的能力为 。则下列离子方程式错误的是
。则下列离子方程式错误的是A. |
B.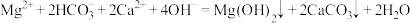 |
C. |
D. |
您最近一年使用:0次
2024-01-11更新
|
48次组卷
|
26卷引用:作业(二十一) 沉淀溶解平衡的应用
作业(二十一) 沉淀溶解平衡的应用作业(二十二) 沉淀的溶解与生成、转化及应用(已下线)2012年人教版高中化学选修4 3.4难溶电解质的溶解平衡练习卷(已下线)2014年高考化学一轮复习课后规范训练8-4练习卷云南省曲靖市第一中学2023-2024学年高二上学期11月期中考试化学试题山西省阳泉市城区瑞源教育培训学校2023-2024学年高二上学期12月大联考化学试题(已下线)湖北省黄冈中学2011届高三年级十月月考化学试题(已下线)2013届辽宁省五校协作体高三冲刺最后一模化学试卷(已下线)2013届北京市通州区高三年级上学期期末摸底考试理综化学试卷(已下线)2013-2014福建省南安一中高二下学期期末考试化学试卷2016届上海市十三校高三上学期第一次联考化学试卷2015-2016学年四川省彭州中学高二下2月月考化学试卷2017届湖南省益阳市箴言中学高三上学期第二次月考化学试卷2016-2017学年湖北省襄阳五中高二上10月月考化学试卷天津市耀华中学2018届高三上学期第一次月考化学试题云南省会泽县茚旺高级中学2018-2019学年高二上学期12月月考化学试题上海市南汇中学2019届高三下学期3月等级月考卷化学试题(已下线)第8章 单元测试(测)-《2020年高考一轮复习讲练测》云南省玉溪市江川区二中2019-2020学年高二上学期期末考试化学试题云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省遂宁市船山区第二中学校2019-2020学年高二下学期期中考试化学试题四川省成都市实验外国语学校(西区)2020-2021学年高二上学期12月月考化学测试卷四川省邻水实验学校2020-2021学年高二上学期第三阶段考试化学试题(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题(已下线)专题3 溶液中的离子反应 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河南省部分高中2023-2024学年高二上学期1月联考化学试题
4 . 某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。
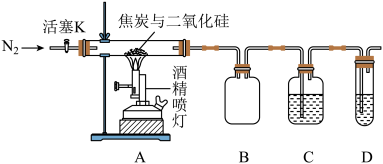
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O=CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是___________ 。
(2)装置B的作用是___________ 。
(3)装置C、D中所盛试剂分别为___________ 、___________ ,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为___________ 。
(4)该装置的缺点是___________ 。
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC.取36gSiO2和16.8g焦炭充分反应后收集到标准状况下的气体26.88L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为___________ 。

已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O=CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是
(2)装置B的作用是
(3)装置C、D中所盛试剂分别为
(4)该装置的缺点是
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC.取36gSiO2和16.8g焦炭充分反应后收集到标准状况下的气体26.88L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为
您最近一年使用:0次
5 . A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
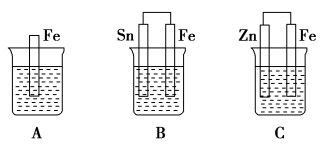
(1)A中反应的离子方程式为___________ 。
(2)B中锡极为________ 极,电极反应式为_________ ,锡极附近溶液的酸性_________ (填“增强”“减弱”或“不变”)。B中Fe极为________ 极,电极反应式为_________ 。
(3)C中被氧化的金属是___________ ,总反应的化学方程式为___________ 。
(4)A、B、C中铁被氧化由快到慢的顺序是___________ 。

(1)A中反应的离子方程式为
(2)B中锡极为
(3)C中被氧化的金属是
(4)A、B、C中铁被氧化由快到慢的顺序是
您最近一年使用:0次
6 . 工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。测得CH3OH和CO2的物质的量随时间变化如图所示。下列描述正确的是
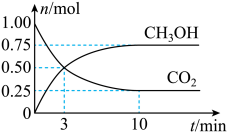

| A.达到平衡时,H2的转化率为25% |
| B.3min时,CH3OH和CO2的浓度相等,达到了化学平衡状态 |
| C.反应进行到10min时,CO2的正逆反应速率相等,反应停止 |
| D.反应开始到10min,用CO2表示的反应速率为0.0375mol·L-1·min-1 |
您最近一年使用:0次
7 . 如图所示是某同学利用注射器设计的简易实验装置。加热分离出可燃冰中的甲烷,将10mL甲烷注入甲注射器中,在同温、同压下向乙注射器中注入50mLCl2,将乙注射器中气体推入甲注射器中,用日光照射甲注射器一段时间,气体在甲注射器中发生反应。
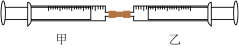
(1)下列是某同学预测的实验现象,其中正确的是___________(填字母)。
(2)甲注射器中发生的化学反应类型为___________ 。
(3)反应后,甲注射器中剩余气体最好用___________(填字母)吸收。

(1)下列是某同学预测的实验现象,其中正确的是___________(填字母)。
| A.气体最终变为无色 |
| B.实验过程中,甲注射器活塞向右移动 |
| C.甲注射器内壁有油状液滴产生 |
| D.产生火花 |
(2)甲注射器中发生的化学反应类型为
(3)反应后,甲注射器中剩余气体最好用___________(填字母)吸收。
| A.水 | B.氢氧化钠溶液 |
| C.硝酸银溶液 | D.饱和食盐水 |
您最近一年使用:0次
8 . 已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4mol/L的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为
| A.2.8×10-2mol/L | B.1.4×10-5mol/L | C.5.6×10-5mol/L | D.2.8×10-5mol/L |
您最近一年使用:0次
2024-01-10更新
|
112次组卷
|
38卷引用:作业(二十) 沉淀溶解平衡与溶度积
作业(二十) 沉淀溶解平衡与溶度积鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时1 沉淀溶解平衡及其应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)第三章 第四节 沉淀溶解平衡 第1课时 沉淀溶解平衡与溶度积黑龙江省实验中学2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁县阳高一中2023-2024学年高二上学期11月化学试卷陕西省 韩城市象山中学2023-2024学年高二上学期第三次月考化学试题 江西省抚州市临川区第一中学2017-2018学年高二上学期期中考试化学试题云南省中央民族大学附属中学芒市国际学校2017-2018学年高二上学期末考试化学试题湖南省衡阳县第四中学2018-2019学年高二第一学期实验班9月月考化学试题河北省沧州市盐山中学2018-2019学年高二上学期12月月考化学试题【全国百强校】河北省石家庄市第二中学2018-2019学年高二上学期期中考试化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(能力卷)试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(清北组)2020年春季人教版高中化学选修4第三章《水溶液中的离子平衡》测试卷(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第三章 水溶液中的离子平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题吉林省公主岭市范家屯镇第一中学2020-2021学年高二上学期期末两校联考化学试题甘肃省天水市一中2020-2021学年高二上学期第二学段(期末)考试化学试题吉林省白城市第一中学2020-2021学年高二下学期3月月考化学试题广西钦州市2020-2021学年高二下学期期末考试化学试题海南省北京师范大学万宁附属中学2021-2022学年高二上学期第一次月考化学试题 安徽省芜湖市第一中学2021-2022学年高二上学期第二次月末诊断测试化学试题新疆昌吉州2021-2022学年高二上学期期末考试化学试题陕西省渭南市大荔县2021-2022学年高二上学期期末考试化学试题安徽省阜阳市临泉县第一中学2021-2022学年高二下学期开学考试化学试题云南省文山州麻栗坡县2021-2022学年高二上学期期中测试化学试题辽宁省重点高中沈阳市郊联体2022-2023学年高二上学期期中考试化学试题辽宁省沈阳市辽中区第二高级中学2022-2023学年高二上学期期中考试化学试题广东省湛江市雷州市第二中学2023-2024学年高二下学期开学化学试题
9 . 化学反应的速率与限度在社会生产、生活和科学研究中具有广泛的应用,对人类文明的进步和现代化建设具有重大的价值,与我们每个人息息相关。恒温条件下,在5L恒容密闭容器内充入1.5molX(g)与2.0molY(g),反应10min后达到平衡,此时X的物质的量减少1mol,Y的物质的量浓度为0.2mol·L-1,0~10min内,生成Z的平均反应速率为0.04mol·L-1·min-1。请回答下列问题:
(1)该反应的化学方程式为___________ 。
(2)0~10min内,v(Y)=___________ mol·L-1·min-1。
(3)反应达到平衡状态时,X、Y的转化率分别为___________ 、___________ (保留三位有效数字)。
(4)298K时,将一定物质的量浓度的Na3AsO3、I2和NaOH三种溶液混合,发生反应:AsO (aq)+I2(aq)+2OH-(aq)⇌AsO
(aq)+I2(aq)+2OH-(aq)⇌AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
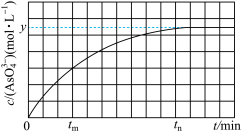
①tm时,v(正)___________ v(逆)(填“>”“<”或“=”)。
②从0到tn时,v(OH-)=___________ 。
③下列可判断反应达到平衡的是___________ (填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO ) c.
) c.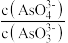 不再变化
不再变化
(1)该反应的化学方程式为
(2)0~10min内,v(Y)=
(3)反应达到平衡状态时,X、Y的转化率分别为
(4)298K时,将一定物质的量浓度的Na3AsO3、I2和NaOH三种溶液混合,发生反应:AsO
 (aq)+I2(aq)+2OH-(aq)⇌AsO
(aq)+I2(aq)+2OH-(aq)⇌AsO (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①tm时,v(正)
②从0到tn时,v(OH-)=
③下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I-)=2v(AsO
 ) c.
) c.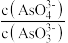 不再变化
不再变化
您最近一年使用:0次
解题方法
10 . 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
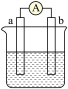
(1)当电极a为Zn,电极b为Cu,电解质溶液为CuSO4溶液时,正极的电极反应式为_______ 。若初始时两电极质量相等,当电路中有2mole-通过时,两极的质量差为_________ g。
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为______ 。当反应中收集到标准状况下336mL气体时,消耗负极的物质的量为________ mol。

(1)当电极a为Zn,电极b为Cu,电解质溶液为CuSO4溶液时,正极的电极反应式为
(2)当电极a为Al,电极b为Mg,电解质溶液为NaOH溶液时,该电池的负极反应式为
您最近一年使用:0次



