解题方法
1 . 下列化学用语表达正确的是
A. 的电子式: 的电子式: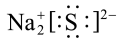 |
B. 分子的球棍模型: 分子的球棍模型: |
C. 的VSEPR模型: 的VSEPR模型: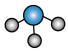 |
D.用电子云轮廓图表示  键的形成: 键的形成: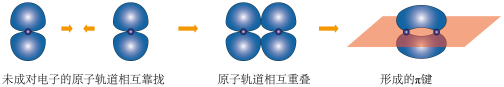 |
您最近一年使用:0次
解题方法
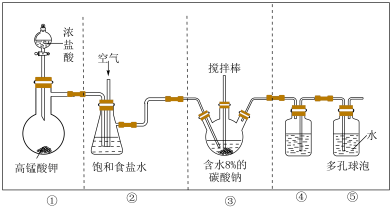
2 . 次氯酸作为消毒剂,被广泛应用于物体表面、织物等污染物品的消毒。某小组涉及如下装置(部分夹持装置略)制备 。
。 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;
ⅱ. 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;
ⅲ. 在
在 以上会分解。
以上会分解。
请回答下列问题:
(1)写出装置①中发生反应的化学方程式:_____ 。
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:_____ ;饱和食盐水也可替换为_____ 。
(3)制备 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_____ 。
(4)装置④的作用是_____ ;装置⑤中多孔球泡的作用是_____ 。
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b._____ 。
 。
。
 混合通入潮湿的碳酸钠中能生成
混合通入潮湿的碳酸钠中能生成 ,且反应放热;
,且反应放热;ⅱ.
 浓度过高时易爆炸,不含
浓度过高时易爆炸,不含 的
的 易与水反应生成
易与水反应生成 ;
;ⅲ.
 在
在 以上会分解。
以上会分解。请回答下列问题:
(1)写出装置①中发生反应的化学方程式:
(2)试从平衡角度分析装置②中试剂选择饱和食盐水的原因:
(3)制备
 的一种产物为
的一种产物为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)装置④的作用是
(5)实验小组成员发现该套制备装置的设计存在一定问题并制订了修正方案:
a.将装置④的导管改为左长右短;b.
您最近一年使用:0次
解题方法
3 . 一种处理废旧电池正极材料(主要成分为 ),制备三元锂电池正极材料
),制备三元锂电池正极材料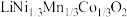 的工业流程如下:
的工业流程如下:
② 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。
回答下列问题:
(1)基态 价层电子排布图是
价层电子排布图是_____ 。
(2)“酸浸”中 发生反应的化学方程式为
发生反应的化学方程式为_____ ;“酸浸”中 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是_____ 。
(3)假设正极材料酸浸后溶液中金属阳离子浓度均为 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是_____ (溶液中某离子浓度小于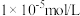 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。
(4)“沉锂”过程发生反应的离子方程式为_____ 。
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行_____ (填“预烧”、“酸洗”或“搅拌”)。
(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为: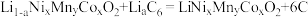 (石墨)
(石墨)
放电时工作装置简图如下,写出放电时A电极的电极反应式_____ 。
 ),制备三元锂电池正极材料
),制备三元锂电池正极材料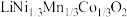 的工业流程如下:
的工业流程如下: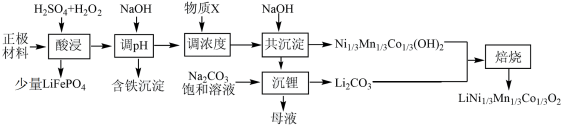

②
 时相关物质的溶度积数据如下表。
时相关物质的溶度积数据如下表。| 物质 |  |  |  |  |
 | 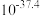 | 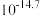 | 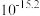 |  |
(1)基态
 价层电子排布图是
价层电子排布图是(2)“酸浸”中
 发生反应的化学方程式为
发生反应的化学方程式为 消耗量较大程度地超过理论用量,其原因可能是
消耗量较大程度地超过理论用量,其原因可能是(3)假设正极材料酸浸后溶液中金属阳离子浓度均为
 ,则“调
,则“调 ”过程中
”过程中 调控的范围是
调控的范围是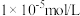 时,视为该离子沉淀完全)。
时,视为该离子沉淀完全)。(4)“沉锂”过程发生反应的离子方程式为
(5)产品的粒径和结晶度直接关系着三元电极的性能。为防止反应中产生的
 和
和 影响晶体生长,需在“焙烧”前进行
影响晶体生长,需在“焙烧”前进行(6)某三元锂电池以有机聚合物为电解质,电池放电时总反应方程式为:
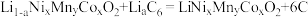 (石墨)
(石墨)放电时工作装置简图如下,写出放电时A电极的电极反应式

您最近一年使用:0次
2024-04-29更新
|
73次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
4 . 环氧乙烷( ,简称
,简称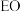 )是有机合成常用的试剂。
)是有机合成常用的试剂。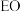 常温下易燃易爆,其爆炸极限为
常温下易燃易爆,其爆炸极限为 。工业上常用乙烯、氧气、氮气混合气投料的乙烯氧化法制备
。工业上常用乙烯、氧气、氮气混合气投料的乙烯氧化法制备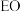 。涉及反应有:
。涉及反应有:

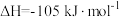
副反应:

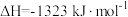
(1)主反应的活化能
 (正)
(正) (逆)(填“>”、“<”或“=”)。
(逆)(填“>”、“<”或“=”)。(2)已知
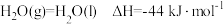 ,则
,则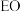 的燃烧热为
的燃烧热为
 。
。(3)在温度为T,压强为
 的环境下,欲提高乙烯的平衡转化率,理论上需
的环境下,欲提高乙烯的平衡转化率,理论上需(4)以Ag为催化剂的反应机理如下:
反应I:
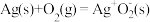 慢
慢反应Ⅱ:
 快
快反应Ⅲ:
 快
快①一定能够提高主反应反应速率的措施有
A.移出
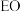 B.增大
B.增大 浓度 C.降低温度 D.增大
浓度 C.降低温度 D.增大 浓度
浓度②加入
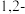 二氯乙烷会发生反应
二氯乙烷会发生反应 。一定条件下,反应经过一定时间后,
。一定条件下,反应经过一定时间后,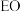 产率及选择性[
产率及选择性[ ]与
]与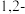 二氯乙烷浓度关系如图。
二氯乙烷浓度关系如图。
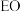 产率先增加后降低的原因可能是
产率先增加后降低的原因可能是(5)一定温度下,假定体系内只发生主反应,设
 的平衡分压为p,
的平衡分压为p, 的平衡转化率为x,用含p和x的代数式表示主反应的
的平衡转化率为x,用含p和x的代数式表示主反应的
您最近一年使用:0次
2024-04-29更新
|
65次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
5 .  为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为
为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为 ]按下列流程进行制备:
]按下列流程进行制备: 时
时 电离平衡常数
电离平衡常数 ,碳酸电离平衡常数
,碳酸电离平衡常数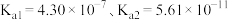 。下列说法正确的是
。下列说法正确的是
 为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为
为锂离子电池的正极材料的前体,用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。利用以氟磷灰石[主要成分为 ]按下列流程进行制备:
]按下列流程进行制备:
 时
时 电离平衡常数
电离平衡常数 ,碳酸电离平衡常数
,碳酸电离平衡常数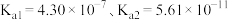 。下列说法正确的是
。下列说法正确的是A. 滴入足量 滴入足量 溶液中反应: 溶液中反应: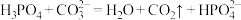 |
B.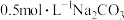 溶液中存在: 溶液中存在: |
C. 溶液中: 溶液中: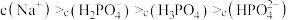 |
D.产生 沉淀的上层清液中, 沉淀的上层清液中, |
您最近一年使用:0次
6 . 氢能是极具发展潜力的清洁能源,2021年我国制氢量位居世界第一、
Ⅰ.以 和
和 为原料生产甲醇的一种途径涉及的反应有:
为原料生产甲醇的一种途径涉及的反应有:
ⅰ.
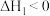
ⅱ.
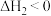
ⅲ.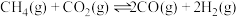
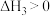
(1)关于反应ⅰ,下列描述正确的是_____ (填字母)。
A.恒压条件下达到平衡状态时,再充入少量氦气,正逆反应速率不变
B.恒容条件下,混合气体的平均摩尔质量不变时反应达到平衡
C.恒压条件下,混合气体的密度不变时反应达到平衡
D.断裂 键的同时断裂
键的同时断裂 键,则该反应达到平衡
键,则该反应达到平衡
E.在恒容容器中通入 和
和 ,当
,当 的体积分数不变时,则该反应达到平衡
的体积分数不变时,则该反应达到平衡
F.该反应达到平衡状态时,其他条件不变,升温,反应逆向移动,则该反应的正反应速率减小,逆反应速率增大
(2)若某反应的平衡常数表达式为 ,根据反应ⅰ~ⅲ,写出该反应的热化学方程式:
,根据反应ⅰ~ⅲ,写出该反应的热化学方程式:_____ 。
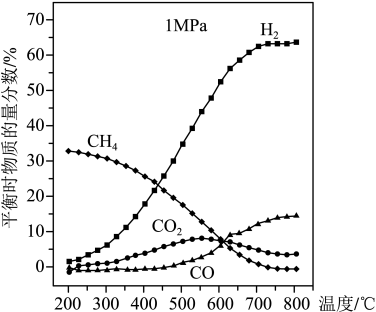
(3)工业中,对于反应ⅰ,通常同时存在副反应ⅳ: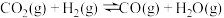
 。
。 和
和 ,发生反应ⅰ和ⅳ,当气体总压强恒定为
,发生反应ⅰ和ⅳ,当气体总压强恒定为 时,平衡时各物质的物质的量分数如图所示,则
时,平衡时各物质的物质的量分数如图所示,则
_____ 0(填“>”,“<”或“=”); 的物质的量分数随温度升高而增大,原因是
的物质的量分数随温度升高而增大,原因是_____ 。
Ⅱ.工业上,可以用 还原
还原 ,发生反应
,发生反应
 。
。
(4)从反应进行程度上考虑,有利于生成 的条件是
的条件是_____ (填字母)。
a.高温高压 b.低温高压 c.高温低压 d.低温低压
(5)容积均为 的甲、乙反应器中都充入
的甲、乙反应器中都充入 和
和 ,发生上述反应。测得
,发生上述反应。测得 的物质的量与反应时间的关系如图所示:
的物质的量与反应时间的关系如图所示:_____ 。甲条件下平衡常数
_____ 。
Ⅲ.“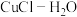 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阴极发生的电极反应为
。电解时阴极发生的电极反应为_____ 。
Ⅰ.以
 和
和 为原料生产甲醇的一种途径涉及的反应有:
为原料生产甲醇的一种途径涉及的反应有:ⅰ.

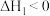
ⅱ.

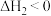
ⅲ.
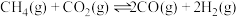
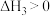
(1)关于反应ⅰ,下列描述正确的是
A.恒压条件下达到平衡状态时,再充入少量氦气,正逆反应速率不变
B.恒容条件下,混合气体的平均摩尔质量不变时反应达到平衡
C.恒压条件下,混合气体的密度不变时反应达到平衡
D.断裂
 键的同时断裂
键的同时断裂 键,则该反应达到平衡
键,则该反应达到平衡E.在恒容容器中通入
 和
和 ,当
,当 的体积分数不变时,则该反应达到平衡
的体积分数不变时,则该反应达到平衡F.该反应达到平衡状态时,其他条件不变,升温,反应逆向移动,则该反应的正反应速率减小,逆反应速率增大
(2)若某反应的平衡常数表达式为
 ,根据反应ⅰ~ⅲ,写出该反应的热化学方程式:
,根据反应ⅰ~ⅲ,写出该反应的热化学方程式:(3)工业中,对于反应ⅰ,通常同时存在副反应ⅳ:
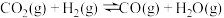
 。
。
 和
和 ,发生反应ⅰ和ⅳ,当气体总压强恒定为
,发生反应ⅰ和ⅳ,当气体总压强恒定为 时,平衡时各物质的物质的量分数如图所示,则
时,平衡时各物质的物质的量分数如图所示,则
 的物质的量分数随温度升高而增大,原因是
的物质的量分数随温度升高而增大,原因是Ⅱ.工业上,可以用
 还原
还原 ,发生反应
,发生反应
 。
。(4)从反应进行程度上考虑,有利于生成
 的条件是
的条件是a.高温高压 b.低温高压 c.高温低压 d.低温低压
(5)容积均为
 的甲、乙反应器中都充入
的甲、乙反应器中都充入 和
和 ,发生上述反应。测得
,发生上述反应。测得 的物质的量与反应时间的关系如图所示:
的物质的量与反应时间的关系如图所示: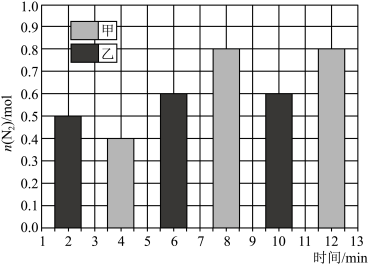

Ⅲ.“
 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中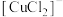 转化为
转化为 。电解时阴极发生的电极反应为
。电解时阴极发生的电极反应为
您最近一年使用:0次
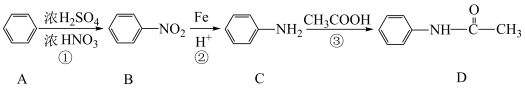
7 . 现代有机合成能制备自然界中存在的天然有机物,还能根据人类需求创造自然界中不存在的新物质,满足医药、生命科学等领域的需求,对人类健康具有积极意义。
Ⅰ.物质D俗称“退热冰”,实验室合成路线如下:_____ ;为了确定D中官能团的种类,可采用的方法是_____ (填字母)。
A.红外光谱 B.质谱法 C.原子吸收光谱 D.核磁共振氢谱
(2)写出反应①的化学方程式:_____ 。
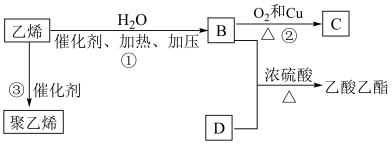
Ⅱ.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
已知乙烯能发生如图转化:_____ 。
(4)乙烯的电子式为_____ 。
(5)请写出B→C的化学方程式:_____ 。
(6)从B、D中分离得到乙酸乙酯所需的试剂和方法分别为_____ 和_____ 。
Ⅰ.物质D俗称“退热冰”,实验室合成路线如下:
A.红外光谱 B.质谱法 C.原子吸收光谱 D.核磁共振氢谱
(2)写出反应①的化学方程式:
Ⅱ.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
已知乙烯能发生如图转化:
(4)乙烯的电子式为
(5)请写出B→C的化学方程式:
(6)从B、D中分离得到乙酸乙酯所需的试剂和方法分别为
您最近一年使用:0次
解题方法
8 . 高压氢还原法可直接从溶液中提取金属粉。以硫化铜(CuS)精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下: 如下表所示:
如下表所示:
请回答下列问题:
(1)“浸取”时能提高反应速率的措施有_____ (答一条即可)。
(2)“浸取”时增大 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:_____ 。
(3)固体 的主要成分是
的主要成分是 和
和_____ (填化学式)。
(4)利用上述表格数据,计算 的
的
_____ 。
(5)“中和调 ”应控制的
”应控制的 范围是
范围是_____ 。
(6)“还原”中发生反应的离子方程式为_____ 。
(7)金属 为
为_____ 。

 如下表所示:
如下表所示:| 物质 |  |  |  |
开始沉淀 的 的 | 2.2 | 5.2 | 6.7 |
沉淀完全 的 的 | 3.2 | 6.7 | 8.2 |
(1)“浸取”时能提高反应速率的措施有
(2)“浸取”时增大
 压强可促进
压强可促进 的浸出,从沉淀溶解平衡角度进行解释:
的浸出,从沉淀溶解平衡角度进行解释:(3)固体
 的主要成分是
的主要成分是 和
和(4)利用上述表格数据,计算
 的
的
(5)“中和调
 ”应控制的
”应控制的 范围是
范围是(6)“还原”中发生反应的离子方程式为
(7)金属
 为
为
您最近一年使用:0次
9 . 常温下,已知三种一元弱酸的相对强弱: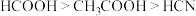 。在浓度均为
。在浓度均为 的
的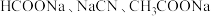 的混合溶液中,通入
的混合溶液中,通入 气体,随着
气体,随着 增大,溶液中的
增大,溶液中的 与
与 (
( 代表三种酸根离子,
代表三种酸根离子, 表示三种弱酸)的分布系数
表示三种弱酸)的分布系数 (平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
(平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
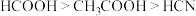 。在浓度均为
。在浓度均为 的
的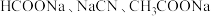 的混合溶液中,通入
的混合溶液中,通入 气体,随着
气体,随着 增大,溶液中的
增大,溶液中的 与
与 (
( 代表三种酸根离子,
代表三种酸根离子, 表示三种弱酸)的分布系数
表示三种弱酸)的分布系数 (平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
(平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
A. 的电离常数 的电离常数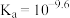 |
B.反应 的平衡常数 的平衡常数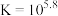 |
C.交点 处的 处的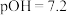 |
D.原混合溶液中: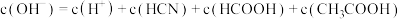 |
您最近一年使用:0次
解题方法
10 . 已知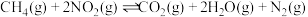
 。在
。在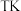 时,向恒容密闭容器中充入
时,向恒容密闭容器中充入 和
和 发生上述反应,起始时测得总压强为
发生上述反应,起始时测得总压强为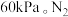 分压与时间关系如图所示。其中,
分压与时间关系如图所示。其中, 为以平衡分压代替平衡浓度表示的平衡常数,分压
为以平衡分压代替平衡浓度表示的平衡常数,分压 总压
总压 物质的量分数。下列说法中错误的是
物质的量分数。下列说法中错误的是
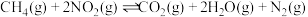
 。在
。在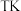 时,向恒容密闭容器中充入
时,向恒容密闭容器中充入 和
和 发生上述反应,起始时测得总压强为
发生上述反应,起始时测得总压强为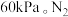 分压与时间关系如图所示。其中,
分压与时间关系如图所示。其中, 为以平衡分压代替平衡浓度表示的平衡常数,分压
为以平衡分压代替平衡浓度表示的平衡常数,分压 总压
总压 物质的量分数。下列说法中错误的是
物质的量分数。下列说法中错误的是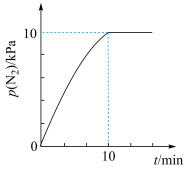
A. 用 用 分压变化表示的速率为 分压变化表示的速率为 |
B.该温度下平衡常数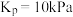 |
C.若改为绝热体系进行,则平衡后 转化率增大 转化率增大 |
D. 时,单位时间内 时,单位时间内 键断裂数目与 键断裂数目与 键形成数目相等 键形成数目相等 |
您最近一年使用:0次



