1 . 我国长征系列运载火箭的第一、第二级发动机,使用的燃料是偏二甲肼( )和四氧化二氮(
)和四氧化二氮( ),燃烧产物绿色无污染。燃烧的化学反应方程式:
),燃烧产物绿色无污染。燃烧的化学反应方程式: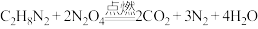 。
。
(1)上述反应中,氧化剂是___________ ;若有30g的 参加反应,需要
参加反应,需要 的物质的量为
的物质的量为___________ mol。
(2) 为
为___________ 色气体。若用 代替
代替 也能与
也能与 发生类似的反应,写出该反应的化学方程式:
发生类似的反应,写出该反应的化学方程式:___________ 。
 )和四氧化二氮(
)和四氧化二氮( ),燃烧产物绿色无污染。燃烧的化学反应方程式:
),燃烧产物绿色无污染。燃烧的化学反应方程式: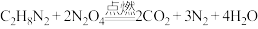 。
。(1)上述反应中,氧化剂是
 参加反应,需要
参加反应,需要 的物质的量为
的物质的量为(2)
 为
为 代替
代替 也能与
也能与 发生类似的反应,写出该反应的化学方程式:
发生类似的反应,写出该反应的化学方程式:
您最近一年使用:0次
2 . 以软锰矿浆(含 及少量
及少量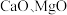 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿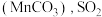 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 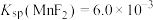 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入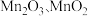 等,其原因是
等,其原因是_______ 。
 及少量
及少量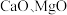 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是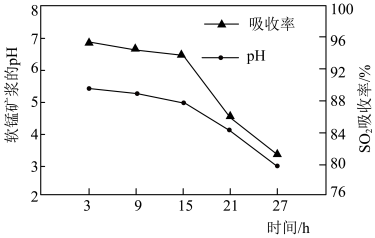
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿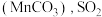 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 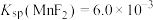 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为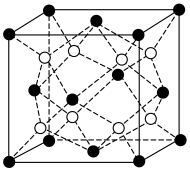
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入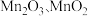 等,其原因是
等,其原因是
您最近一年使用:0次
7日内更新
|
242次组卷
|
2卷引用:福建省泉州中远学校2024届高三下学期5月模拟化学试题
3 . 利用物质的性质能帮助我们开展科学探究。
(1)判断化学变化。如图,在稀盐酸和氢氧化钠溶液中分别滴加几滴无色酚酞溶液,观察到能使无色酚酞变红的物质是___________ 。
实验结论:稀盐酸和氢氧化钠溶液反应的化学方程式为___________ 。
(1)判断化学变化。如图,在稀盐酸和氢氧化钠溶液中分别滴加几滴无色酚酞溶液,观察到能使无色酚酞变红的物质是

| 编号 | 实验操作 | 实验现象 | 实验分析 |
| 实验一 | 取一定量稀盐酸于小烧杯中,加入氢氧化钠溶液 | 无明显现象 | 稀盐酸与氢氧化钠溶液混合后有新物质生成 |
| 实验二 | 取实验一所得溶液少量于试管中,滴入几滴无色酚酞溶液 | 无明显现象 | |
| 实验三 | 取实验一所得溶液少量, |
您最近一年使用:0次
4 . 化学与生产生活密切相关,回答下列问题:
(1)在我市新农村建设中,许多家庭兴建了沼气池。沼气的主要成分是___________ 。
(2)6000L氧气在加压的情况下可装入容积为40L的钢瓶中,原因是___________ 。
(3)许多矿石中含有铁元素,菱铁矿的主要成分是FeCO3,其中铁元素的化合价是___________ 。
(4)大米的主要成分是淀粉,淀粉属于六大基本营养素中的___________ 。
(1)在我市新农村建设中,许多家庭兴建了沼气池。沼气的主要成分是
(2)6000L氧气在加压的情况下可装入容积为40L的钢瓶中,原因是
(3)许多矿石中含有铁元素,菱铁矿的主要成分是FeCO3,其中铁元素的化合价是
(4)大米的主要成分是淀粉,淀粉属于六大基本营养素中的
您最近一年使用:0次
5 . Ⅰ.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出CCl4层由紫色变成无色(生成HIO3)的化学反应方程式___________ 。
(2)KI在整个过程中作___________ 剂(填“氧化”或“还原”)。
(3)把KI换成KBr,则CCl4层先变为___________ 色,继续滴加氯水,CCl4层的颜色没有变化,Cl2、HIO3、HBrO3氧化性由强到弱的顺序是___________ 。
Ⅱ.实验室中药品的保存和实验的安全至关重要,药品的正确保存和实验的规范操作是进行科学实验的基础。
(4)氢氧化钠的保存不能用玻璃塞,原因是(用化学反应方程式表示)___________ 。
(5)Na2SiO3的水溶液俗称水玻璃,在空气中久置后会产生白色胶状沉淀,原因是(用化学反应 方程式表示)___________ 。
(6)实验员小张想要熔融NaOH,他应选用的仪器是___________(填序号)。
(1)写出CCl4层由紫色变成无色(生成HIO3)的化学反应方程式
(2)KI在整个过程中作
(3)把KI换成KBr,则CCl4层先变为
Ⅱ.实验室中药品的保存和实验的安全至关重要,药品的正确保存和实验的规范操作是进行科学实验的基础。
(4)氢氧化钠的保存不能用玻璃塞,原因是(用化学反应方程式表示)
(5)Na2SiO3的水溶液俗称水玻璃,在空气中久置后会产生白色胶状沉淀,原因是(用化学反应 方程式表示)
(6)实验员小张想要熔融NaOH,他应选用的仪器是___________(填序号)。
| A.蒸发皿 | B.铁坩埚 | C.氧化铝坩埚 | D.石英坩埚 |
您最近一年使用:0次
6 . 化学与人类生产、生活密切相关,利用所学知识进行填空(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)下列物质能导电且属于电解质的是___________(填字母)。
(2)NaH可在野外作生氢剂,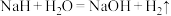 ,该反应中氧化产物和还原产物的质量比为
,该反应中氧化产物和还原产物的质量比为___________ 。
(3)标准状况下,44.8L 对应的物质的量是
对应的物质的量是___________ ,含有的化学键类型为___________ 键(填共价键或离子键)。 电子式为:
电子式为:___________ ,CaF2的电子式为:___________ 。
(4)氮的氧化物是大气污染的主要污染物之一,对人类危害很大,每天行驶的汽车排放的尾气中就含有大量的氮氧化物。标准状况下,将盛满二氧化氮的大试管倒扣在盛水的水槽中,充分吸收后,其反应的的化学方程式是___________ ,试管内溶液的物质的量浓度是___________ 。
 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(1)下列物质能导电且属于电解质的是___________(填字母)。
| A.氯化钠固体 | B.熔融的氯化钠 | C.氯化钠溶液 | D.钠 |
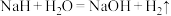 ,该反应中氧化产物和还原产物的质量比为
,该反应中氧化产物和还原产物的质量比为(3)标准状况下,44.8L
 对应的物质的量是
对应的物质的量是 电子式为:
电子式为:(4)氮的氧化物是大气污染的主要污染物之一,对人类危害很大,每天行驶的汽车排放的尾气中就含有大量的氮氧化物。标准状况下,将盛满二氧化氮的大试管倒扣在盛水的水槽中,充分吸收后,其反应的的化学方程式是
您最近一年使用:0次
名校
7 . 铜及其化合物在生产生活有广泛应用,铜在化合物中的常见化合价有+1、+2.已知 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
(1)工业上可用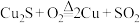 反应制取粗铜,该反应中
反应制取粗铜,该反应中___________ 元素被还原。不考虑杂质的反应,理论上生成1mol的 电子转移的数目为
电子转移的数目为___________
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为___________ 。温度控制在50~60℃的原因除了加快反应速率外,还有___________ 。在 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:___________ 。
(3)现向Cu、 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为___________ 。若将上述混合物用足量的 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为___________ g。若上述混合物中含0.2mol Cu,将该混合物与稀硫酸充分反应,消耗 的物质的量为
的物质的量为___________ mol。
 与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。
与稀硫酸反应,溶液呈蓝色并有紫红色固体析出。(1)工业上可用
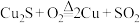 反应制取粗铜,该反应中
反应制取粗铜,该反应中 电子转移的数目为
电子转移的数目为(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入
 溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为
溶液,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为 溶液中加入一定量的
溶液中加入一定量的 和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:
和NaCl溶液,加热,生成CuCl沉淀,写出生成CuCl的离子方程式:(3)现向Cu、
 和CuO组成的混合物中,加入2L 0.6
和CuO组成的混合物中,加入2L 0.6
 溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。
溶液恰好使混合物溶解,同时收集到4480mL NO气体(标准状况)。 跟稀硝酸反应的离子方程式为
跟稀硝酸反应的离子方程式为 加热还原,所得到固体的质量为
加热还原,所得到固体的质量为 的物质的量为
的物质的量为
您最近一年使用:0次
8 . 回答下列问题:
(1)含有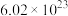 个氢原子的
个氢原子的 的物质的量是
的物质的量是___________ 。
(2)25℃ 条件下,同质量的
条件下,同质量的 和
和 气体的体积之比是
气体的体积之比是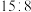 ,则
,则 的相对分子质量为
的相对分子质量为___________ 。
(3)两个相同容积的密闭容器 ,在25℃下,
,在25℃下, 中充入
中充入 气体,Y中充入
气体,Y中充入 气体,
气体, 与
与 内的压强之比是
内的压强之比是 ,则A的摩尔质量为
,则A的摩尔质量为___________ 。
(4)相同条件下,体积比为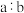 的
的 和
和 的混合气体,其平均摩尔质量是
的混合气体,其平均摩尔质量是___________ 。
(1)含有
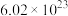 个氢原子的
个氢原子的 的物质的量是
的物质的量是(2)25℃
 条件下,同质量的
条件下,同质量的 和
和 气体的体积之比是
气体的体积之比是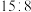 ,则
,则 的相对分子质量为
的相对分子质量为(3)两个相同容积的密闭容器
 ,在25℃下,
,在25℃下, 中充入
中充入 气体,Y中充入
气体,Y中充入 气体,
气体, 与
与 内的压强之比是
内的压强之比是 ,则A的摩尔质量为
,则A的摩尔质量为(4)相同条件下,体积比为
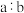 的
的 和
和 的混合气体,其平均摩尔质量是
的混合气体,其平均摩尔质量是
您最近一年使用:0次
9 . 根据所学知识填空:
(1)___________  含有的氧原子数与
含有的氧原子数与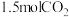 中含有的氧原子数相等。
中含有的氧原子数相等。
(2)标准状况下,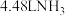 中N原子质量为
中N原子质量为___________ 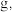 H原子数目为
H原子数目为___________ 。
(3)已知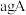 和
和 恰好完全反应生成
恰好完全反应生成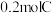 和
和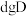 ,则C的摩尔质量为
,则C的摩尔质量为___________ (用含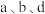 的表达式表示)。
的表达式表示)。
(4) 为阿伏加德罗常数,标准状况下,mg某气体中含有b个分子,则ng该气体在相同状态下的体积为
为阿伏加德罗常数,标准状况下,mg某气体中含有b个分子,则ng该气体在相同状态下的体积为___________  (用含
(用含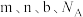 的表达式表示)。
的表达式表示)。
(1)
 含有的氧原子数与
含有的氧原子数与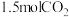 中含有的氧原子数相等。
中含有的氧原子数相等。(2)标准状况下,
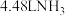 中N原子质量为
中N原子质量为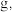 H原子数目为
H原子数目为(3)已知
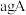 和
和 恰好完全反应生成
恰好完全反应生成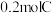 和
和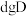 ,则C的摩尔质量为
,则C的摩尔质量为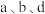 的表达式表示)。
的表达式表示)。(4)
 为阿伏加德罗常数,标准状况下,mg某气体中含有b个分子,则ng该气体在相同状态下的体积为
为阿伏加德罗常数,标准状况下,mg某气体中含有b个分子,则ng该气体在相同状态下的体积为 (用含
(用含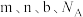 的表达式表示)。
的表达式表示)。
您最近一年使用:0次
10 . 铁及其化合物与生产、生活关系密切:
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
(2) 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式_______ 。向反应后的溶液加入_______ (填名称),可回收Cu,并得到 溶液。
溶液。
(3)用废铁皮制取( )的部分流程示意图如下:
)的部分流程示意图如下:_______ 。
(4) 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为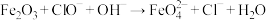 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5) 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是_______ 。当该反应转移1.2mol电子时,能产生_______ mol 。
。
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
A. | B. | C. | D. |
(2)
 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式 溶液。
溶液。(3)用废铁皮制取(
 )的部分流程示意图如下:
)的部分流程示意图如下: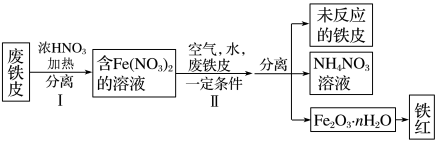
(4)
 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为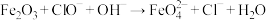 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(5)
 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是 。
。
您最近一年使用:0次
2024-05-03更新
|
138次组卷
|
2卷引用:福建省晋江市养正中学2023-2024学年高一下学期3月第一次月考化学试题



