1 . 一氧化二氯( )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:
实验室制备原理: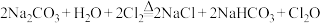
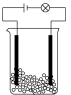
现用如图所示装置设计实验制备少量 ,并探究相关物质的性质。
,并探究相关物质的性质。

(1)装置A中仪器X的名称为________ ,写出装置A中的反应方程式________ 。
(2)若气体从左至右流动,则装置的连接顺序是A、________ 。(每个装置限用一次)
(3)装置F中盛装试剂的名称为________ 。装置E中无水氯化钙的作用________ 。
(4)装置中浓硫酸的作用________ 。写出 与
与 反应的离子方程式
反应的离子方程式________ 。
(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:________ 。
(6)已知 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式________ 。
 )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:物理性质 | 化学性质 |
常温下, |
|
现用如图所示装置设计实验制备少量
 ,并探究相关物质的性质。
,并探究相关物质的性质。
(1)装置A中仪器X的名称为
(2)若气体从左至右流动,则装置的连接顺序是A、
(3)装置F中盛装试剂的名称为
(4)装置中浓硫酸的作用
 与
与 反应的离子方程式
反应的离子方程式(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:
(6)已知
 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式
您最近一年使用:0次
名校
2 . 活性氧化锌(ZnO)常用于医药、涂料、陶瓷等。某科研小组以锌废料(主要成分是ZnSO4和ZnO,含少量的Fe、Cu、Pb、As等元素以及油污)为原料制备活性氧化锌及回收其他金属元素,流程如图。
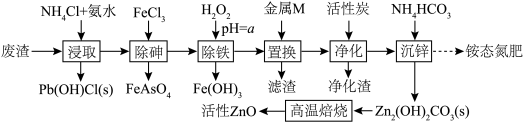
已知几种金属离子生成氢氧化物的pH如下表:
回答下列问题:
(1)As的原子结构示意图为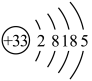 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为______ 价。
(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是______ 。
(3)a的范围为______ 。“除铁”时发生氧化还原反应的离子方程式为______ 。
(4)金属M的化学式为______ 。
(5)“沉锌”的滤液采用______ 、______ ,过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
(6)“高温焙烧”过程中发生反应的化学方程式为______ 。

已知几种金属离子生成氢氧化物的pH如下表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 3.7 |
| Zn2+ | 7.9 | 10.0 |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 7.4 | 9.4 |
(1)As的原子结构示意图为
 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是
(3)a的范围为
(4)金属M的化学式为
(5)“沉锌”的滤液采用
(6)“高温焙烧”过程中发生反应的化学方程式为
您最近一年使用:0次
2024-03-29更新
|
125次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
解题方法
3 . 四氯化钛( )是制取航天工业材料——钛合金的重要原料。实验室以
)是制取航天工业材料——钛合金的重要原料。实验室以 和
和 为原料制取液态
为原料制取液态 的装置如图所示(部分夹持装置省略)。
的装置如图所示(部分夹持装置省略)。
①反应原理: 。
。
②反应条件:无水、无氧,加热。
回答下列问题:
(1)所装稀硫酸的仪器名称为___________ 。装置C处用热水浴的目的是___________ 。
(2)若没有装置F,则装置E中产生白雾的原因是___________ 。
(3)实验开始时,缓慢滴入稀硫酸,能证明 已排尽装置中的空气的实验现象是
已排尽装置中的空气的实验现象是___________ 。
(4)从E处产物中分离出 的实验方法是
的实验方法是___________ 。
(5) 的电子式为
的电子式为___________ 。
(6) 还可由
还可由 、焦炭和氯气在加热条件下制得,生成体积比为2:1的
、焦炭和氯气在加热条件下制得,生成体积比为2:1的 和
和 混合气体,反应中氧化剂与还原剂的物质的量之比为4:3,反应的化学方程式为
混合气体,反应中氧化剂与还原剂的物质的量之比为4:3,反应的化学方程式为___________ 。
 )是制取航天工业材料——钛合金的重要原料。实验室以
)是制取航天工业材料——钛合金的重要原料。实验室以 和
和 为原料制取液态
为原料制取液态 的装置如图所示(部分夹持装置省略)。
的装置如图所示(部分夹持装置省略)。①反应原理:
 。
。②反应条件:无水、无氧,加热。

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
 | -23 | 76 | 与 互溶 互溶 |
 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)所装稀硫酸的仪器名称为
(2)若没有装置F,则装置E中产生白雾的原因是
(3)实验开始时,缓慢滴入稀硫酸,能证明
 已排尽装置中的空气的实验现象是
已排尽装置中的空气的实验现象是(4)从E处产物中分离出
 的实验方法是
的实验方法是(5)
 的电子式为
的电子式为(6)
 还可由
还可由 、焦炭和氯气在加热条件下制得,生成体积比为2:1的
、焦炭和氯气在加热条件下制得,生成体积比为2:1的 和
和 混合气体,反应中氧化剂与还原剂的物质的量之比为4:3,反应的化学方程式为
混合气体,反应中氧化剂与还原剂的物质的量之比为4:3,反应的化学方程式为
您最近一年使用:0次
2024-01-10更新
|
55次组卷
|
2卷引用:西藏林芝市2023-2024学年高三上学期期末考试化学试题
4 . 实验兴趣小组为探究电解质的导电性做了如下实验。根据所学知识回答下列问题:
(1)实验一:灯泡________ ;(填“发光”或“不发光”,下同);实验二:灯泡________ 。
(2)干燥的KNO3固体、NaCl固体、蒸馏水都___________ ;(填“导电”或“不导电”)但是KNO3溶液、NaCl溶液却能够 ___________ 。(填“导电”或“不导电”)
| 实验操作 | 实验一:向三个烧杯中分别加入硝KNO3固体、NaCl固体和蒸馏水。按照右图所示连接装置,将石墨电极伸入到烧杯中,观察并记录现象 实验二:将少量KNO3固体和NaCl固体加入盛有水的烧杯中,搅拌使其完全溶解转化为相应的溶液,重复上述的实验,观察并记录现象 |
|
| 实验现象 | 实验一:灯泡___________;(填“发光”或“不发光”) 实验二:灯泡___________。(填“发光”或“不发光”) | |
| 实验结论 | 干燥的KNO3固体、NaCl固体、蒸馏水都___________;(填“导电”或“不导电”)但是KNO3溶液、NaCl溶液却能够 ___________ 。(填“导电”或“不导电”) | |
(1)实验一:灯泡
(2)干燥的KNO3固体、NaCl固体、蒸馏水都
您最近一年使用:0次
解题方法
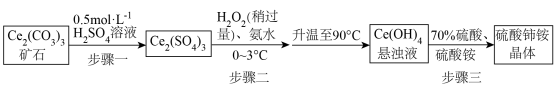
5 . 硫酸铈铵 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈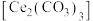 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①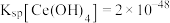 。
。
②硫酸铈铵的熔点为 ,沸点为
,沸点为 。
。
回答下列问题:
(1)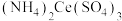 中铈元素的化合价为
中铈元素的化合价为_______ 。
(2)步骤一中,先将
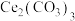 矿石粉碎,目的是
矿石粉碎,目的是_______ 。
(3)步骤二中,反应温度需要控制在
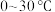 ,原因是
,原因是_______ 。反应完全后,要将混合物升温至
 ,目的是
,目的是_______ 。
(4)步骤二中,
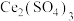 与
与
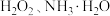 反应生成
反应生成
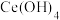 的化学方程式为
的化学方程式为_______ 。
(5)步骤三反应完全后的溶液经_______ 、_______ 、过滤,得到晶体。最后用_______ 洗涤
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。
(6)若最初称取一定量的碳酸铈矿石,其中含
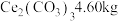 ,经该工艺流程最终获得
,经该工艺流程最终获得
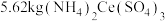 晶体,则
晶体,则
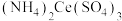 的产率为
的产率为_______ (保留三位有效数字)。
 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈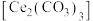 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①
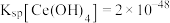 。
。②硫酸铈铵的熔点为
 ,沸点为
,沸点为 。
。回答下列问题:
(1)
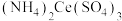 中铈元素的化合价为
中铈元素的化合价为(2)步骤一中,先将
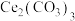 矿石粉碎,目的是
矿石粉碎,目的是(3)步骤二中,反应温度需要控制在
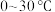 ,原因是
,原因是 ,目的是
,目的是(4)步骤二中,
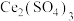 与
与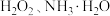 反应生成
反应生成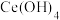 的化学方程式为
的化学方程式为(5)步骤三反应完全后的溶液经
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。(6)若最初称取一定量的碳酸铈矿石,其中含
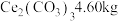 ,经该工艺流程最终获得
,经该工艺流程最终获得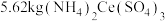 晶体,则
晶体,则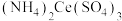 的产率为
的产率为
您最近一年使用:0次
2023-10-29更新
|
751次组卷
|
4卷引用:西藏林芝市2023-2024学年高三上学期期末考试化学试题
西藏林芝市2023-2024学年高三上学期期末考试化学试题广西北海市2024届高三一模考试化学试题甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
6 . 乙烯的产量可以用来衡量一个国家的石油化工发展水平,A和B是生活中两种常见的有机物,C是一种具有香味的物质,且碳原子数是A的两倍。现以乙烯为主要原料合成C,其合成路线如图所示,请回答下列问题:
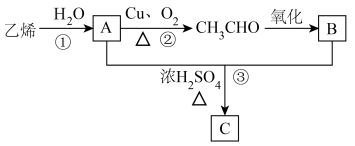
(1)乙烯的结构简式:______ 。
(2)A分子中含有的官能团名称为______ 。
(3)②的反应类型为______ ,③的反应类型为______ 。
(4)写出反应①的化学方程式_______ 。

(1)乙烯的结构简式:
(2)A分子中含有的官能团名称为
(3)②的反应类型为
(4)写出反应①的化学方程式
您最近一年使用:0次
解题方法
7 . 北京冬奥会将于2022年举行.如图所示,“五环”中相交两环中的物质间能够发生化学反应,其中A、B、C、D分别是NaOH、Fe、CuO、CuCl2中的一种,C溶液能使紫色石蕊溶液变蓝。

(1)C的化学式是_______ 。
(2)写出B与C反应的化学方程式:________ ;A与B的反应属于_______ (填基本反应类型)。

(1)C的化学式是
(2)写出B与C反应的化学方程式:
您最近一年使用:0次
名校
解题方法
8 .  是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
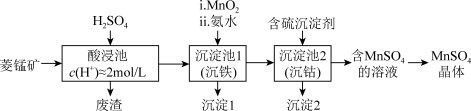
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括 、
、 、
、_______ 。
(2)沉淀池1中,先加 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:_______ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
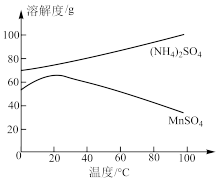
(4)图为 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为_______ 、洗涤、干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。
iii.加入指示剂,用b mol/L 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。
①补全步骤ⅱ中反应的离子方程式:_______ 。
 +
+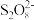 +_______
+_______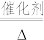
 +_______+_______
+_______+_______
②废渣中锰元素的质量分数为_______ 。
 是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
 、
、 、
、(2)沉淀池1中,先加
 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为
 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成
 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。iii.加入指示剂,用b mol/L
 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。①补全步骤ⅱ中反应的离子方程式:
 +
+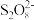 +_______
+_______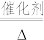
 +_______+_______
+_______+_______②废渣中锰元素的质量分数为
您最近一年使用:0次
2023-04-15更新
|
265次组卷
|
3卷引用:西藏自治区林芝市第二高级中学2023-2024学年高三上学期第三次月考理科综合试题
解题方法
9 . 高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I.已知:①MnO2(s)=Mn(s)+O2(g) ∆H=+520kJ· mol -1
②S(s)+O2(g)=SO2(g) ∆H=-297kJ· mol -1
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ∆H=-1065kJ· mol -1
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的∆H=_________ kJ· mol -1。
II.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO +CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
(2)反应①中,氧化剂与还原剂的物质的量之比为_________ ,反应②转移电子0.6 mol时,生成的气体在标准状况下体积为_________ L。
III.KMnO4是一种常用消毒剂。
(3)其消毒机理与下列物质相似的是_________(填序号)。
(4)其消毒效率(用单位质量转移的电子数表示)是NaClO的_________ 倍(保留两位小数)。
(5)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL 0.1000 mol•L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和_________ 。
②取某KMnO4产品0.7000 g溶于水,并加入_________ 进行酸化。
A.稀盐酸 B.稀硫酸 C.硝酸 D.次氯酸
③将②所得溶液用0.1000 mol•L-1标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积。重复步骤②、③,三次平行实验数据如表:
(有关离子方程式为:MnO +S2O
+S2O +H+→SO
+H+→SO +Mn2++H2O,未配平)
+Mn2++H2O,未配平)
计算该KMnO4产品的纯度为_________ 。(保留三个有效数字)
I.已知:①MnO2(s)=Mn(s)+O2(g) ∆H=+520kJ· mol -1
②S(s)+O2(g)=SO2(g) ∆H=-297kJ· mol -1
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ∆H=-1065kJ· mol -1
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的∆H=
II.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO
 +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)②MnO
 +CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)(2)反应①中,氧化剂与还原剂的物质的量之比为
III.KMnO4是一种常用消毒剂。
(3)其消毒机理与下列物质相似的是_________(填序号)。
| A.双氧水 | B.消毒酒精(75%) |
| C.肥皂水 | D.84消毒液(NaClO溶液) |
(5)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL 0.1000 mol•L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和
②取某KMnO4产品0.7000 g溶于水,并加入
A.稀盐酸 B.稀硫酸 C.硝酸 D.次氯酸
③将②所得溶液用0.1000 mol•L-1标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积。重复步骤②、③,三次平行实验数据如表:
实验次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液体积/mL | 19.30 | 20.98 | 21.02 |
 +S2O
+S2O +H+→SO
+H+→SO +Mn2++H2O,未配平)
+Mn2++H2O,未配平)计算该KMnO4产品的纯度为
您最近一年使用:0次
10 . 下图是CO还原CuO的装置图:
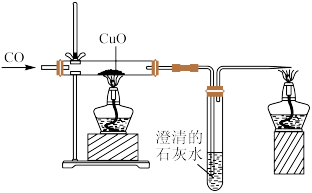
(1)需要先通一会一氧化碳,为了先_______ ,防止一氧化碳纯度不够而爆炸,通一会一氧化碳之后再加热。结束时,先撤掉_______ ,继续通一会一氧化碳,直到玻璃管冷却,防止生成的铜又被氧化,一氧化碳_______ (填“有”或“没有”)毒,加强通风换气,这里通入的气体必须处理掉,用点燃或者小气球收集;
(2)如果用点燃的方法处理多余的CO,化学方程式是_______ ,产物_______ (填“是”或“不是”)温室效应的气体之一,其固体俗称_______ ;
(3)生活中冶炼金属(还原金属氧化物)除常用CO外,还有H2和C等,从经济型和实用型考虑:
①首饰加工店你建议用_______ ,(选填“CO”、“H2或” 或“C”);
②农村打铁铺你建议用_______ ,(选填“CO”、“H2或” 或“C”);
(4)CO还原CuO反应的化学方程式CO+CuO Cu+CO2中,氧化剂是:
Cu+CO2中,氧化剂是:_______ ,还原剂是:_______ ,氧化产物是:_______ ,还原产物是:_______ 。

(1)需要先通一会一氧化碳,为了先
(2)如果用点燃的方法处理多余的CO,化学方程式是
(3)生活中冶炼金属(还原金属氧化物)除常用CO外,还有H2和C等,从经济型和实用型考虑:
①首饰加工店你建议用
②农村打铁铺你建议用
(4)CO还原CuO反应的化学方程式CO+CuO
 Cu+CO2中,氧化剂是:
Cu+CO2中,氧化剂是:
您最近一年使用:0次