名校
解题方法
1 . 亚硝酸钙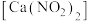 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应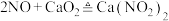 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质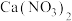 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: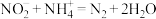 ;“还原
;“还原 ”时加入
”时加入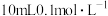 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
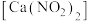 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应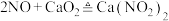 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。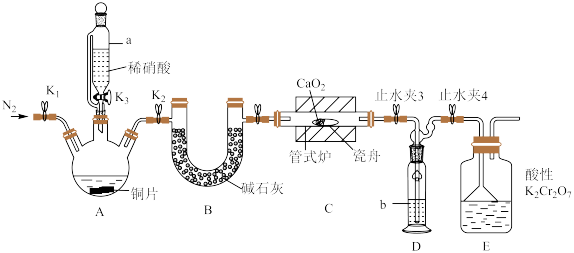
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质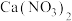 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: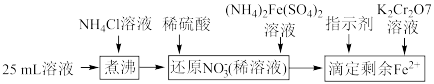
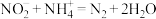 ;“还原
;“还原 ”时加入
”时加入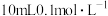 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
今日更新
|
242次组卷
|
6卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
名校
解题方法
2 . 高砷烟尘(主要成分有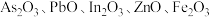 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为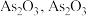 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过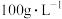 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为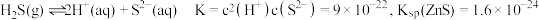 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的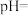
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用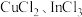 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
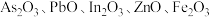 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: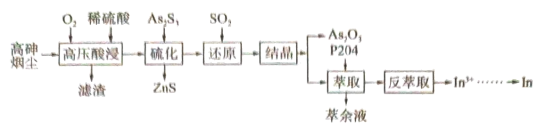
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为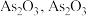 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过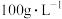 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为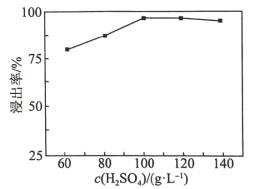
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为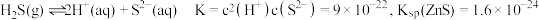 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的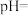
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用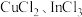 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
今日更新
|
139次组卷
|
4卷引用:广东省梅州市部分学校2024届高三下学期5月联考化学试卷
3 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL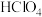 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL 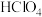 、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用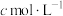 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成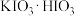 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有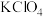 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
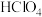 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL 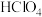 、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用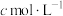 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)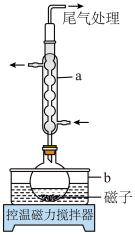
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
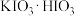 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
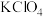 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近一年使用:0次
7日内更新
|
176次组卷
|
3卷引用:2024届河南省九师联盟2023-2024学年高三下学期4月联考理综试题-高中化学
4 . 以银锰精矿(主要含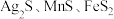 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银、锰及
)为原料联合提取银、锰及 的一种流程示意图如下:
的一种流程示意图如下: 的氧化性强于
的氧化性强于 。
。
(1)“浸锰渣”含有S和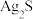 ,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:
,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:_______ 。
(2)“除杂”时,若溶液中 ,欲使溶液中
,欲使溶液中 浓度小于
浓度小于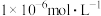 ,需控制的
,需控制的 范围为
范围为_______ (已知:室温下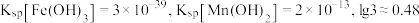 )。
)。
(3)沉锰过程在 为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在
为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在 左右达最大的原因是
左右达最大的原因是_______ 。 晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。_______  (用含有a、b及
(用含有a、b及 的代数式表示)。
的代数式表示)。
(5)“浸银”时,使用过量 和
和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以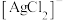 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式:_______ 。“沉银”过程中需要过量的铁粉作为还原剂,“沉银”后的滤液中,主要含有的阳离子有_______ 。
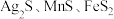 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银、锰及
)为原料联合提取银、锰及 的一种流程示意图如下:
的一种流程示意图如下: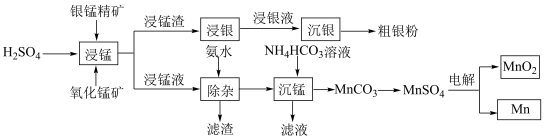
 的氧化性强于
的氧化性强于 。
。(1)“浸锰渣”含有S和
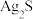 ,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:
,写出“浸锰”过程中,二氧化锰和硫化锰反应的化学方程式:(2)“除杂”时,若溶液中
 ,欲使溶液中
,欲使溶液中 浓度小于
浓度小于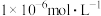 ,需控制的
,需控制的 范围为
范围为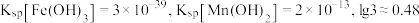 )。
)。(3)沉锰过程在
 为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在
为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。沉锰反应中,锰沉淀率在 左右达最大的原因是
左右达最大的原因是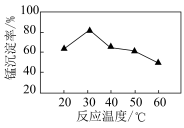
 晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
晶体的晶胞示意图如图1,晶胞的俯视图和正视图如图2。
①图1中“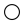 ”代表的是
”代表的是 ”或“O”),对应图2中的
”或“O”),对应图2中的
 (用含有a、b及
(用含有a、b及 的代数式表示)。
的代数式表示)。(5)“浸银”时,使用过量
 和
和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以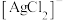 形式浸出并生成S。写出“浸银”反应的离子方程式:
形式浸出并生成S。写出“浸银”反应的离子方程式:
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
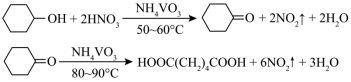
5 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:_______ 。步骤Ⅳ提纯方法的名称为_______ 。如图为1,6己二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为ρg·mL-1;该溶液的物质的量浓度为_______ 。
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:

| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近一年使用:0次
2024高三·全国·专题练习
6 . 以Fe(NO3)3作为铁源制备高铁酸钾(K2FeO4),可用于去除水体中的As( )。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
)。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
(1)制备高铁酸钾。
向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。
① 制备K2FeO4的化学方程式为___________ 。
② 过滤所得的滤液中加入稀硫酸产生Cl2,原因可能是酸性条件下K2FeO4氧化了Cl-,还可能是___________ 。
(2)测定 K2FeO4的纯度。
准确称取0.528 0 g K2FeO4样品置于锥形瓶中,用KOH溶液溶解,加入过量KCr(OH)4溶液,再加入硫酸酸化配成待测液,用0.3000 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准液20.00 mL,计算样品中K2FeO4的纯度___________ (写出计算过程)。
测定过程中涉及的离子反应有(未配平):Cr(OH) +FeO
+FeO →Fe(OH)3+CrO
→Fe(OH)3+CrO +OH-;CrO
+OH-;CrO +H+→Cr2O
+H+→Cr2O +H2O;Cr2O
+H2O;Cr2O +Fe2++H+→Cr3++Fe3++H2O。
+Fe2++H+→Cr3++Fe3++H2O。
(3)K2FeO4的应用。
某水样中As元素主要以As( )存在,As(
)存在,As( )可被K2FeO4氧化为As(
)可被K2FeO4氧化为As( ),再通过Fe(
),再通过Fe( )吸附去除。
)吸附去除。
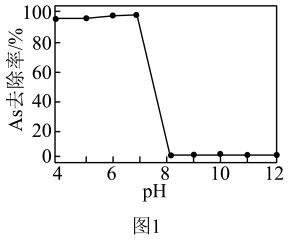
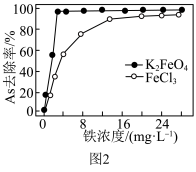
①K2FeO4对水中As元素的去除率随pH变化如图1所示,当pH大于7时,As去除率迅速下降的原因是___________ 。___________ 。 ,纳米铁还原废水中NO
,纳米铁还原废水中NO 的可能反应机理如图3所示。
的可能反应机理如图3所示。 的过程可描述为
的过程可描述为___________ 。
②经检验,污水经处理后,水体中NO 、NO
、NO 浓度很小,但水中总氮浓度下降不明显,原因是
浓度很小,但水中总氮浓度下降不明显,原因是___________ 。
 )。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
)。已知:K2FeO4微溶于水,在酸性或中性溶液中迅速氧化H2O产生O2,在碱性溶液中较稳定,在Fe3+和Fe(OH)3催化作用下发生分解。(1)制备高铁酸钾。
向KOH和KClO混合溶液中加入Fe(NO3)3,过滤得到K2FeO4固体。
① 制备K2FeO4的化学方程式为
② 过滤所得的滤液中加入稀硫酸产生Cl2,原因可能是酸性条件下K2FeO4氧化了Cl-,还可能是
(2)测定 K2FeO4的纯度。
准确称取0.528 0 g K2FeO4样品置于锥形瓶中,用KOH溶液溶解,加入过量KCr(OH)4溶液,再加入硫酸酸化配成待测液,用0.3000 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准液20.00 mL,计算样品中K2FeO4的纯度
测定过程中涉及的离子反应有(未配平):Cr(OH)
 +FeO
+FeO →Fe(OH)3+CrO
→Fe(OH)3+CrO +OH-;CrO
+OH-;CrO +H+→Cr2O
+H+→Cr2O +H2O;Cr2O
+H2O;Cr2O +Fe2++H+→Cr3++Fe3++H2O。
+Fe2++H+→Cr3++Fe3++H2O。(3)K2FeO4的应用。
某水样中As元素主要以As(
 )存在,As(
)存在,As( )可被K2FeO4氧化为As(
)可被K2FeO4氧化为As( ),再通过Fe(
),再通过Fe( )吸附去除。
)吸附去除。①K2FeO4对水中As元素的去除率随pH变化如图1所示,当pH大于7时,As去除率迅速下降的原因是
 ,纳米铁还原废水中NO
,纳米铁还原废水中NO 的可能反应机理如图3所示。
的可能反应机理如图3所示。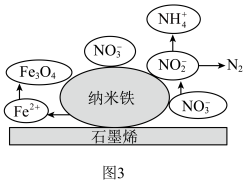
 的过程可描述为
的过程可描述为②经检验,污水经处理后,水体中NO
 、NO
、NO 浓度很小,但水中总氮浓度下降不明显,原因是
浓度很小,但水中总氮浓度下降不明显,原因是
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
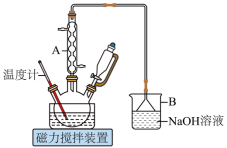
7 . 碳酸锰(MnCO3)是制造高性能磁性材料的主要原料。实验室以KMnO4为原料制备少量MnCO3并研究其性质,制备MnCO3的装置如图1所示。已知: MnCO3难溶于水、乙醇,100 ℃开始分解,在潮湿环境下易被氧化。
(1)选用仪器B、C的目的是___________ 。
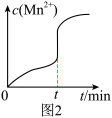
(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为___________ 。 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则t min时,c(Mn2+)迅速增大的原因是___________ 。___________ 。
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再___________ ,即得到干燥的MnCO3固体。用乙醇洗涤的优点是___________ 。
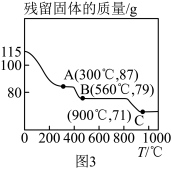
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为___________ (填化学式);B→C反应的化学方程式为___________ 。
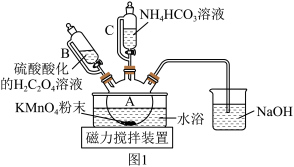
(1)选用仪器B、C的目的是
(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为
您最近一年使用:0次
2024高三·全国·专题练习
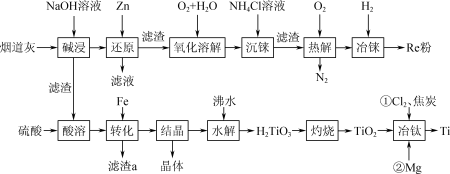
8 . 稀有金属元素铼(Re)和锰同族,铼和钛是航天工程不可缺少的材料。某烟道灰的主要成分为Re2O7、TiO2、SiO2、CuO、 Fe2O3,从中提取铼粉和钛的流程如图所示: 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO
被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO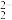 。
。
回答下列问题:
(1)“碱浸”过程Re2O7、SiO2分别发生反应的离子方程式为___________ 、___________ 。
(2)“氧化溶解”过程中Re(OH)4转化为ReO ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为___________ 。
(3)“酸溶”过程得到的钛在溶液中以TiO2+形式存在,其“水解”反应的离子方程式为___________ 。
(4)“转化”过程中加入Fe的作用是___________ ;所得晶体主要成分的化学式中含有7个结晶水,其化学式是___________ 。
(5)“冶钛”过程中将TiO2先转化为TiCl4,再用Mg进行还原,写出高温条件下用Mg还原TiCl4的化学方程式:___________ 。
 被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO
被Zn还原为+4价的铼。ZnO为两性氧化物,溶于碱生成ZnO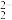 。
。回答下列问题:
(1)“碱浸”过程Re2O7、SiO2分别发生反应的离子方程式为
(2)“氧化溶解”过程中Re(OH)4转化为ReO
 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为(3)“酸溶”过程得到的钛在溶液中以TiO2+形式存在,其“水解”反应的离子方程式为
(4)“转化”过程中加入Fe的作用是
(5)“冶钛”过程中将TiO2先转化为TiCl4,再用Mg进行还原,写出高温条件下用Mg还原TiCl4的化学方程式:
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
9 . 废旧铅蓄电池的铅膏中主要含有 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为________ ,用沉淀溶解平衡原理解释选择 的原因
的原因________ 。
(2)在“脱硫”中,加入 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是________ 。
(3)在“酸浸”中,除加入醋酸(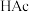 ),还要加入
),还要加入 。
。
(ⅰ)能被 氧化的离子是
氧化的离子是________ ;
(ⅱ) 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为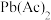 ,其化学方程式为
,其化学方程式为________ ;
(ⅲ) 也能使
也能使 转化为
转化为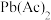 ,
, 的作用是
的作用是________ 。
 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。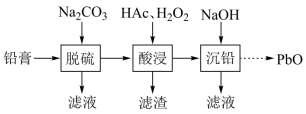
| 难溶电解质 |  | 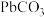 | 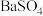 | 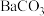 |
 | 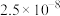 | 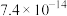 | 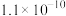 |  |
 如下表:
如下表:| 金属氢氧化物 |  |  | 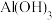 | 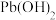 |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中
 转化反应的离子方程式为
转化反应的离子方程式为 的原因
的原因(2)在“脱硫”中,加入
 不能使铅膏中
不能使铅膏中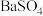 完全转化,原因是
完全转化,原因是(3)在“酸浸”中,除加入醋酸(
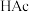 ),还要加入
),还要加入 。
。(ⅰ)能被
 氧化的离子是
氧化的离子是(ⅱ)
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为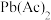 ,其化学方程式为
,其化学方程式为(ⅲ)
 也能使
也能使 转化为
转化为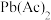 ,
, 的作用是
的作用是
您最近一年使用:0次
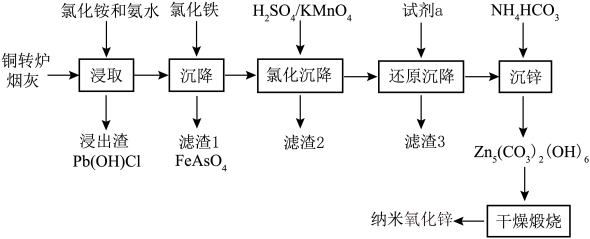
10 . 纳米氧化锌具有颗粒微小、比表面积大、分散性好、疏松多孔等物理特性和极强的化学活性,目前已广泛用于橡胶、陶瓷、催化剂、涂料和磁性材料的辅助生产。以铜转炉烟灰为原料,采用浸取、均相沉淀、干燥煅烧等工艺制备纳米氧化锌的工艺方法过程简单,生产成本低。具体流程如下:
铜转炉烟灰主要化学成分分析结果/%
以上金属元素在铜转炉烟灰中均以硫酸盐和氧化物形式存在,砷以砷酸盐形式存在。
流程中涉及离子的氢氧化物溶度积常数如下表:
请回答下列问题:
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃,浸出率随温度升高而降低的原因可能是___________ 。
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___________ 。
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是___________ ,缩短沉降时间。
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5,使还原产物为MnO2,滤渣2的主要成分为___________ (填化学式)。
(5)“还原沉降”选用的“试剂a”为___________ (填化学式)。
(6)“沉锌”反应的离子方程式为___________ 。
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整HCO 和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO
和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO 的浓度为
的浓度为___________ ,沉淀物的粒径最佳。
铜转炉烟灰主要化学成分分析结果/%
| Cu | Zn | Pb | Fe(Ⅱ) | As |
| 10.30 | 8.75 | 19.07 | 2.51 | 4.68 |
流程中涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Cu2+ | Zn2+ | Fe2+ | Fe3+ |
| Ksp | 2.2×10-20 | 6.7×10-17 | 8.0×10-16 | 4.0×10-38 |
(1)“浸取”温度应选择40℃左右为宜。温度高于40℃,浸出率随温度升高而降低的原因可能是
(2)若“浸取”所得滤液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为
(3)在“沉降”过程中,FeCl3作沉淀剂可起到两点作用,一是与砷酸根结合生成FeAsO4沉淀,二是
(4)用酸性高锰酸钾溶液“氧化沉降”时,需调整溶液pH=5,使还原产物为MnO2,滤渣2的主要成分为
(5)“还原沉降”选用的“试剂a”为
(6)“沉锌”反应的离子方程式为
(7)若想通过“干燥煅烧”得到更多活性较高的纳米氧化锌,应在“沉锌”时注意调整HCO
 和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO
和Zn2+的浓度,以保证最终沉淀物粒径在1μm以下,通过下表可判断,当Zn2+的浓度恒定在0.8mol·L-1时,HCO 的浓度为
的浓度为n(HCO )/n(Zn2+) )/n(Zn2+) | 粒度分布质量分数/% | ||||
| 0.0~0.1μm | 0.1~0.5μm | 0.5~1.0μm | 1.0~5.0μm | 5.0μm以上 | |
| 2 | 25.3 | 38.41 | 34.55 | 1.74 | 0.001 |
| 2.5 | 40.82 | 50.35 | 8.37 | 0.46 | 0.001 |
| 3 | 35.2 | 55.37 | 8.2 | 1.23 | 0.001 |
您最近一年使用:0次



