解题方法
1 . 钒是重要的战略资源,以硫酸工业产生的废钒催化剂(含 、
、 、
、 、
、 以及少量的
以及少量的 等)为原料,综合回收利用钒、硅、钾,实现变废为宝、保护环境的目的,回收工艺流程如下:
等)为原料,综合回收利用钒、硅、钾,实现变废为宝、保护环境的目的,回收工艺流程如下: 、
、 的形式存在,pH增大时
的形式存在,pH增大时 可转化为
可转化为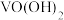 沉淀。
沉淀。
(1)基态V原子的价层电子排布式为___________ 。
(2)“水浸”前,通常需要将催化剂粉碎,其目的是___________ 。
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是___________ 。
②过程中除了有 被还原成
被还原成 ,
, 也被还原,写出
也被还原,写出 被还原的离子方程式:
被还原的离子方程式:___________ 。
(4)“萃取”时选择有机萃取剂,原理是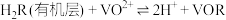 (有机层),“反萃取”应选择在
(有机层),“反萃取”应选择在___________ (填“酸性”“中性”或“碱性”)环境中进行。
(5)加氨水“沉钒”生成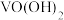 沉淀,若经“焙烧”得到1mol
沉淀,若经“焙烧”得到1mol 产品,则消耗空气中
产品,则消耗空气中
___________ mol。
(6) 常用作
常用作 转化为
转化为 反应的催化剂。
反应的催化剂。 分子的空间结构为
分子的空间结构为___________ 。 的三聚体环状结构如图所示,该结构中S—O键长大致分为两类,一类键长约为140pm,另一类键长约为160pm,较短的键为
的三聚体环状结构如图所示,该结构中S—O键长大致分为两类,一类键长约为140pm,另一类键长约为160pm,较短的键为___________ (填图中字母),该分子中含有___________ 个 键。
键。
 、
、 、
、 、
、 以及少量的
以及少量的 等)为原料,综合回收利用钒、硅、钾,实现变废为宝、保护环境的目的,回收工艺流程如下:
等)为原料,综合回收利用钒、硅、钾,实现变废为宝、保护环境的目的,回收工艺流程如下: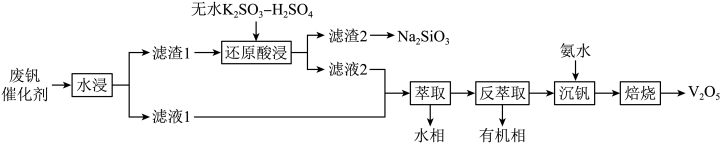
 、
、 的形式存在,pH增大时
的形式存在,pH增大时 可转化为
可转化为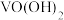 沉淀。
沉淀。(1)基态V原子的价层电子排布式为
(2)“水浸”前,通常需要将催化剂粉碎,其目的是
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是
②过程中除了有
 被还原成
被还原成 ,
, 也被还原,写出
也被还原,写出 被还原的离子方程式:
被还原的离子方程式:(4)“萃取”时选择有机萃取剂,原理是
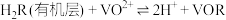 (有机层),“反萃取”应选择在
(有机层),“反萃取”应选择在(5)加氨水“沉钒”生成
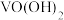 沉淀,若经“焙烧”得到1mol
沉淀,若经“焙烧”得到1mol 产品,则消耗空气中
产品,则消耗空气中
(6)
 常用作
常用作 转化为
转化为 反应的催化剂。
反应的催化剂。 分子的空间结构为
分子的空间结构为 的三聚体环状结构如图所示,该结构中S—O键长大致分为两类,一类键长约为140pm,另一类键长约为160pm,较短的键为
的三聚体环状结构如图所示,该结构中S—O键长大致分为两类,一类键长约为140pm,另一类键长约为160pm,较短的键为 键。
键。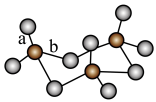
您最近一年使用:0次
2 . 氢化铝锂( )是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到
)是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到 晶体。
晶体。
(一)制备无水
已知 的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的
的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的 与铝粉反应制备无水
与铝粉反应制备无水 (夹持装置略去)。
(夹持装置略去)。___________ 。
(2)装置的连接顺序(从左至右)为A→___________ 。
(3)装置D的作用是___________ 。
(二)制备
①LiH、 均溶于乙醚,产品
均溶于乙醚,产品 难溶于苯,可溶于乙醚、四氢呋喃;
难溶于苯,可溶于乙醚、四氢呋喃;
②LiH、 在潮湿的空气中均会发生剧烈水解,释放大量
在潮湿的空气中均会发生剧烈水解,释放大量 ;
;
③乙醚,沸点34.5℃,易燃,易溶于苯等有机溶剂,一般不与金属单质反应。
(4)制取 的实验原理
的实验原理___________ (用化学方程式表示)。
(5)下列说法中正确的是___________。
(三)产品的纯度测定(不含LiH)
(6)实际生产中 的纯度是关键指标,常温常压下,称取a g
的纯度是关键指标,常温常压下,称取a g 样品,按图所示装置测定纯度,反应前量气管读数为
样品,按图所示装置测定纯度,反应前量气管读数为 mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为
mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为 mL。该装置中的量气管由
mL。该装置中的量气管由___________ (填“酸式”或“碱式”)滴定管改装,该样品纯度为___________ (用含a、 、
、 的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
 )是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到
)是有机合成的重要还原剂,实验中利用氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到 晶体。
晶体。(一)制备无水

已知
 的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的
的沸点为178℃,在潮湿的空气中易水解。某实验小组利用纯净的 与铝粉反应制备无水
与铝粉反应制备无水 (夹持装置略去)。
(夹持装置略去)。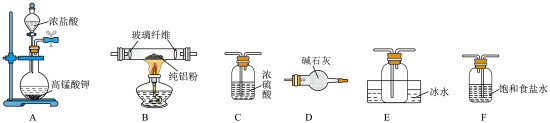
(2)装置的连接顺序(从左至右)为A→
(3)装置D的作用是
(二)制备


①LiH、
 均溶于乙醚,产品
均溶于乙醚,产品 难溶于苯,可溶于乙醚、四氢呋喃;
难溶于苯,可溶于乙醚、四氢呋喃;②LiH、
 在潮湿的空气中均会发生剧烈水解,释放大量
在潮湿的空气中均会发生剧烈水解,释放大量 ;
;③乙醚,沸点34.5℃,易燃,易溶于苯等有机溶剂,一般不与金属单质反应。
(4)制取
 的实验原理
的实验原理(5)下列说法中正确的是___________。
| A.市售乙醚中含少量水,可以利用金属钠或五氧化二磷除去 |
| B.滤渣A的主要成分是LiCl |
C.为提高合成 的速率,可将反应温度提高至40℃ 的速率,可将反应温度提高至40℃ |
| D.操作B可以在分液漏斗中进行,乙醚经回收提纯后可循环使用 |
(三)产品的纯度测定(不含LiH)
(6)实际生产中
 的纯度是关键指标,常温常压下,称取a g
的纯度是关键指标,常温常压下,称取a g 样品,按图所示装置测定纯度,反应前量气管读数为
样品,按图所示装置测定纯度,反应前量气管读数为 mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为
mL,倾斜Y形管,将足量蒸馏水(掺有四氢呋喃可减缓反应)注入样品中,反应完毕冷却后,量气管读数为 mL。该装置中的量气管由
mL。该装置中的量气管由 、
、 的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
的代数式表示)。(注:常温常压下气体摩尔体积约为24.5L/mol)
您最近一年使用:0次
名校
解题方法
3 . 丙炔酸乙酯(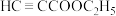 )是一种重要的有机化工原料和医药中间体。实验室制备少量丙炔酸乙酯的反应为:
)是一种重要的有机化工原料和医药中间体。实验室制备少量丙炔酸乙酯的反应为:

实验步骤如下:
Ⅰ.向三颈烧瓶中加入14.0g丙炔酸、少许碎瓷片、40mL乙醇(过量),搅拌均匀后再加入3mL浓 ,按图组装好仪器后,油浴加热1h。
,按图组装好仪器后,油浴加热1h。 溶液、水洗涤,分离出有机相。
溶液、水洗涤,分离出有机相。
Ⅲ.向有机相中加入无水氯化钙干燥、过滤、蒸馏,得到12.0g丙炔酸乙酯。可能用到的信息:
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
(2)本实验中加入过量乙醇的目的是_______ 。
(3)冷却水应从_______ (填“x”或“y”)口流入。回流时,烧瓶内气雾上升高度不宜超过冷凝管的 ,若气雾上升过高,可采取的措施为
,若气雾上升过高,可采取的措施为_______ 。
(4)蒸馏时,加热一段时间后发现忘记加入碎瓷片,应采取的正确操作为_______ 。
(5)检验丙烯酸乙酯中不再含有 的药品是
的药品是_______ (填标号)。
A.无水 B.
B. C.
C.
(6)如果加入的浓硫酸过多,可能有副产物乙烯( )生成,请写出生成乙烯的化学反应方程式
)生成,请写出生成乙烯的化学反应方程式_______ 。
(7)丙炔酸乙酯的产率为_______ %(保留一位小数)。
(8)请列举1条本实验中需要采取的安全措施:_______ 。
(9)蒸馏操作收集丙炔酸乙酯馏分时,不能用水浴加热的原因是_______ 。
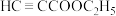 )是一种重要的有机化工原料和医药中间体。实验室制备少量丙炔酸乙酯的反应为:
)是一种重要的有机化工原料和医药中间体。实验室制备少量丙炔酸乙酯的反应为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入14.0g丙炔酸、少许碎瓷片、40mL乙醇(过量),搅拌均匀后再加入3mL浓
 ,按图组装好仪器后,油浴加热1h。
,按图组装好仪器后,油浴加热1h。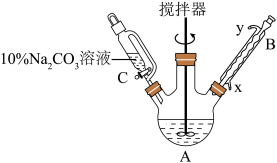
 溶液、水洗涤,分离出有机相。
溶液、水洗涤,分离出有机相。Ⅲ.向有机相中加入无水氯化钙干燥、过滤、蒸馏,得到12.0g丙炔酸乙酯。可能用到的信息:
物质 | 沸点/℃ | 溶解性 |
丙炔酸 | 141 | 与水互溶,易溶于有机溶剂 |
乙醇 | 78 | 与水互溶,易溶于有机溶剂 |
丙炔酸乙酯 | 120 | 难溶于水,易溶于有机溶剂 |
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为 (填标号)。
| A.50mL | B.100mL | C.250ml | D.500ml |
(2)本实验中加入过量乙醇的目的是
(3)冷却水应从
 ,若气雾上升过高,可采取的措施为
,若气雾上升过高,可采取的措施为(4)蒸馏时,加热一段时间后发现忘记加入碎瓷片,应采取的正确操作为
(5)检验丙烯酸乙酯中不再含有
 的药品是
的药品是A.无水
 B.
B. C.
C.
(6)如果加入的浓硫酸过多,可能有副产物乙烯(
 )生成,请写出生成乙烯的化学反应方程式
)生成,请写出生成乙烯的化学反应方程式(7)丙炔酸乙酯的产率为
(8)请列举1条本实验中需要采取的安全措施:
(9)蒸馏操作收集丙炔酸乙酯馏分时,不能用水浴加热的原因是
您最近一年使用:0次
名校
解题方法
4 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。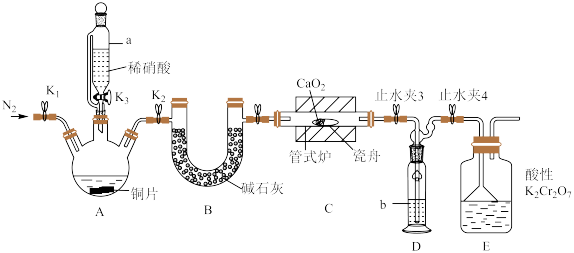
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: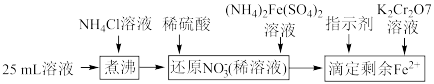
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
7日内更新
|
217次组卷
|
5卷引用:江西省南昌市八一中学2024届高三下学期三模测试化学试题
名校
5 . 酸性条件下,砷酸具有较强氧化性,能被正四价硫、碘离子等还原为正三价砷。某工厂以废渣(主要含 )制备砷的流程如下:
)制备砷的流程如下:
(1)砷的原子结构示意图为_______ 。 的结构简式为
的结构简式为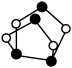 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为_______ mol。
(2)“碱浸”后溶液中含有 、
、 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为______________ 。
(3)“沉砷”时,加入试剂A的作用为_______ ;结合必要的化学用语说明为了提高 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是_______ 。
(4)滤渣1含硫酸钙和沉淀a,实验室里,用_______ 试剂除去试管壁上的沉淀a。
(5)加热时“再还原”的化学方程式为_______ 。“还原”中,氧化产物与还原产物的物质的量之比为_______ 。
(6)该流程中可以循环使用的物质为_______ 。
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素_______ 。
 )制备砷的流程如下:
)制备砷的流程如下: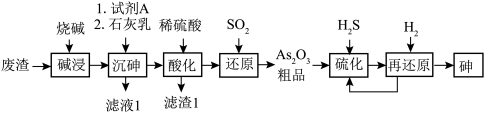
(1)砷的原子结构示意图为
 的结构简式为
的结构简式为 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为(2)“碱浸”后溶液中含有
 、
、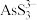 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为(3)“沉砷”时,加入试剂A的作用为
 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是(4)滤渣1含硫酸钙和沉淀a,实验室里,用
(5)加热时“再还原”的化学方程式为
(6)该流程中可以循环使用的物质为
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素
您最近一年使用:0次
解题方法
6 . 某研究小组模拟用硫酸化焙烧—水浸工艺从高砷铜冶炼烟尘中浸出铜、锌的流程如下。 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与 。各元素质量分数如下:
。各元素质量分数如下:
②25℃时,硫酸铅的溶度积常数 ;
;
③浸出率的计算:浸出率 。
。
回答下列问题:
(1)基态Zn原子的价层电子排布式为___________ 。
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现___________ 的作用。请补全 参与反应的化学方程式:
参与反应的化学方程式:
___________ 。
(3)“水浸”时,所得浸渣的主要成分为___________ (写化学式),往浸取液中加入的金属单质是___________ (写化学式)。
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中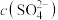 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?___________ (列式计算并得出结论)。
(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。
标准溶液21.00mL。
(已知: ,
, )
)
①滴定终点的现象为___________ 。
②忽略流程中的损失,可得铜的浸出率为___________ 。
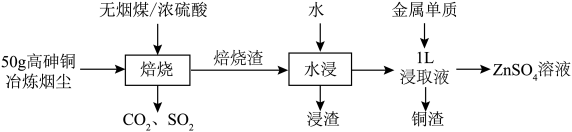
 及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与
及氧化物,焙烧时,金属砷酸盐转化为硫酸盐与 。各元素质量分数如下:
。各元素质量分数如下:| Cu | Zn | As | Pb | In | Ag |
| 5.60% | 15.60% | 28.68% | 22.34% | 0.073% | 0.01% |
 ;
;③浸出率的计算:浸出率
 。
。回答下列问题:
(1)基态Zn原子的价层电子排布式为
(2)“焙烧”时,无烟煤除了为焙烧提供热量外,还表现
 参与反应的化学方程式:
参与反应的化学方程式:
(3)“水浸”时,所得浸渣的主要成分为
(4)高砷铜冶炼烟尘经过焙烧、水浸等工序后,测得浸取液中
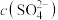 为
为 ,请从理论上分析铅是否沉淀完全?
,请从理论上分析铅是否沉淀完全?(5)铜浸出率的测定:从上述流程中得到的1L浸取液中取50mL与过量的酸性KI完全反应后,过滤,往滤液中滴加淀粉溶液为指示剂,用
 标准溶液滴定,滴定终点时消耗
标准溶液滴定,滴定终点时消耗 标准溶液21.00mL。
标准溶液21.00mL。(已知:
 ,
, )
)①滴定终点的现象为
②忽略流程中的损失,可得铜的浸出率为
您最近一年使用:0次
名校
解题方法
7 . 草酸镍(NiC2O4)是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图: 、
、 ;
;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体能吸附Ni2+。
③草酸的Ka1=6.0×10-2,Ka2=5.0×10-5。
回答下列问题:
(1)生产时为提高合金废料浸出率,下列措施可行的是_______ (填字母)。
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是_______ 。
(3)“氧化”过程中,控制70℃、pH小于3的条件下进行。
①“氧化”过程的离子方程式为_______ 。
②若pH大于3镍的回收率降低的原因是_______ 。
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是_______ 。已知常温下Ksp[NiC2O4]=1.70×10-17,当溶液pH=2时,Ni2+沉淀完全[c(Ni2+)≤1×10-5mol·L-1时认为完全沉淀],则此时溶液中草酸的浓度c(H2C2O4)=_______ (保留两位有效数字)。
(5)在空气中加热二水合草酸镍得到NiO,该反应的化学方程式为_______ 。
 、
、 ;
;②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体能吸附Ni2+。
③草酸的Ka1=6.0×10-2,Ka2=5.0×10-5。
回答下列问题:
(1)生产时为提高合金废料浸出率,下列措施可行的是
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是
(3)“氧化”过程中,控制70℃、pH小于3的条件下进行。
①“氧化”过程的离子方程式为
②若pH大于3镍的回收率降低的原因是
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是
(5)在空气中加热二水合草酸镍得到NiO,该反应的化学方程式为
您最近一年使用:0次
2024-05-21更新
|
421次组卷
|
3卷引用:2024届江西省南昌市第十九中学高三下学期模拟预测化学试题
2024届江西省南昌市第十九中学高三下学期模拟预测化学试题2024届四川省成都外国语学校高三下学期高考模拟(二)理综化学试题(已下线)山东省青岛市2023-2024学年高三下学期第三次模拟考试化学试题
解题方法
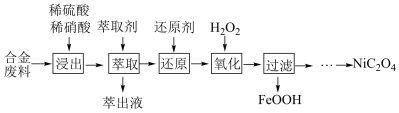
8 . 三氯化六氨合钴( )是一种重要的化工产品。实验室以
)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:
Ⅰ.制备氯化钴:已知 易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备
易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备_____ 。
(2)A中固体为高锰酸钾,则反应的离子方程式为______ 。装置B中试剂X为____ 。
(3)球形干燥管中试剂的作用为______ 。
Ⅱ.制备三氯化六氨合钴:将制备的 按下图流程操作:
按下图流程操作:____ 。
(5)利用 、
、 、浓氨水、
、浓氨水、 制备
制备 的总反应化学方程式
的总反应化学方程式___ 。
(6)操作X中,加入浓盐酸的作用是____ 。
Ⅲ.测定钴含量:准确称量3.0000g样品 ,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L
,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L  溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积为10.00mL。
溶液的体积为10.00mL。
(已知:① 将
将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ;②
;② )。
)。
(7)计算样品中钴元素的质量分数为_______ %(保留至小数点后两位)。
 )是一种重要的化工产品。实验室以
)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:Ⅰ.制备氯化钴:已知
 易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备
易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备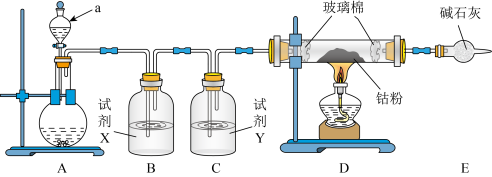
(2)A中固体为高锰酸钾,则反应的离子方程式为
(3)球形干燥管中试剂的作用为
Ⅱ.制备三氯化六氨合钴:将制备的
 按下图流程操作:
按下图流程操作:
(5)利用
 、
、 、浓氨水、
、浓氨水、 制备
制备 的总反应化学方程式
的总反应化学方程式(6)操作X中,加入浓盐酸的作用是
Ⅲ.测定钴含量:准确称量3.0000g样品
 ,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L
,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L  溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积为10.00mL。
溶液的体积为10.00mL。(已知:①
 将
将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ;②
;② )。
)。(7)计算样品中钴元素的质量分数为
您最近一年使用:0次
9 . 硫酸铁和硫酸亚铁均为重要的盐。实验室用废铁屑(含油污)制备 和
和 溶液,并进行相关探究。回答下列问题:
溶液,并进行相关探究。回答下列问题:
Ⅰ.制备0.01 mol⋅L
 溶液和0.04 mol⋅L
溶液和0.04 mol⋅L
 溶液。
溶液。
步骤一:将废铁屑(含油污)依次用热纯碱溶液、蒸馏水清洗后,加入足量 溶液,充分反应后过滤;
溶液,充分反应后过滤;
步骤二:向滤液中分批加入足量双氧水,充分反应后小心煮沸、冷至室温;
步骤三:标定所得 溶液浓度;
溶液浓度;
步骤四:配制100 mL 0.01 mol⋅L
 溶液;
溶液;
步骤五:取部分标定浓度后的 溶液,经转化后配制100 mL 0.04 mol⋅L
溶液,经转化后配制100 mL 0.04 mol⋅L
 溶液。
溶液。
(1)步骤一中用蒸馏水清洗的目的为___________ ;步骤二中,双氧水需足量并分批加入的原因为___________ 。
(2)步骤三标定 溶液浓度的操作:准确量取10.00 mL
溶液浓度的操作:准确量取10.00 mL  溶液于锥形瓶中,依次加入适当过量的
溶液于锥形瓶中,依次加入适当过量的 、适量的
、适量的 ,充分反应后用0.1000 mol⋅L
,充分反应后用0.1000 mol⋅L
 标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下
标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下 不与
不与 反应)。
反应)。
①向 溶液中加入
溶液中加入 反应的离子方程式为
反应的离子方程式为___________ ;加入适量 的作用为
的作用为___________ 。
② 溶液的物质的量浓度为
溶液的物质的量浓度为___________ 。
(3)制备0.01 mol⋅L
 溶液的实验中,如图所示仪器不需要使用的是
溶液的实验中,如图所示仪器不需要使用的是___________ (填仪器名称)。 与Ag生成
与Ag生成 和
和 的反应特点。
的反应特点。
提出猜想:上述反应为可逆反应。
验证猜想:取少量Ag粉,向其中加入0.01mol⋅L
 溶液,固体全部溶解;将0.01 mol⋅L
溶液,固体全部溶解;将0.01 mol⋅L
 溶液与0.04 mol⋅L
溶液与0.04 mol⋅L
 溶液等体积混合,产生灰黑色沉淀。
溶液等体积混合,产生灰黑色沉淀。
(4)验证猜想时,第二步实验中所加FeSO₄溶液过量的目的为___________ ;向所得灰黑色沉淀中加入适量浓硝酸,通过___________ (填实验现象),可证明灰黑色沉淀为Ag单质。
(5)实验结论:猜想___________ (填“成立”或“不成立”)。
 和
和 溶液,并进行相关探究。回答下列问题:
溶液,并进行相关探究。回答下列问题:Ⅰ.制备0.01 mol⋅L

 溶液和0.04 mol⋅L
溶液和0.04 mol⋅L
 溶液。
溶液。步骤一:将废铁屑(含油污)依次用热纯碱溶液、蒸馏水清洗后,加入足量
 溶液,充分反应后过滤;
溶液,充分反应后过滤;步骤二:向滤液中分批加入足量双氧水,充分反应后小心煮沸、冷至室温;
步骤三:标定所得
 溶液浓度;
溶液浓度;步骤四:配制100 mL 0.01 mol⋅L

 溶液;
溶液;步骤五:取部分标定浓度后的
 溶液,经转化后配制100 mL 0.04 mol⋅L
溶液,经转化后配制100 mL 0.04 mol⋅L
 溶液。
溶液。(1)步骤一中用蒸馏水清洗的目的为
(2)步骤三标定
 溶液浓度的操作:准确量取10.00 mL
溶液浓度的操作:准确量取10.00 mL  溶液于锥形瓶中,依次加入适当过量的
溶液于锥形瓶中,依次加入适当过量的 、适量的
、适量的 ,充分反应后用0.1000 mol⋅L
,充分反应后用0.1000 mol⋅L
 标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下
标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下 不与
不与 反应)。
反应)。①向
 溶液中加入
溶液中加入 反应的离子方程式为
反应的离子方程式为 的作用为
的作用为②
 溶液的物质的量浓度为
溶液的物质的量浓度为(3)制备0.01 mol⋅L

 溶液的实验中,如图所示仪器不需要使用的是
溶液的实验中,如图所示仪器不需要使用的是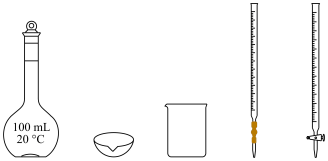
 与Ag生成
与Ag生成 和
和 的反应特点。
的反应特点。提出猜想:上述反应为可逆反应。
验证猜想:取少量Ag粉,向其中加入0.01mol⋅L

 溶液,固体全部溶解;将0.01 mol⋅L
溶液,固体全部溶解;将0.01 mol⋅L
 溶液与0.04 mol⋅L
溶液与0.04 mol⋅L
 溶液等体积混合,产生灰黑色沉淀。
溶液等体积混合,产生灰黑色沉淀。(4)验证猜想时,第二步实验中所加FeSO₄溶液过量的目的为
(5)实验结论:猜想
您最近一年使用:0次
10 . 钨(W)广泛用于国防军事、航空航天、信息制造等领域。实验室以硬质合金废料(含WC、Fe和少量C、Co)为原料制备炼钨中间体 ,并提取有价金属的一种工艺流程如图所示:
,并提取有价金属的一种工艺流程如图所示:
回答下列问题:
(1)“酸浸”的目的为___________ ;“沉铁”时调节pH的范围为___________ ;“还原”反应同时生成一种参与大气循环的气体,该离子方程式为___________ 。
(2)其他条件相同时,“焙烧”过程中 流速与钨氧化率的关系如图所示,其中
流速与钨氧化率的关系如图所示,其中 流速大于0.15 m3/h时钨氧化率降低的原因为
流速大于0.15 m3/h时钨氧化率降低的原因为___________ 。 ,其原因为
,其原因为___________ 。
(4)“酸浸”工序可用电解法代替。则进行电解时,WC进入___________ (填“阳极泥”或“阴极泥”)。
(5)尾气1与尾气3的反应是汽车尾气处理的原理之一,该反应的化学方程式为___________ 。
(6) 、
、 ,
, 、
、 ,NaOH,Co中,熔点主要取决于氢键的是
,NaOH,Co中,熔点主要取决于氢键的是___________ ;H、O、Cl、Co的电负性由大到小的顺序为___________ 。
 ,并提取有价金属的一种工艺流程如图所示:
,并提取有价金属的一种工艺流程如图所示: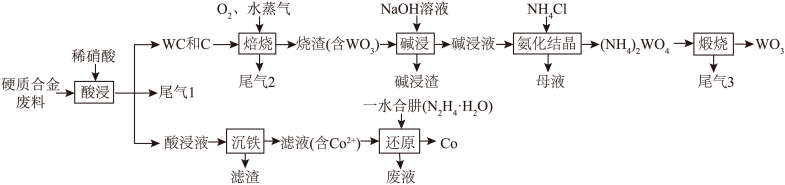
| 金属离子 |  |  |  |  |
| 开始沉定pH | 0.2 | 1.5 | 6.5 | 7.0 |
| 沉淀完全pH | 1.1 | 4.1 | 9.7 | 9.2 |
(1)“酸浸”的目的为
(2)其他条件相同时,“焙烧”过程中
 流速与钨氧化率的关系如图所示,其中
流速与钨氧化率的关系如图所示,其中 流速大于0.15 m3/h时钨氧化率降低的原因为
流速大于0.15 m3/h时钨氧化率降低的原因为
 ,其原因为
,其原因为(4)“酸浸”工序可用电解法代替。则进行电解时,WC进入
(5)尾气1与尾气3的反应是汽车尾气处理的原理之一,该反应的化学方程式为
(6)
 、
、 ,
, 、
、 ,NaOH,Co中,熔点主要取决于氢键的是
,NaOH,Co中,熔点主要取决于氢键的是
您最近一年使用:0次



