解题方法
1 . 硫脲 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为__________ 。
(2)从结构角度分析,硫脲可溶于水的原因是__________ 。
(3)多孔球泡的作用是__________ 。
(4)B中反应完全的标志是__________ 。
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为__________ (填标号)。
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:
取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为__________ 。
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成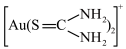 ,反应的离子方程式为
,反应的离子方程式为_______ 。溶解金的过程伴随着溶液变红的现象,原因可能为硫脲发生异构化生成__________ (填化学式)。
 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。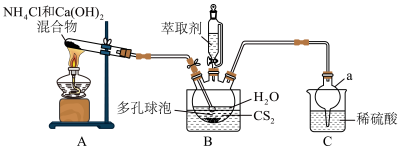
(1)仪器a的名称为
(2)从结构角度分析,硫脲可溶于水的原因是
(3)多孔球泡的作用是
(4)B中反应完全的标志是
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:

取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成
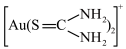 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 三水合硝酸铜[Cu(NO3)2·3H2O,M=242g/mol]是一种重要的无机试剂,用途广泛。
回答下列问题:
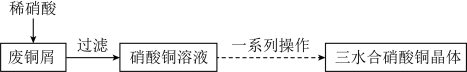
Ⅰ.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。_______ 。
(2)由硝酸铜溶液获得三水合硝酸铜晶体过程中的一系列操作包括_______ 、过滤、洗涤、干燥。在洗涤操作中用乙醇洗涤的原因是_______ 。
(3)某工厂在用稀硝酸溶解废铜屑制备Cu(NO3)2·3H2O时,为避免NOx的生成,工程师提出还应加入H2O2溶液,反应的化学方程式为_______ ,当消耗含铜元素80%的废铜屑240kg时,得到653.4kg产品,产率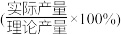 为
为_______ 。
Ⅱ.三水合硝酸铜[Cu(NO3)2·3H2O]的热分解实验。
(4)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为_______ ,继续升温至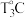 时生成的固体产物为
时生成的固体产物为_______ (填化学式)。
回答下列问题:
Ⅰ.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。
(2)由硝酸铜溶液获得三水合硝酸铜晶体过程中的一系列操作包括
(3)某工厂在用稀硝酸溶解废铜屑制备Cu(NO3)2·3H2O时,为避免NOx的生成,工程师提出还应加入H2O2溶液,反应的化学方程式为
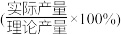 为
为Ⅱ.三水合硝酸铜[Cu(NO3)2·3H2O]的热分解实验。
(4)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在
 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为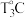 时生成的固体产物为
时生成的固体产物为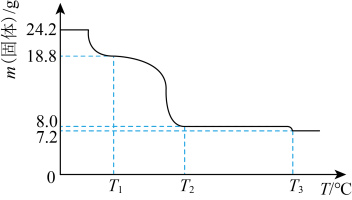
您最近一年使用:0次
解题方法
3 . 废 催化剂(含
催化剂(含 、
、 、
、 等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。 、
、 和
和 都能与NaOH溶液反应生成可溶性的
都能与NaOH溶液反应生成可溶性的 、
、 和不溶性的
和不溶性的 ;②
;② 易水解;③
易水解;③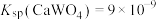 。
。
回答下列问题:
(1)基态钒原子的价层电子轨道表示式为:___________ 。
(2)碱浸步骤可以提高浸取率的操作有___________ (列举两项)。
(3)碱浸后可通过减压过滤的方式分离Ti与V、W,减压过滤的优点是___________ 。
(4)酸浸后Ti以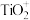 形式存在,热水解步骤的离子方程式为
形式存在,热水解步骤的离子方程式为___________ 。
(5)“沉钒”中析出 时,需要加入过量
时,需要加入过量 ,其目的是
,其目的是___________ 。
(6)向10mL0.1mol/L 的滤液中加入等体积的
的滤液中加入等体积的 溶液(忽略混合过程中的体积变化),欲使
溶液(忽略混合过程中的体积变化),欲使 浓度小于
浓度小于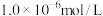 ,则
,则 溶液的最小浓度为
溶液的最小浓度为___________ mol/L。
(7)铝热法常用于冶炼高熔点金属,写出铝热法冶炼W的化学方程式___________ 。
 催化剂(含
催化剂(含 、
、 、
、 等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。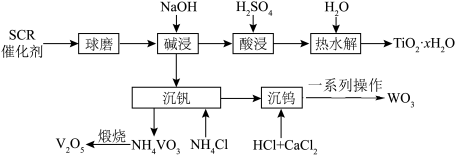
 、
、 和
和 都能与NaOH溶液反应生成可溶性的
都能与NaOH溶液反应生成可溶性的 、
、 和不溶性的
和不溶性的 ;②
;② 易水解;③
易水解;③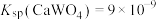 。
。回答下列问题:
(1)基态钒原子的价层电子轨道表示式为:
(2)碱浸步骤可以提高浸取率的操作有
(3)碱浸后可通过减压过滤的方式分离Ti与V、W,减压过滤的优点是
(4)酸浸后Ti以
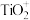 形式存在,热水解步骤的离子方程式为
形式存在,热水解步骤的离子方程式为(5)“沉钒”中析出
 时,需要加入过量
时,需要加入过量 ,其目的是
,其目的是(6)向10mL0.1mol/L
 的滤液中加入等体积的
的滤液中加入等体积的 溶液(忽略混合过程中的体积变化),欲使
溶液(忽略混合过程中的体积变化),欲使 浓度小于
浓度小于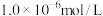 ,则
,则 溶液的最小浓度为
溶液的最小浓度为(7)铝热法常用于冶炼高熔点金属,写出铝热法冶炼W的化学方程式
您最近一年使用:0次
4 . 以水钴矿(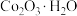 ,含
,含 、MgO、CaO)和辉铜矿(
、MgO、CaO)和辉铜矿( ,含
,含 、
、 )为原料制取胆矾和单质钴。
)为原料制取胆矾和单质钴。 ,
,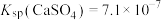 ,
,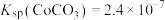 ;
;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取 的反应原理;
的反应原理; ;
;
④Mg、Ca、Fe、Co均能与强酸反应产生 。
。
回答下列问题:
(1)基态Co原子的简化电子排布式为___________ 。
(2)“酸浸”过程硫元素价态变为 价,写出“酸浸”过程中主要反应的化学方程式:
价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(3)“滤渣1”的主要成分为___________ 。
(4)常温下,若“滤液2”中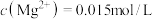 (忽略溶液中极少量的
(忽略溶液中极少量的 ),除去2L“滤液2”中的
),除去2L“滤液2”中的 ,至少需加入NaF固体的质量为
,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解 溶液﹑在无离子交换膜的条件下,不能用
溶液﹑在无离子交换膜的条件下,不能用 溶液代替
溶液代替 溶液的理由是
溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入 至弱酸性,生成白色沉淀和硫酸铵。经仪器分析:白色沉淀含H、N、O、S、Cu五种元素;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为一种三角锥形和一种正四面体形。则白色沉淀的化学式为
至弱酸性,生成白色沉淀和硫酸铵。经仪器分析:白色沉淀含H、N、O、S、Cu五种元素;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为一种三角锥形和一种正四面体形。则白色沉淀的化学式为___________ 。
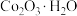 ,含
,含 、MgO、CaO)和辉铜矿(
、MgO、CaO)和辉铜矿( ,含
,含 、
、 )为原料制取胆矾和单质钴。
)为原料制取胆矾和单质钴。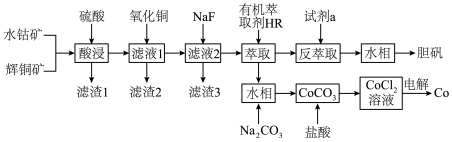
 ,
,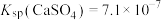 ,
,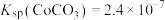 ;
;②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 |  |  |  |  |
开始沉淀时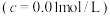 的pH 的pH | 2.7 | 7.5 | 7.6 | 4.7 |
完全沉淀时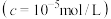 的pH 的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 的反应原理;
的反应原理; ;
;④Mg、Ca、Fe、Co均能与强酸反应产生
 。
。回答下列问题:
(1)基态Co原子的简化电子排布式为
(2)“酸浸”过程硫元素价态变为
 价,写出“酸浸”过程中主要反应的化学方程式:
价,写出“酸浸”过程中主要反应的化学方程式:(3)“滤渣1”的主要成分为
(4)常温下,若“滤液2”中
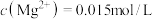 (忽略溶液中极少量的
(忽略溶液中极少量的 ),除去2L“滤液2”中的
),除去2L“滤液2”中的 ,至少需加入NaF固体的质量为
,至少需加入NaF固体的质量为(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解
 溶液﹑在无离子交换膜的条件下,不能用
溶液﹑在无离子交换膜的条件下,不能用 溶液代替
溶液代替 溶液的理由是
溶液的理由是(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入
 至弱酸性,生成白色沉淀和硫酸铵。经仪器分析:白色沉淀含H、N、O、S、Cu五种元素;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为一种三角锥形和一种正四面体形。则白色沉淀的化学式为
至弱酸性,生成白色沉淀和硫酸铵。经仪器分析:白色沉淀含H、N、O、S、Cu五种元素;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为一种三角锥形和一种正四面体形。则白色沉淀的化学式为
您最近一年使用:0次
解题方法
5 . 以黄铁矿(主要成分 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
(1)黄铁矿中硫元素的化合价为___________ 。
(2)“氧化”时,反应的化学方程式为___________ 。
(3)工业上,吸收 时宜选用的试剂X为
时宜选用的试剂X为___________ (填“水”或“浓硫酸”)。
(4) 高温灼烧时,火焰呈
高温灼烧时,火焰呈___________ 色。
(5) 在保存过程中发生
在保存过程中发生___________ (填“氧化”或“还原”)反应,导致商品 中不可避免地存在
中不可避免地存在 ,欲检验其中的
,欲检验其中的 ,可取少量样品溶于水中,
,可取少量样品溶于水中,___________ ,说明含有 。
。
(6)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用已知浓度的K2Cr2O7溶液测定其中的Fe2+。反应原理为___________Cr2O +___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
+___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
①配平上述离子反应方程式___________ 。
②某次实验称取0.2800g样品,测定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为___________ %(保留至小数点后第一位)。
 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。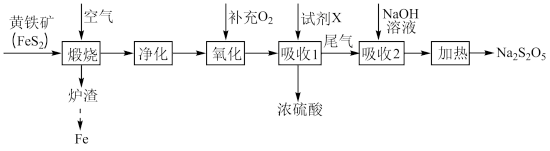
(1)黄铁矿中硫元素的化合价为
(2)“氧化”时,反应的化学方程式为
(3)工业上,吸收
 时宜选用的试剂X为
时宜选用的试剂X为(4)
 高温灼烧时,火焰呈
高温灼烧时,火焰呈(5)
 在保存过程中发生
在保存过程中发生 中不可避免地存在
中不可避免地存在 ,欲检验其中的
,欲检验其中的 ,可取少量样品溶于水中,
,可取少量样品溶于水中, 。
。(6)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用已知浓度的K2Cr2O7溶液测定其中的Fe2+。反应原理为___________Cr2O
 +___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
+___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。①配平上述离子反应方程式
②某次实验称取0.2800g样品,测定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
您最近一年使用:0次
名校
解题方法
6 . 废电池粉[锂、铁、磷、铜、铝和碳(碳粉)的质量分数分别为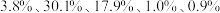 和
和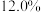 ]回收处理的工艺流程如下:
]回收处理的工艺流程如下: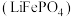 转化为难溶于水
转化为难溶于水 和可溶于水硫酸锂,写出该反应的化学方程式:
和可溶于水硫酸锂,写出该反应的化学方程式:______________ 。哪些途径可以提高转化的效率(写两条):______________ 。
(2)“净化”步骤可以去除滤液中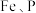 等元素,沉渣1中含
等元素,沉渣1中含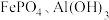 、
、_______ 。沉渣2的主要成分为_______ 。
(3)“电解”可以将溶液中的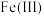 转化为
转化为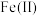 ,溶液中
,溶液中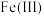 完全转化为
完全转化为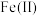 的标志是
的标志是______________ 。甲醇在阳极发生反应生成甲醛,阳极电极反应方程式为_______ 。在电解完成后向溶液中加入 溶液可以将溶液中的
溶液可以将溶液中的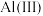 沉淀。
沉淀。
(4)称取一定量的二水磷酸铁,用硝酸溶解后再用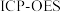 进行分析,得到部分杂质的质量分数
进行分析,得到部分杂质的质量分数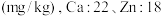 ,评价该制备过程
,评价该制备过程_______ (填“是”或“否”)符合均满足 《电池用磷酸铁》的Ⅱ型标准
《电池用磷酸铁》的Ⅱ型标准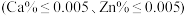 。
。
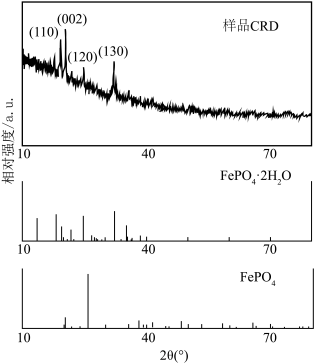
(5) 衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、
衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、 和
和 的标准卡片的
的标准卡片的 衍射实验图谱,结合图像内容判断获的样品
衍射实验图谱,结合图像内容判断获的样品_______ (填“是”或“否”) 。
。
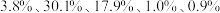 和
和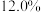 ]回收处理的工艺流程如下:
]回收处理的工艺流程如下: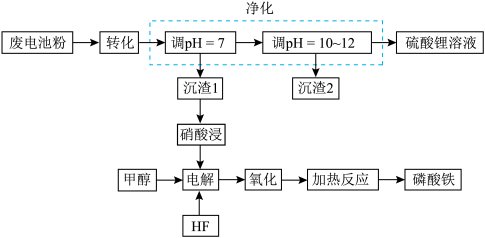
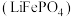 转化为难溶于水
转化为难溶于水 和可溶于水硫酸锂,写出该反应的化学方程式:
和可溶于水硫酸锂,写出该反应的化学方程式:(2)“净化”步骤可以去除滤液中
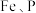 等元素,沉渣1中含
等元素,沉渣1中含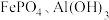 、
、(3)“电解”可以将溶液中的
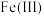 转化为
转化为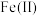 ,溶液中
,溶液中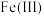 完全转化为
完全转化为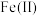 的标志是
的标志是 溶液可以将溶液中的
溶液可以将溶液中的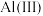 沉淀。
沉淀。(4)称取一定量的二水磷酸铁,用硝酸溶解后再用
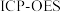 进行分析,得到部分杂质的质量分数
进行分析,得到部分杂质的质量分数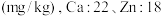 ,评价该制备过程
,评价该制备过程 《电池用磷酸铁》的Ⅱ型标准
《电池用磷酸铁》的Ⅱ型标准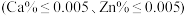 。
。(5)
 衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、
衍射实验图谱与标准卡片进行对比分析,可判断样品晶体类型。下图分别为样品、 和
和 的标准卡片的
的标准卡片的 衍射实验图谱,结合图像内容判断获的样品
衍射实验图谱,结合图像内容判断获的样品 。
。
您最近一年使用:0次
解题方法
7 . 实现废钨——镍型加氢催化剂(主要成分为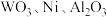 ,还含有
,还含有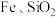 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。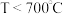 ,纯碱不与
,纯碱不与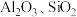 反应。
反应。
ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)28Ni位于元素周期表的第__________ 周期、__________ 族。
(2)“氧化”的目的为__________ 和将金属单质氧化至相应价态。
(3)“钠化焙烧”中生成 的化学方程式为
的化学方程式为__________ 。
(4)“酸化沉钨”后过滤,所得滤饼的主要成分为__________ (填化学式)。
(5)“调 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为__________ 。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
“一系列操作”依次是__________ 、及时过滤、洗涤、干燥。
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为__________ 。
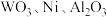 ,还含有
,还含有 和少量含
和少量含 有机物)中有价值金属回收的工艺流程如下。
有机物)中有价值金属回收的工艺流程如下。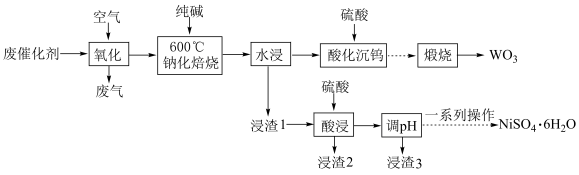
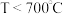 ,纯碱不与
,纯碱不与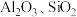 反应。
反应。ⅱ.相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的
 范围如下:
范围如下:| 金属离子 | Ni2+ | Al3+ | Fe3+ |
| 开始沉淀时的pH | 6.9 | 3.4 | 1.5 |
| 沉淀完全时的pH | 8.9 | 4.7 | 2.8 |
(1)28Ni位于元素周期表的第
(2)“氧化”的目的为
(3)“钠化焙烧”中生成
 的化学方程式为
的化学方程式为(4)“酸化沉钨”后过滤,所得滤饼的主要成分为
(5)“调
 ”除铁和铝,溶液的
”除铁和铝,溶液的 范围应调节为
范围应调节为(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
| 温度 | 低于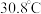 |  | 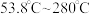 | 高于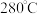 |
| 晶体形态 |  |  | 多种结晶水合物 |  |
(7)强碱溶液中NaClO氧化NiSO4,可沉淀出用作电池正极材料的NiOOH,该反应的离子方程式为
您最近一年使用:0次
8 . 环己酮(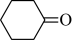 )是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
)是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
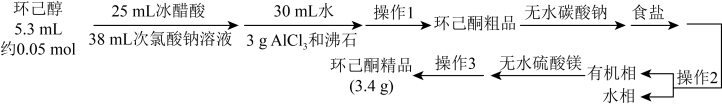
①环己酮的密度比水的密度小,能与水形成恒沸混合物,沸点为95℃。
②31℃时,环己酮在水中的溶解度为2.4 g。
回答下列问题:
(1)环己醇与次氯酸钠溶液反应的离子方程式为
(2)“操作1”和“操作3”是蒸馏,其蒸馏装置中用到的冷凝管是
A.  B.
B.  C.
C. 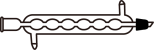
(4)实验中加入无水硫酸镁的目的是
(5)制备环己酮粗品时:
①加入次氯酸钠溶液后,用淀粉-碘化钾试纸检验,试纸应呈蓝色,否则应再补加次氯酸钠溶液,其目的是
②次氯酸钠溶液的浓度可用间接碘量法测定。用移液管移取10.00mL次氯酸钠溶液于500mL容量瓶中,加蒸馏水至刻度线,摇匀后移取25.00mL该溶液于250mL锥形瓶中,加入50mL0.1 mol·L-1盐酸和2g碘化钾,用0.1mol·L-1硫代硫酸钠标准溶液滴定析出的碘。在滴定接近终点时加入1mL0.2%淀粉溶液。析出碘的反应的离子方程式为
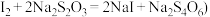
(6)本实验环己酮的产率最接近_______(填字母)。
| A.50% | B.60% | C.70% | D.80% |
您最近一年使用:0次
9 . 铼(Re)被誉为“金属之王”,用于航空航天发动机制造等领域。以含铼废料(主要含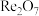 、
、 、CuO等)为原料制备铼的流程如下:
、CuO等)为原料制备铼的流程如下: )是白色片状晶体,微溶于冷水,溶于热水。
)是白色片状晶体,微溶于冷水,溶于热水。
回答下列问题:
(1)下列状态Zn的最外层电子排布式中,能量最高的是___________(填字母)。
(2)根据上述流程图预测:铼在金属活动顺序表中位置在___________(填字母)。
(3)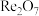 是酸性氧化物。“还原”中主要离子方程式为
是酸性氧化物。“还原”中主要离子方程式为___________ 。“热解”中得到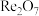 的化学方程式:
的化学方程式:___________ 。
(4)“沉铼”中,用___________ (填“热水”或“冰水”)洗涤过铼酸铵,确认 洗涤干净的方法是
洗涤干净的方法是___________ 。
(5)用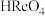 制备
制备 的另一种方案是:第1步,用有机溶剂萃取得到含铼有机相;第2步,用氨水反萃取得到
的另一种方案是:第1步,用有机溶剂萃取得到含铼有机相;第2步,用氨水反萃取得到 溶液。相对“沉铼”法,该工艺优点是
溶液。相对“沉铼”法,该工艺优点是___________ 。
 、
、 、CuO等)为原料制备铼的流程如下:
、CuO等)为原料制备铼的流程如下: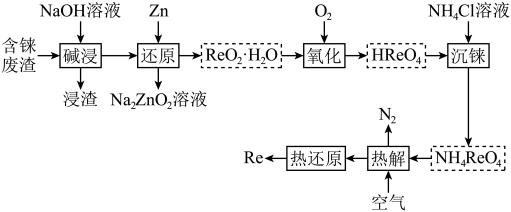
 )是白色片状晶体,微溶于冷水,溶于热水。
)是白色片状晶体,微溶于冷水,溶于热水。回答下列问题:
(1)下列状态Zn的最外层电子排布式中,能量最高的是___________(填字母)。
A.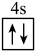 | B.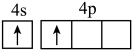 | C.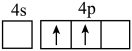 | D.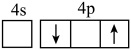 |
(2)根据上述流程图预测:铼在金属活动顺序表中位置在___________(填字母)。
| A.Na之前 | B.Mg、Al之间 | C.Zn、Cu之间 | D.Ag之后 |
(3)
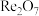 是酸性氧化物。“还原”中主要离子方程式为
是酸性氧化物。“还原”中主要离子方程式为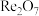 的化学方程式:
的化学方程式:(4)“沉铼”中,用
 洗涤干净的方法是
洗涤干净的方法是(5)用
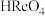 制备
制备 的另一种方案是:第1步,用有机溶剂萃取得到含铼有机相;第2步,用氨水反萃取得到
的另一种方案是:第1步,用有机溶剂萃取得到含铼有机相;第2步,用氨水反萃取得到 溶液。相对“沉铼”法,该工艺优点是
溶液。相对“沉铼”法,该工艺优点是
您最近一年使用:0次
解题方法
10 . 含铈(Ce)化合物广泛应用与光学材料、催化等领域。一种以氟碳酸铈(主要成分为CeFCO3、BaO、SiO2)为原料制备碳酸铈的工艺流程如图所示: 形式存在
形式存在
② 可与
可与 形成难溶复盐
形成难溶复盐
③25℃时的平衡常数如下表:
回答下列问题:
(1)Ce为58号元素,它在周期表中的位置为___________ 。
(2)“焙烧”在对流空气氧化炉中反应速率较快的原因是___________ 。
(3)滤渣1的主要成分为___________ 。
(4)“还原”加入硫脲和Na2SO4的作用分别是___________ 、___________ 。
(5)“沉铈”步骤的离子反应方程式为___________ 。
(6)若“沉铈”溶液中恒定。 ,则要使
,则要使 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),理论上pH不低于
),理论上pH不低于___________ (保留一位小数)。

 形式存在
形式存在②
 可与
可与 形成难溶复盐
形成难溶复盐③25℃时的平衡常数如下表:
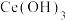 |  |  |
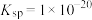 |  | 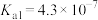  |
(1)Ce为58号元素,它在周期表中的位置为
(2)“焙烧”在对流空气氧化炉中反应速率较快的原因是
(3)滤渣1的主要成分为
(4)“还原”加入硫脲和Na2SO4的作用分别是
(5)“沉铈”步骤的离子反应方程式为
(6)若“沉铈”溶液中恒定。
 ,则要使
,则要使 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),理论上pH不低于
),理论上pH不低于
您最近一年使用:0次



