名校
解题方法
1 . 某化学兴趣小组在实验室中利用下图装置制备SO2并进行相关性质的探究。回答下列问题:

I.A与B相连时
(1)滴加浓硫酸之前,先通一段时间的N2,目的是
(2)装置A中反应的化学方程式是
(3)通入足量SO2后②中仍无明显现象,将其分成甲、乙两份,甲中加入氯水,乙中加入氨水,均产生白色沉淀。产生沉淀的化学式是:甲
Ⅱ.A与C相连时,可用来探究碳、硅元素的非金属性的相对强弱。
(4)装置⑤的作用为
您最近一年使用:0次
2023-05-11更新
|
84次组卷
|
2卷引用:河南省济源高级中学2023-2024学年高二上学期开学考试 化学试题
2 . 某兴趣小组的同学制备了氯气并探究其性质。试回答下列问题:
(1)Ⅰ.写出实验室由MnO2、浓盐酸制取氯气的离子反应方程式:___________ 。
(2)若用含有0.2molHCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12L(标准状况)的原因是___________ 。
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:
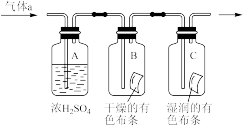
(3)证明氯气和水反应的实验现象为_____ 。
(4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是___
(5)漂白粉溶于水后,遇到空气中的 ,即产生漂白、杀菌作用,反应的化学方程式是
,即产生漂白、杀菌作用,反应的化学方程式是____ 。
(6)实验室常用烧碱溶液吸收Cl2.若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaClO和NaClO3的物质的量之比为3:1时,Cl2与烧碱反应的离子方程式是___ 。
(1)Ⅰ.写出实验室由MnO2、浓盐酸制取氯气的离子反应方程式:
(2)若用含有0.2molHCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12L(标准状况)的原因是
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题:

(3)证明氯气和水反应的实验现象为
(4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是
(5)漂白粉溶于水后,遇到空气中的
 ,即产生漂白、杀菌作用,反应的化学方程式是
,即产生漂白、杀菌作用,反应的化学方程式是(6)实验室常用烧碱溶液吸收Cl2.若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaClO和NaClO3的物质的量之比为3:1时,Cl2与烧碱反应的离子方程式是
您最近一年使用:0次
2021-11-23更新
|
137次组卷
|
2卷引用:河南省济源市英才学校2022-2023学年高一上学期11月月考化学试题
名校
解题方法
3 . 下图所示的实验或操作中,能达到实验目的的是
 | 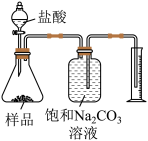 |  | 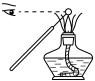 |
| 制备氢氧化亚铁 | 测定纯碱样品中碳酸钠的质量分数(杂质不与酸作用) | 排水法收集H2 | 钾的焰色试验 |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-11更新
|
563次组卷
|
10卷引用:河南省济源高级中学2022-2023学年高一下学期期末综合练习化学试题
河南省济源高级中学2022-2023学年高一下学期期末综合练习化学试题河北省张家口市2020-2021学年高一上学期期末教学质量监测化学试题天津市滨海新区塘沽第一中学2022届高三第一次月考化学试卷天津市新华中学2021-2022学年高三上学期第一次月考化学试题广东省广州市广外附设外语学校2021-2022学年高一上学期12月月考化学试题期末学业水平测试新疆维吾尔自治区伊犁哈萨克自治州新源县2021-2022学年高一上学期期中联考化学试题北京市昌平区新学道临川学校2021-2022学年高一上学期期末考试化学试题江西省丰城市第九中学2021-2022学年高三复读班上学期10月月考化学试题新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2022-2023学年高一上学期期末测试化学试题
名校
解题方法
4 . 某化学兴趣小组为了探究 的相关性质,设计了如图1实验。以下是氯元素形成物质的二维图的部分信息及相关实验装置。下列说法中正确的是
的相关性质,设计了如图1实验。以下是氯元素形成物质的二维图的部分信息及相关实验装置。下列说法中正确的是


 的相关性质,设计了如图1实验。以下是氯元素形成物质的二维图的部分信息及相关实验装置。下列说法中正确的是
的相关性质,设计了如图1实验。以下是氯元素形成物质的二维图的部分信息及相关实验装置。下列说法中正确的是

| A.根据二维图中信息,氯的氧化物有四种 |
B.盛 钢瓶上应贴的标签为腐蚀品 钢瓶上应贴的标签为腐蚀品 |
C.图1中,通入 后,从集气瓶A、B的现象可得出的结论是氯气有漂白性 后,从集气瓶A、B的现象可得出的结论是氯气有漂白性 |
D.用 和盐酸反应制备氯气, 和盐酸反应制备氯气, 过量,盐酸不能全部消耗完 过量,盐酸不能全部消耗完 |
您最近一年使用:0次
2022-11-02更新
|
235次组卷
|
3卷引用:河南省济源市2023-2024学年高级中学高一上学期化学模拟练习
名校
解题方法
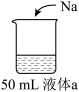
5 . 为研究Na的性质,进行如下实验
下列说法中,不正确 的是
装置 | 实验 | |
| 液体a | 现象 |
| 蒸馏水 | Ⅰ.Na浮在液面上,剧烈反应,产生少量白雾 | |
| 0.1 mol·L-1 盐酸 | Ⅱ.Na浮在液面上,反应比Ⅰ中剧烈,产生白雾 | |
| 浓盐酸 | Ⅲ.Na浮在液面上,反应比Ⅰ中缓慢,产生大量白雾,烧杯底部有白色固体 | |
| A.Ⅰ中现象说明Na与水反应放热 |
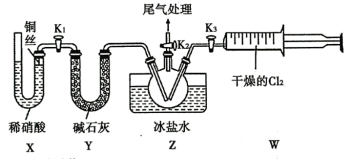
B.Ⅰ中反应的离子方程式为 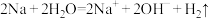 |
| C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多 |
| D.推测Ⅲ中反应缓慢可能与c(Cl-)以及生成的白色固体有关 |
您最近一年使用:0次
2021-01-23更新
|
756次组卷
|
18卷引用:河南省济源市2023-2024学年高级中学高一上学期化学模拟练习
河南省济源市2023-2024学年高级中学高一上学期化学模拟练习北京市西城区2020-2021学年高一上学期期末考试化学试题北京市第九中学2021-2022学年高一上学期期中考试化学试题北京市顺义牛栏山第一中学2022-2023学年高一上学期10月月考化学试题北京市顺义区杨镇第一中学2021-2022学年高一上学期期中考试化学试题北京市北京师范大学附属中学2022-2023学年高一上学期期中考试化学试题北京教育学院附属中学2022-2023学年高一上学期期中练习化学试题北京市第五十七中学2021-2022学年高一上学期期中考试化学试题北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练北京市第十三中学2021-2022学年高一上学期期中考试化学试题北京市第十五中学2023-2024学年高一上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高一上学期12月月考化学试题四川省自贡市蜀光中学2023-2024学年高一上学期12月月考化学试题江西省新余市第一中学2023-2024学年高一下学期开学考试化学试卷 北京市第三十一中学2023-2024学年高一上学期期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高一上学期期中考试化学试题
名校
6 . Ⅰ.已知氮氧化物(NO、NO2)、SO2是大气污染物。回答下列问题:
(1)以上污染物会造成的环境问题有___________ (写一种即可)。
(2)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2,应选择的装置是___________ (填字母)。___________ 。
(4)写出装置B中发生反应的化学方程式___________ 。
(5)装置C中浓硫酸的主要作用是___________ 。
Ⅲ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:___________ 。
(7)反应后,若要检验SO2是否过量,可用试剂为___________ 。
(1)以上污染物会造成的环境问题有
(2)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2,应选择的装置是


(4)写出装置B中发生反应的化学方程式
(5)装置C中浓硫酸的主要作用是
Ⅲ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:

(7)反应后,若要检验SO2是否过量,可用试剂为
您最近一年使用:0次
2024-04-10更新
|
483次组卷
|
2卷引用:河南省济源市英才学校2022-2023学年高一下学期3月月考 化学试卷
7 . 亚硝酰氯(ClNO),熔点-64.5℃,沸点-5.5℃,遇水反应生成一种氢化物和两种氧化物。某学习小组利用Cl2和NO通过下图所示装置制备亚硝酰氯,下列说法不正确 的是

| A.装置X可以随开随用,随关随停 |
| B.装置Y中的试剂可以换成浓硫酸 |
| C.该实验在进行反应制备之前,应先通气体将装置内的空气全部排掉 |
| D.装置Z上方的K2接口处需要连接一个干燥装置防止水进入 |
您最近一年使用:0次
2021-10-25更新
|
277次组卷
|
4卷引用:河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷
名校
解题方法
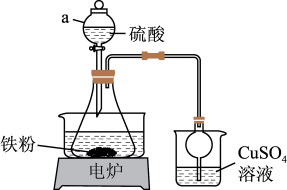
8 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]俗称摩尔盐,用途十分广泛。实验室通常用如图所示装置制备FeSO4溶液后,再与等物质的量的(NH4)2SO4反应制备摩尔盐。
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)制备FeSO4
用图示装置制备FeSO4。仪器a的名称是___________ ,该实验不用明火加热的原因是___________ 。将0.7g铁粉加入锥形瓶中,放入15mL1mol·L−1H2SO4溶液,保持温度在50℃~60℃之间反应,待无明显气泡产生后停止加热,趁热过滤。
(2)制备摩尔盐
向滤液中加入适量(NH4)2SO4饱和溶液,70℃~80℃水浴加热,保持溶液pH为1~2,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,其原因是___________ 。选用乙醇洗涤晶体的目的是___________ 。
(3)尾气吸收
由于加入的铁粉不纯,反应过程中会产生少量H2S、PH3气体,故需使用封闭装置。用CuSO4溶液吸收H2S时发生反应的离子方程式为___________ 。
(4)产品检验
称取摩尔盐产品3.920g溶于稀硫酸中,转入100mL容量瓶定容。每次用移液管取25.00mL溶液放入锥形瓶,用0.02000mol·L−1的KMnO4溶液滴定(还原产物为Mn2+,杂质不与KMnO4反应),三次平均消耗24.30mL的KMnO4溶液。
①滴定终点时的现象是___________ 。
②酸性高锰酸钾溶液与Fe2+反应的离子方程式是___________ 。
③产品中(NH4)2Fe(SO4)2·6H2O(相对分子质量为392)的质量分数为___________ 。
④实验过程中的下列操作,可能导致测定结果偏高的是___________ (填标号)。
A.取用的晶体不够干燥 B.容量瓶定容时俯视刻度线
C.滴定管未用待盛溶液润洗 D.滴定完成后,滴定管尖嘴处留有气泡
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)制备FeSO4
用图示装置制备FeSO4。仪器a的名称是

(2)制备摩尔盐
向滤液中加入适量(NH4)2SO4饱和溶液,70℃~80℃水浴加热,保持溶液pH为1~2,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,其原因是
(3)尾气吸收
由于加入的铁粉不纯,反应过程中会产生少量H2S、PH3气体,故需使用封闭装置。用CuSO4溶液吸收H2S时发生反应的离子方程式为
(4)产品检验
称取摩尔盐产品3.920g溶于稀硫酸中,转入100mL容量瓶定容。每次用移液管取25.00mL溶液放入锥形瓶,用0.02000mol·L−1的KMnO4溶液滴定(还原产物为Mn2+,杂质不与KMnO4反应),三次平均消耗24.30mL的KMnO4溶液。
①滴定终点时的现象是
②酸性高锰酸钾溶液与Fe2+反应的离子方程式是
③产品中(NH4)2Fe(SO4)2·6H2O(相对分子质量为392)的质量分数为
④实验过程中的下列操作,可能导致测定结果偏高的是
A.取用的晶体不够干燥 B.容量瓶定容时俯视刻度线
C.滴定管未用待盛溶液润洗 D.滴定完成后,滴定管尖嘴处留有气泡
您最近一年使用:0次
2021-11-03更新
|
800次组卷
|
4卷引用:河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷
河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷四川省绵阳市2021-2022学年高三上学期第一次考试理综化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】08四川省泸县第四中学2023-2024学年高三上学期开学考试理综化学试题