名校
1 . 由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
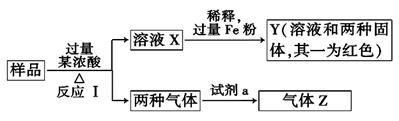
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)___________ 。
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是_________ 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_____________ 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)_____________ 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是_______________ 。

(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是
您最近一年使用:0次
2016-12-09更新
|
294次组卷
|
5卷引用:2016届甘肃会宁第一中学高三上第三次月考理化学试卷
2 . 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取.
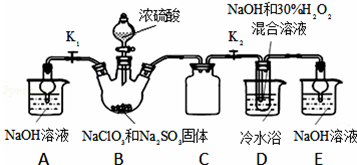
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_______________ ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为________________ ;装置D中反应生成NaClO2的化学方程式为_________________ ;反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是_________ ;检验该离子的方法是______________ ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;②___________ ;③____________ ;④___________ 得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________ ;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣).请计算所称取的样品中NaClO2的物质的量为_______________ .
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取.

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;②
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣).请计算所称取的样品中NaClO2的物质的量为
您最近一年使用:0次
2016-12-09更新
|
141次组卷
|
2卷引用:2016届甘肃省张掖二中高三上学期10月月考化学试卷
解题方法
3 . 工业上采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、A12O3,不考虑其他杂质)制取FeSO4·7H2O,其制备工艺流程如下:
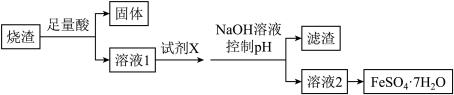
结合所学知识回答:
(1)溶解烧渣选用的酸应为_____ (填化学式),选用的试剂X为_____ (填试剂名称)。
(2)加入NaOH控制pH的目的是____________ 。
(3)从溶液2得到FeSO4·7H2O的实验操作主要步骤是________________________ 。
(4)为了测定获得的绿矾产品的纯度,进行了如下实验操作:
I.称取2.850g绿矾产品,溶解,用250mL容量瓶配制成待测液;
Ⅱ.量取25.00mL待测溶液置于锥形瓶中;
Ⅲ.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的方法是____________ 。
②该滴定反应的离子方程式为___________________ 。
③上述样品中FeSO4·7H2O的纯度为____________________ 。
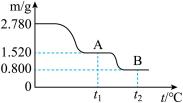
(5)古代炼丹家以绿矾(FeSO4·7H2O)为原料,放在炼丹炉中煅烧可制得绿矾油。下图是2.780 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液,得到白色沉淀1.165 g。则t1~t2段发生反应的化学方程式为__________ 。

结合所学知识回答:
(1)溶解烧渣选用的酸应为
(2)加入NaOH控制pH的目的是
(3)从溶液2得到FeSO4·7H2O的实验操作主要步骤是
(4)为了测定获得的绿矾产品的纯度,进行了如下实验操作:
I.称取2.850g绿矾产品,溶解,用250mL容量瓶配制成待测液;
Ⅱ.量取25.00mL待测溶液置于锥形瓶中;
Ⅲ.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的方法是
②该滴定反应的离子方程式为
③上述样品中FeSO4·7H2O的纯度为
(5)古代炼丹家以绿矾(FeSO4·7H2O)为原料,放在炼丹炉中煅烧可制得绿矾油。下图是2.780 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液,得到白色沉淀1.165 g。则t1~t2段发生反应的化学方程式为

您最近一年使用:0次



