解题方法
1 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。某学习小组在实验室对高铁酸钾的制备和一些性质进行探究。回答下列问题:
(1)高铁酸钾的制备,装置如图1所示。
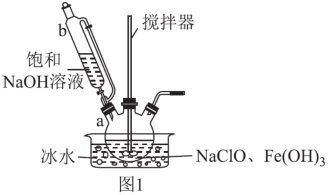
步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是_______ ,其侧管的作用为_______ 。
②a中制备Na2FeO4反应的离子方程式为_______ 。
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过_______ 方法进一步提纯。
(2)K2FeO4遇水转化为Fe(OH)3,则其能用于净水的原理为:_______ 。
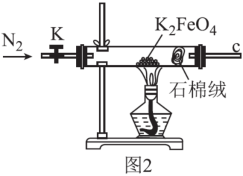
(3)用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,_______ 。
(4)实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:_______ 。
已知: +4I-+8H+=Fe2++2I2+4H2O;I2+2
+4I-+8H+=Fe2++2I2+4H2O;I2+2 =
= +2I-。
+2I-。
(1)高铁酸钾的制备,装置如图1所示。

步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是
②a中制备Na2FeO4反应的离子方程式为
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过
(2)K2FeO4遇水转化为Fe(OH)3,则其能用于净水的原理为:
(3)用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,

(4)实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:
已知:
 +4I-+8H+=Fe2++2I2+4H2O;I2+2
+4I-+8H+=Fe2++2I2+4H2O;I2+2 =
= +2I-。
+2I-。
您最近一年使用:0次
名校
2 . 定性分析和定量分析是研究物质的两种重要方法。绿矾( )在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。
)在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。
Ⅰ.定性分析
(1)设计实验检验绿矾样品是否变质:取绿矾晶体样品溶于水配成溶液,取少量溶液于试管中,滴加___________ 溶液(填化学式),溶液变红,说明溶液中有 。另取少量溶液于试管中,滴加几滴酸性
。另取少量溶液于试管中,滴加几滴酸性 溶液,溶液的紫红色褪去,说明溶液中有
溶液,溶液的紫红色褪去,说明溶液中有___________ (填离子符号),以上实验说明绿矾部分变质。
(2)若要使部分变质的 溶液复原,最佳试剂为
溶液复原,最佳试剂为___________ (填化学式)。
Ⅱ.定量分析
(3)为测定绿矾样品中 晶体的质量分数,进行如下实验:
晶体的质量分数,进行如下实验:
步骤ⅱ:准确称取绿矾样品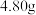 溶于水,配成
溶于水,配成 溶液。
溶液。
步骤ⅱ:取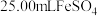 溶液,向其中滴加
溶液,向其中滴加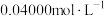 酸性
酸性 溶液至恰好反应,消耗酸性
溶液至恰好反应,消耗酸性 溶液
溶液 。
。
已知杂质不参加反应,实验过程中发生的反应为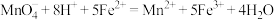 。
。
①实验室由绿矾晶体配制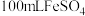 溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、
溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、___________ 。
②步骤ⅰ中,若用含氧气的蒸馏水配制溶液,导致测定的硫酸亚铁晶体的质量分数___________ (填“偏大”或“偏小”)。
③该样品中 晶体的质量分数为
晶体的质量分数为___________ %(结果保留小数点后一位)。
 )在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。
)在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。Ⅰ.定性分析
(1)设计实验检验绿矾样品是否变质:取绿矾晶体样品溶于水配成溶液,取少量溶液于试管中,滴加
 。另取少量溶液于试管中,滴加几滴酸性
。另取少量溶液于试管中,滴加几滴酸性 溶液,溶液的紫红色褪去,说明溶液中有
溶液,溶液的紫红色褪去,说明溶液中有(2)若要使部分变质的
 溶液复原,最佳试剂为
溶液复原,最佳试剂为Ⅱ.定量分析
(3)为测定绿矾样品中
 晶体的质量分数,进行如下实验:
晶体的质量分数,进行如下实验:步骤ⅱ:准确称取绿矾样品
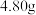 溶于水,配成
溶于水,配成 溶液。
溶液。步骤ⅱ:取
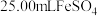 溶液,向其中滴加
溶液,向其中滴加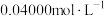 酸性
酸性 溶液至恰好反应,消耗酸性
溶液至恰好反应,消耗酸性 溶液
溶液 。
。已知杂质不参加反应,实验过程中发生的反应为
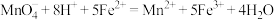 。
。①实验室由绿矾晶体配制
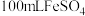 溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、
溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、②步骤ⅰ中,若用含氧气的蒸馏水配制溶液,导致测定的硫酸亚铁晶体的质量分数
③该样品中
 晶体的质量分数为
晶体的质量分数为
您最近一年使用:0次
2020·四川绵阳·二模
名校
解题方法
3 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
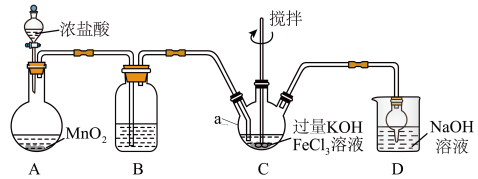
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和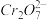 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
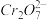 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
698次组卷
|
8卷引用:实验综合题
(已下线)实验综合题2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略
4 . 由下列操作与现象推出的相应结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 光束通过蛋白质溶液 | 产生光亮通路 | 蛋白质溶液属于胶体 |
| B | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已变质 |
| C | 向某溶液中加入盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中不一定含有SO42﹣ |
| D | 测定0.1mol•L﹣1和0.01mol•L﹣1的醋酸溶液导电性 | 前者导电性更强 | 浓度越大,醋酸电离程度越大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-06更新
|
286次组卷
|
3卷引用:海南省海口市2020届高三6月等级模拟试卷化学试题
2020·天津·二模
解题方法
5 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2,某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度,回答下列问题:
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。___ ,装置B中除杂质所用试剂是___ 。
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为___ ,反应中KOH必须过量的原因是___ 。
(3)写出C中总反应的离子方程式___ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
(4)根据以上数据,样品中K2FeO4的质量分数为___ 。(K2FeO4摩尔质量为198g∙mol−1)若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___ 。(填“偏高”、“偏低”或“无影响”)。
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。
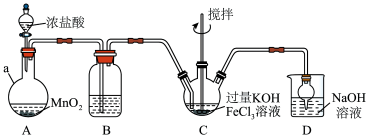
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(3)写出C中总反应的离子方程式
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。(4)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为_______ 。
(2)X中发生反应的离子方程式为_______ 。
(3)装置的连接顺序为A→_______ →B。
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是_______ 。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为_______ 。
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
则该氧化还原滴定指示剂为_______ ,该样品中钴元素的质量分数为_______ 。
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为
(2)X中发生反应的离子方程式为
(3)装置的连接顺序为A→
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O
 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为
您最近一年使用:0次
2022-10-31更新
|
331次组卷
|
2卷引用:海南省琼海市嘉积中学2022-2023学年高三上学期期中检测化学试题
名校
解题方法
7 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,请回答下列问题:
I.某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
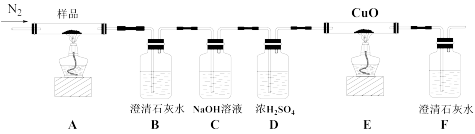
(1)通入氮气的目的是_____ 。
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 和_____ 。
(3)为防止倒吸,停止实验时应进行的操作是____ 。
(4)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:_ 。
II.测定三草酸合铁酸钾中铁的含量。
(5)称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol∙L−1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液(装液)的前一步,应进行的操作为____ 。滴定终点的现象是___ 。
(6)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol∙L−1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为___ 。若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则测定结果____ (填“偏高”或“偏低”)。
(7)过滤、洗涤实验操作过程需要的玻璃仪器有____ 。
I.某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

(1)通入氮气的目的是
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
(3)为防止倒吸,停止实验时应进行的操作是
(4)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
II.测定三草酸合铁酸钾中铁的含量。
(5)称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol∙L−1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液(装液)的前一步,应进行的操作为
(6)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol∙L−1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为
(7)过滤、洗涤实验操作过程需要的玻璃仪器有
您最近一年使用:0次
2021-09-07更新
|
261次组卷
|
2卷引用:2021年海南高考化学试题变式题11-19
8 . 某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:________________________ 。
(2)甲同学认为方案1得到的结论不正确,其理由是____________________ 。
(3)钠在二氧化碳中燃烧的化学方程式为______________________________ 。
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:__________ 。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
(1)写出金属镁与二氧化碳反应的化学方程式:
(2)甲同学认为方案1得到的结论不正确,其理由是
(3)钠在二氧化碳中燃烧的化学方程式为
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:
您最近一年使用:0次
2016-12-09更新
|
164次组卷
|
2卷引用:2016届江汉油田海南海政学校高三月考化学试卷



