名校
解题方法
1 . 某科研小组对乙醛与新制Cu(OH)2反应的实验进行探究。文献资料:
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O Cu+Cu2+。
Cu+Cu2+。
Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
(1)实验ⅰ中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4的化学方程式___________ 。
(2)实验ⅰ、ⅱ、ⅲ中,实验___________ 的新制Cu(OH)2浊液与乙醛反应生成了Cu2O。
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
① 由实验ⅳ的现象推测:实验ⅱ的黑色沉淀是___________ 。
② 实验ⅴ能够产生砖红色沉淀的原因是___________ (结合微粒符号解释),写出实验ⅴ中该微粒与乙醛发生反应的方程式___________ 。
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:___________ ,加热,无色溶液先变为亮黄色,逐渐加深为橙黄色。
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式___________ 。
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是___________ 。
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ | 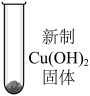 | 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
您最近一年使用:0次
2023-07-10更新
|
141次组卷
|
2卷引用:北京市石景山区2022-2023学年高二下学期期末考试化学试题
2 . 在众多的新能源中,氢能将会成为21世纪最理想的能源。
Ⅰ. 已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
(1)H2燃烧的热化学方程式是_____________________ 。
(2)H2可以代替原煤和汽油作为新能源的依据是_____________________ 。
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是_____________ 。
Ⅱ. 如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。
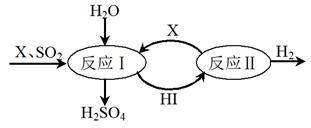
请回答:
(1)该过程可循环利用的物质是_______________ (写化学式)。
(2)该过程总反应的化学方程式是_____________________ 。
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):
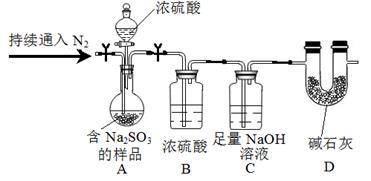
① 装置B的作用是____________ 。
② 测定样品中Na2SO3的质量分数所需的数据是_____________ 。
Ⅰ. 已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(1)H2燃烧的热化学方程式是
(2)H2可以代替原煤和汽油作为新能源的依据是
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是
Ⅱ. 如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。

请回答:
(1)该过程可循环利用的物质是
(2)该过程总反应的化学方程式是
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):

① 装置B的作用是
② 测定样品中Na2SO3的质量分数所需的数据是
您最近一年使用:0次
名校
解题方法
3 . 某烧碱样品因部分变质含Na2CO3。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
【资料】常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色 8.2<pH<10浅红色 pH>10红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4黄色
【实验步骤】
I、迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ、将0.1000mol/LHCl标准溶液装入酸式滴定管,调0,记录起始读数V0;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数。重复上述操作两次,记录数据如下:
(1)烧碱样品变质的原因(用化学方程式表示)______________ 。
(2)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和______________ 。
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是______________ 。
(4)滴定至第一终点的过程中,发生反应的离子方程式为______________ 。
(5)判断滴定至第二终点的现象是溶液由_____________ 色变为橙色,且半分钟不再变化。
(6)样品中NaOH的质量分数w(NaOH)=______________ 。(计算结果保留小数点后1位)
(7)下列操作会导致测得的NaOH质量分数偏高的是______________ (填字母序号)。
a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数时,俯视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
【资料】常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色 8.2<pH<10浅红色 pH>10红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4黄色
【实验步骤】
I、迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ、将0.1000mol/LHCl标准溶液装入酸式滴定管,调0,记录起始读数V0;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数。重复上述操作两次,记录数据如下:
| 实验序号 | 1 | 2 | 3 |
| V0/mL | 0.00 | 0.00 | 0.00 |
| V1/mL | 21.72 | 21.68 | 21.70 |
| V2/mL | 23.72 | 23.68 | 23.70 |
(1)烧碱样品变质的原因(用化学方程式表示)
(2)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是
(4)滴定至第一终点的过程中,发生反应的离子方程式为
(5)判断滴定至第二终点的现象是溶液由
(6)样品中NaOH的质量分数w(NaOH)=
(7)下列操作会导致测得的NaOH质量分数偏高的是
a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数时,俯视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
您最近一年使用:0次
名校
4 . 某烧碱样品因部分变质含 ,某化学课外小组的同学测定该烧碱样品中NaOH的质量分数。
,某化学课外小组的同学测定该烧碱样品中NaOH的质量分数。
实验步骤:
Ⅰ.迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ.取20.00mL样品溶液于锥形瓶中,加入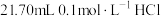 标准溶液,此时溶质为NaCl和
标准溶液,此时溶质为NaCl和 。
。
Ⅲ.继续加入 标准溶液,此时溶质为NaCl。
标准溶液,此时溶质为NaCl。
(1)步骤Ⅰ中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和___________ 。
(2)步骤Ⅱ、步骤Ⅲ中发生反应的离子方程式为___________ 、___________ 、___________ 。
(3)样品中NaOH的质量分数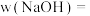
___________ %。(计算结果保留小数点后1位)
(4)下列操作会导致测得的NaOH质量分数偏高的是___________ (填字母序号)。
a.步骤Ⅰ,定容时俯视刻度线
b.步骤Ⅱ,加入HCl标准溶液时锥形瓶中有气泡产生
c.步骤Ⅲ,加入HCl标准溶液的过程中,锥形瓶中有少许液体溅出
 ,某化学课外小组的同学测定该烧碱样品中NaOH的质量分数。
,某化学课外小组的同学测定该烧碱样品中NaOH的质量分数。实验步骤:
Ⅰ.迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ.取20.00mL样品溶液于锥形瓶中,加入
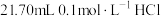 标准溶液,此时溶质为NaCl和
标准溶液,此时溶质为NaCl和 。
。Ⅲ.继续加入
 标准溶液,此时溶质为NaCl。
标准溶液,此时溶质为NaCl。(1)步骤Ⅰ中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(2)步骤Ⅱ、步骤Ⅲ中发生反应的离子方程式为
(3)样品中NaOH的质量分数
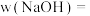
(4)下列操作会导致测得的NaOH质量分数偏高的是
a.步骤Ⅰ,定容时俯视刻度线
b.步骤Ⅱ,加入HCl标准溶液时锥形瓶中有气泡产生
c.步骤Ⅲ,加入HCl标准溶液的过程中,锥形瓶中有少许液体溅出
您最近一年使用:0次
名校
5 . 某烧碱样品因部分变质含 。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
【资料】常用的酸碱指示剂及其变色范围如下:
酚酞: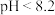 无色
无色 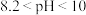 浅红色
浅红色 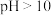 红色
红色
甲基橙: 红色
红色 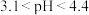 橙色
橙色  黄色
黄色
【实验步骤】
Ⅰ.迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ.将0.1000mol/LHCl标准溶液装入酸式滴定管,调零,记录起始读数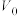 ;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和
;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和 ),记录酸式滴定管的读数
),记录酸式滴定管的读数 ;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数
;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数 。重复上述操作两次,记录数据如下:
。重复上述操作两次,记录数据如下:
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和_____ 。
(2)样品溶液中水的电离程度比相同pH的NaOH溶液中的_____ (选填“大”、“小”或“相等”)
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是_____ 。
(4)滴定至第一终点的过程中,发生反应的离子方程式为_____ 。
(5)判断滴定至第二终点的现象是溶液由_____ 色变为橙色。
(6)样品中NaOH的质量分数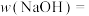
_____ %。(计算结果保留小数点后1位)
(7)下列操作会导致测得的NaOH质量分数偏高的是_____ (填字母序号)。
a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数V₁时,俯视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
(8)用上述方法对其它5种试样进行测试,根据表中给出 、
、 的数值,判断原混合物的成分(用化学式表示)。
的数值,判断原混合物的成分(用化学式表示)。
 。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。【资料】常用的酸碱指示剂及其变色范围如下:
酚酞:
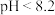 无色
无色 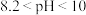 浅红色
浅红色 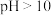 红色
红色甲基橙:
 红色
红色 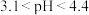 橙色
橙色  黄色
黄色【实验步骤】
Ⅰ.迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ.将0.1000mol/LHCl标准溶液装入酸式滴定管,调零,记录起始读数
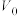 ;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和
;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和 ),记录酸式滴定管的读数
),记录酸式滴定管的读数 ;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数
;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数 。重复上述操作两次,记录数据如下:
。重复上述操作两次,记录数据如下: | 实验序号 | 1 | 2 | 3 |
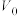 /mL /mL | 0.00 | 0.00 | 0.00 |
 /mL /mL | 21.72 | 21.68 | 21.70 |
 /mL /mL | 23.72 | 23.68 | 23.70 |
(2)样品溶液中水的电离程度比相同pH的NaOH溶液中的
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是
(4)滴定至第一终点的过程中,发生反应的离子方程式为
(5)判断滴定至第二终点的现象是溶液由
(6)样品中NaOH的质量分数
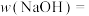
(7)下列操作会导致测得的NaOH质量分数偏高的是
a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数V₁时,俯视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
(8)用上述方法对其它5种试样进行测试,根据表中给出
 、
、 的数值,判断原混合物的成分(用化学式表示)。
的数值,判断原混合物的成分(用化学式表示)。| 式样 | ① | ② | ③ | ④ | ⑤ |
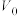 、 、 和 和 | 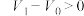 , ,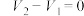 | 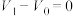 , ,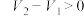 | 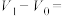 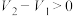 | 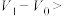 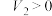 | 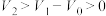 |
| 式样成分 | NaOH |   |
您最近一年使用:0次
名校
解题方法
6 . 某烧碱样品因部分变质含Na2CO3,某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
【资料】常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色 8.2<pH<10浅红色 pH>10红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4黄色
【实验步骤】
Ⅰ.迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ.将0.1000mol/LHCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2,重复上述操作两次,记录数据如下:
(1)步骤Ⅰ中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL___________ 。
(2)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是___________ 。
(3)滴定至第一终点的过程中,发生反应的离子方程式为___________ 。
(4)判断滴定至第二终点的现象是溶液由___________ 色变为橙色。
(5)样品中NaOH的质量分数为___________ %。(计算结果保留小数点后1位)
(6)下列操作会导致测得的NaOH质量分数偏高的是___________ (填字母序号)。
a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数 时,俯视标准液液面
时,俯视标准液液面
c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
【资料】常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色 8.2<pH<10浅红色 pH>10红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4黄色
【实验步骤】
Ⅰ.迅速地称取烧碱样品0.50g,溶解后配制成100mL溶液,备用。
Ⅱ.将0.1000mol/LHCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取20.00mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2,重复上述操作两次,记录数据如下:
| 实验序号 | 1 | 2 | 3 |
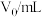 | 0.00 | 0.00 | 0.00 |
 | 21.72 | 21.68 | 21.70 |
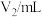 | 23.72 | 23.68 | 23.70 |
(2)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是
(3)滴定至第一终点的过程中,发生反应的离子方程式为
(4)判断滴定至第二终点的现象是溶液由
(5)样品中NaOH的质量分数为
(6)下列操作会导致测得的NaOH质量分数偏高的是
a.达到第一终点前,锥形瓶中有气泡产生
b.记录酸式滴定管读数
 时,俯视标准液液面
时,俯视标准液液面c.第一终点后继续滴定时,锥形瓶中有少许液体溅出
您最近一年使用:0次
7 . Na2O2是一种重要的氧化剂与供氧剂。
(一)研究Na2O2与水的反应。取一定量Na2O2,加入足量的水,充分反应。
(1)Na2O2的电子式是____ ;反应的化学方程式是____ 。
(2)收集并测量生成O2的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.Na2O2+2H2O=2NaOH+H2O2
ii.Na2O2+H2O=NaOH+NaHO2
b.与H2O2类似,NaHO2也能在MnO2催化的条件下分解生成O2
2NaHO2 2NaOH+O2↑
2NaOH+O2↑
MnO2催化H2O2分解的化学方程式是____ 。
②依据资料设计如下实验:取0.02molNa2O2与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量MnO2,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
已知:溶液中c(OH-)越大,溶液pH越大
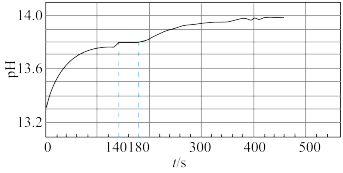
①小组同学根据pH的变化判断反应过程中一定发生反应ii,判断的理由是____ 。
根据140s-180s的pH计算出溶液的c(OH-)为0.6mol/L,则此时段内溶液中n(NaHO2)为____ 。
③由上述实验得出的结论是____ 。
(二)Na2O2空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置的Na2O2的纯度。
向反应容器中加入一定质量的样品,____,再加入足量的水,收集产生的气体并测量体积(折合到标准状况),计算过氧化钠的纯度。
(3)补全上述实验方案____ 。
(4)与水类似,硫酸也能与过氧化钠发生类似反应,若用过量硫酸溶液替代上述方案中的一定量的水,其他测定条件不变,则测量结果会____ (填“偏大”、“偏小”或“不变”)。
(一)研究Na2O2与水的反应。取一定量Na2O2,加入足量的水,充分反应。
(1)Na2O2的电子式是
(2)收集并测量生成O2的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下实验。
查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
i.Na2O2+2H2O=2NaOH+H2O2
ii.Na2O2+H2O=NaOH+NaHO2
b.与H2O2类似,NaHO2也能在MnO2催化的条件下分解生成O2
2NaHO2
 2NaOH+O2↑
2NaOH+O2↑MnO2催化H2O2分解的化学方程式是
②依据资料设计如下实验:取0.02molNa2O2与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量MnO2,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化图所示。
已知:溶液中c(OH-)越大,溶液pH越大

①小组同学根据pH的变化判断反应过程中一定发生反应ii,判断的理由是
根据140s-180s的pH计算出溶液的c(OH-)为0.6mol/L,则此时段内溶液中n(NaHO2)为
③由上述实验得出的结论是
(二)Na2O2空气中容易变质。某小组结合(一)的研究设计如下实验测定某久置的Na2O2的纯度。
向反应容器中加入一定质量的样品,____,再加入足量的水,收集产生的气体并测量体积(折合到标准状况),计算过氧化钠的纯度。
(3)补全上述实验方案
(4)与水类似,硫酸也能与过氧化钠发生类似反应,若用过量硫酸溶液替代上述方案中的一定量的水,其他测定条件不变,则测量结果会
您最近一年使用:0次
22-23高一下·重庆·期末
解题方法
8 . 硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为 )为原料生产
)为原料生产 和
和 。
。
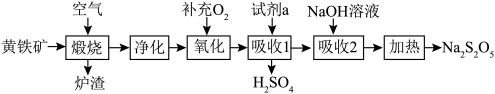
请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ ;试剂a为___________ 。
(2)若要增大煅烧过程的反应速率,应采取的措施是___________ (写两条即可)。
(3)煅烧时主要反应的化学方程式为___________ 。
(4)“氧化”时,反应的化学方程式为___________ 。
(5) 可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中 的含量。请配平其反应的化学方程式:
的含量。请配平其反应的化学方程式:_________
______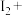 _______
_______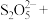 _______
_______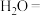 ________
________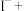 ______
______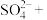 ___________
___________
若要检验 是否变质生成了
是否变质生成了 ,所用的试剂是
,所用的试剂是___________ 。
(6)在测定某葡萄酒中 的含量时,取
的含量时,取 葡萄酒样品,消耗
葡萄酒样品,消耗 碘标准液
碘标准液 。样品中
。样品中 的含量为
的含量为___________  。
。
 )为原料生产
)为原料生产 和
和 。
。
请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)若要增大煅烧过程的反应速率,应采取的措施是
(3)煅烧时主要反应的化学方程式为
(4)“氧化”时,反应的化学方程式为
(5)
 可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中 的含量。请配平其反应的化学方程式:
的含量。请配平其反应的化学方程式:______
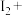 _______
_______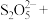 _______
_______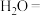 ________
________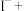 ______
______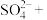 ___________
___________
若要检验
 是否变质生成了
是否变质生成了 ,所用的试剂是
,所用的试剂是(6)在测定某葡萄酒中
 的含量时,取
的含量时,取 葡萄酒样品,消耗
葡萄酒样品,消耗 碘标准液
碘标准液 。样品中
。样品中 的含量为
的含量为 。
。
您最近一年使用:0次
21-22高一下·广东广州·期中
9 . 亚硫酸钠(Na2SO3)是印染工业中常用的脱氧剂和漂白剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:___________
(2)SO2可以与H2S反应,请写出其化学方程式:___________ 。
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(4)(Ga)与A1同主族,化学性质相似,是制造半导体材料氮化镓的重要原料,其中电解NaGaO2是获得Ga单质的重要方法,如图所示,则阴极的电极反应为:___________ 。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为 ___________ L。

(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:
(2)SO2可以与H2S反应,请写出其化学方程式:
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解,得到无色溶液 | / |
| II | 取实验I的溶液, | 样品存在氧化变质 | |
| III | 另取实验I的溶液, | 样品并未完全氧化变质 |

您最近一年使用:0次
解题方法
10 . 化学小组欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为FeC4H4O4)是否已变质,实验如下:
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色。
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色;再滴入3滴H2O2溶液,溶液红色加深。
Ⅲ.准确量取Ⅰ中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g。
Ⅳ.再准确量取Ⅰ中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)Ⅰ中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4___________ HCl(填“>”或“<”)。
(2)用离子方程式解释Ⅱ中实验现象产生的原因:___________ 、Fe3++3SCN−=Fe(SCN)3。
(3)Ⅳ中发生反应的离子方程式是___________ 。
(4)该补铁药中琥珀酸亚铁变质程度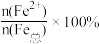 =
=___________ 。
(5)Ⅳ中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是___________ 。
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色。
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色;再滴入3滴H2O2溶液,溶液红色加深。
Ⅲ.准确量取Ⅰ中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g。
Ⅳ.再准确量取Ⅰ中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)Ⅰ中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4
(2)用离子方程式解释Ⅱ中实验现象产生的原因:
(3)Ⅳ中发生反应的离子方程式是
(4)该补铁药中琥珀酸亚铁变质程度
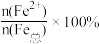 =
=(5)Ⅳ中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是
您最近一年使用:0次



