1 . 已知木炭还原氧化铜实验中发生的主要反应:C+2CuO 2Cu+CO2↑。
2Cu+CO2↑。
某化学实验小组对该实验产物(假设已完全反应)进行了下探究:
探究一:检验产物的成分
[提出问题]实验产物是暗红色固体,很难观察到紫红色固体。而该暗红色固体是什么?
[查阅资料]氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
[猜想假设]暗红色固体除铜外还可能含有Cu2O。
[设计实验]
(1)取少量暗红色固体,加入稀硫酸,如果观察到___________ ,说明猜想正确。
探究二:测定产物中Cu2O的含量。
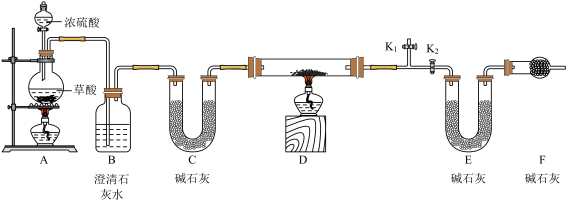
[查阅资料]草酸在浓硫酸的作用下会分解为CO和CO2。
[设计实验]称取固体样品6.0g,置于上图装置D中进行实验(固定装置已略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(2)证明草酸的分解产物中有CO2存在的是___________ 。
(3)装置C的作用是___________ 。
(4)写出装置D中反应的化学方程式___________ 。
(5)下列为加热装置前所涉及的部分操作,正确的顺序是___________ (填序号)。
①检查装置的气密性
②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器
④关闭K1,打开K2
(6)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为___________ 。
 2Cu+CO2↑。
2Cu+CO2↑。某化学实验小组对该实验产物(假设已完全反应)进行了下探究:
探究一:检验产物的成分
[提出问题]实验产物是暗红色固体,很难观察到紫红色固体。而该暗红色固体是什么?
[查阅资料]氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
[猜想假设]暗红色固体除铜外还可能含有Cu2O。
[设计实验]
(1)取少量暗红色固体,加入稀硫酸,如果观察到
探究二:测定产物中Cu2O的含量。

[查阅资料]草酸在浓硫酸的作用下会分解为CO和CO2。
[设计实验]称取固体样品6.0g,置于上图装置D中进行实验(固定装置已略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(2)证明草酸的分解产物中有CO2存在的是
(3)装置C的作用是
(4)写出装置D中反应的化学方程式
(5)下列为加热装置前所涉及的部分操作,正确的顺序是
①检查装置的气密性
②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器
④关闭K1,打开K2
(6)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为
您最近一年使用:0次
2 . 煤化学链技术具有成本低、能耗低的 捕集特性。以铁矿石(主要含铁物质为
捕集特性。以铁矿石(主要含铁物质为 )为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
)为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。

(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是___________ 。
(2)分离燃烧反应器中产生的 (g)和
(g)和 ,可进行
,可进行 高纯捕集和封存,其分离方法是
高纯捕集和封存,其分离方法是___________ 。
(3)测定铁矿石中全部铁元素含量。
i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡( )溶液。
)溶液。
ii.用重铬酸钾( )标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时
)标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时 溶液过量会对测定结果产生影响,分析影响结果及其原因
溶液过量会对测定结果产生影响,分析影响结果及其原因___________ 。
(4)测定燃烧反应后产物中单质铁含量:取a g样品,用 溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
 溶标准液,消耗
溶标准液,消耗 标准液V mL。已知
标准液V mL。已知 被还原为
被还原为 ,样品中单质铁的质量分数为
,样品中单质铁的质量分数为___________ 。
(5)⼯艺中不同价态铁元素含量测定结果如下。
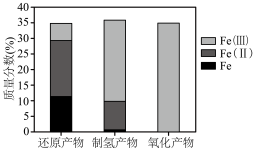
①制氢产物主要为 ,写出蒸汽反应器中发生反应的化学方程式
,写出蒸汽反应器中发生反应的化学方程式___________ 。
②⼯艺中可循环使用的物质是___________ (填化学式)。
 捕集特性。以铁矿石(主要含铁物质为
捕集特性。以铁矿石(主要含铁物质为 )为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
)为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是
(2)分离燃烧反应器中产生的
 (g)和
(g)和 ,可进行
,可进行 高纯捕集和封存,其分离方法是
高纯捕集和封存,其分离方法是(3)测定铁矿石中全部铁元素含量。
i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡(
 )溶液。
)溶液。ii.用重铬酸钾(
 )标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时
)标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时 溶液过量会对测定结果产生影响,分析影响结果及其原因
溶液过量会对测定结果产生影响,分析影响结果及其原因(4)测定燃烧反应后产物中单质铁含量:取a g样品,用
 溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
 溶标准液,消耗
溶标准液,消耗 标准液V mL。已知
标准液V mL。已知 被还原为
被还原为 ,样品中单质铁的质量分数为
,样品中单质铁的质量分数为(5)⼯艺中不同价态铁元素含量测定结果如下。

①制氢产物主要为
 ,写出蒸汽反应器中发生反应的化学方程式
,写出蒸汽反应器中发生反应的化学方程式②⼯艺中可循环使用的物质是
您最近一年使用:0次
名校
解题方法
3 . 研究小组为探究 在空气中变质后的产物,进行如下实验并记录现象。
在空气中变质后的产物,进行如下实验并记录现象。
实验①:取 样品加水溶解,得到澄清溶液a。
样品加水溶解,得到澄清溶液a。
实验②:取少量溶液a,向其中加入过量盐酸,有臭鸡蛋气味的气体生成,且出现淡黄色浑浊。
实验③:将实验②中的浊液过滤,向滤液中加入 溶液,产生白色沉淀。
溶液,产生白色沉淀。
已知信息:i. 溶液能溶解S,并生成
溶液能溶解S,并生成 ,
, 与酸反应生成S和
与酸反应生成S和 (臭鸡蛋气味);ii.
(臭鸡蛋气味);ii. 易溶于水。
易溶于水。
下列说法不正确的是
 在空气中变质后的产物,进行如下实验并记录现象。
在空气中变质后的产物,进行如下实验并记录现象。实验①:取
 样品加水溶解,得到澄清溶液a。
样品加水溶解,得到澄清溶液a。实验②:取少量溶液a,向其中加入过量盐酸,有臭鸡蛋气味的气体生成,且出现淡黄色浑浊。
实验③:将实验②中的浊液过滤,向滤液中加入
 溶液,产生白色沉淀。
溶液,产生白色沉淀。已知信息:i.
 溶液能溶解S,并生成
溶液能溶解S,并生成 ,
, 与酸反应生成S和
与酸反应生成S和 (臭鸡蛋气味);ii.
(臭鸡蛋气味);ii. 易溶于水。
易溶于水。下列说法不正确的是
A.实验②中淡黄色浑浊可能是 与 与 反应产生的 反应产生的 |
B.实验①和实验②说明 样品中一定含有S 样品中一定含有S |
C.实验③中产生的白色沉淀是 |
D. 样品中可能含有 样品中可能含有 |
您最近一年使用:0次
2023-02-09更新
|
693次组卷
|
12卷引用:北京市西城区2021~2022学年高三上学期期末考试化学试题
北京市西城区2021~2022学年高三上学期期末考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)化学-2022年高考押题预测卷01(北京卷)北京市第二中学2022-2023学年高二下学期3月月考化学试题北京交通大学附属中学2023-2024学年高三上学期开学考试化学试题北京市第二中学2023-2024学年高三上学期12月月考化学试题北京市第一○一中学2023-2024学年高三下学期开学考试化学试题(已下线)北京市第四中学2023-2024学年高三下学期一模模拟化学试题河北省五校联盟(保定市第一中学等)2021-2022学年高三下学期3月模拟考试化学试题安徽省示范高中培优联盟 2022-2023学年高二上学期联赛化学试题黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题巩固训练7
名校
4 . Mn及其化合物在工业生产中具有重要的用途。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在_______ (填“阳极”或“阴极”)生成。
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:_______ 。
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。
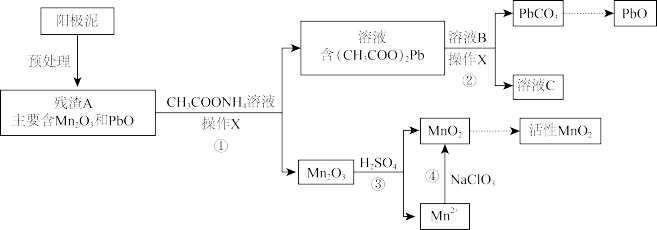
已知:(CH3COO)2Pb在水中难解离。
(3)操作X为_______ 。
(4)①中反应的离子方程式为_______ 。
(5)滤液C能循环使用,②中溶液B的溶质为_______ 。
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为_______ (已知NaClO3的还原产物为NaCl)。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是_______ 。
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5 +2
+2 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=_______ [M(MnO2)=87g·mol-1]。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。

已知:(CH3COO)2Pb在水中难解离。
(3)操作X为
(4)①中反应的离子方程式为
(5)滤液C能循环使用,②中溶液B的溶质为
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+
 +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的
 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5 +2
+2 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)样品中MnO2的质量分数=
您最近一年使用:0次
2022-05-08更新
|
495次组卷
|
4卷引用:北京市东城区2022届高三综合练习(二模)化学试题
5 . 钒是人体生命活动的必需元素,还可用于催化剂和新型电池。制备VOSO4的实验流程及实验装置如图甲(夹持及加热装置已省略)。
V2O5+H2SO4 (VO2)2SO4溶液(橙红色)
(VO2)2SO4溶液(橙红色) VOSO4
VOSO4 VOSO4晶体(纯蓝色)
VOSO4晶体(纯蓝色) VOSO4产品
VOSO4产品
回答下列问题:
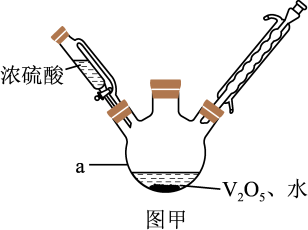
(1)仪器a的名称为_______ ,写出仪器a中发生反应生成(VO2)2SO4的化学方程式_______ 。该反应属于_______ (填“氧化还原反应”或“非氧化还原反应”)。
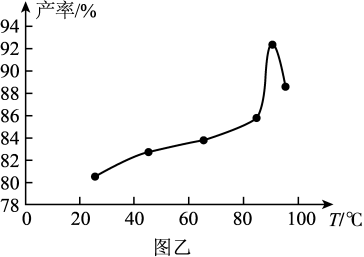
(2)图乙为该反应温度与产物产率间的关系,则最适宜的加热方式为_______ (填“直接加热”或“水浴加热”)。
(3)加入草酸前,反应液需充分冷却并加适量蒸馏水稀释的目的是_______ ;反应液由橙红色变为蓝黑色的离子反应方程式为_______ ;
(4)准确称取上述操作制备的VOSO4产品0.4000g,配制成100mL溶液,用0.0200mol•L-1的酸性KMnO4溶液滴定,滴定终点时,消耗酸性KMnO4溶液的体积为20.00mL,该样品的纯度为_______ (保留三位有效数字)。
(5)钒液流电池具有广阔的应用领域。图丙中钒液流电池隔膜只允许H+通过。电池放电时负极的电极反应式为_______ ,电池充电时阳极的电极反应式为_______ 。

V2O5+H2SO4
 (VO2)2SO4溶液(橙红色)
(VO2)2SO4溶液(橙红色) VOSO4
VOSO4 VOSO4晶体(纯蓝色)
VOSO4晶体(纯蓝色) VOSO4产品
VOSO4产品回答下列问题:

(1)仪器a的名称为
(2)图乙为该反应温度与产物产率间的关系,则最适宜的加热方式为

(3)加入草酸前,反应液需充分冷却并加适量蒸馏水稀释的目的是
(4)准确称取上述操作制备的VOSO4产品0.4000g,配制成100mL溶液,用0.0200mol•L-1的酸性KMnO4溶液滴定,滴定终点时,消耗酸性KMnO4溶液的体积为20.00mL,该样品的纯度为
(5)钒液流电池具有广阔的应用领域。图丙中钒液流电池隔膜只允许H+通过。电池放电时负极的电极反应式为

您最近一年使用:0次
名校
解题方法
6 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
Ⅰ. 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:

(1)生成 的化学方程式是
的化学方程式是_______ 。
(2) 的电离方程式是
的电离方程式是_______ 。
(3)样液中加入 后产生氧气,说明
后产生氧气,说明 与水反应的过程中还生成了
与水反应的过程中还生成了_______ (化学式)。
(4)用该方法制备的 中含有碳酸钠。生成白色沉淀的离子方程式是
中含有碳酸钠。生成白色沉淀的离子方程式是_______ 。
(5)若bg 样品可消耗
样品可消耗 的
的 溶液amL,则该样品的纯度为
溶液amL,则该样品的纯度为_______ 。
Ⅱ.工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如下;
,能溶于水)的工艺流程如下;
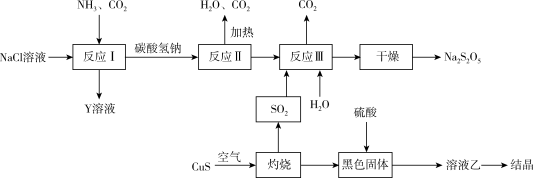
(6)反应Ⅱ的化学方程式是_______ 。
(7)关于上述流程,下列说法不正确的是_______(填字母)。
(8)Y溶液中含有阳离子有 、
、 和离子X。检验离子X的方法是
和离子X。检验离子X的方法是_______ 。
(9)反应Ⅲ包含多步反应:
第一步:……
第二步: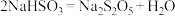
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为_______ 。
(10)已知 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为_______ 。
(11)灼烧的化学方程式为_______ 。
Ⅰ.
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:
(1)生成
 的化学方程式是
的化学方程式是(2)
 的电离方程式是
的电离方程式是(3)样液中加入
 后产生氧气,说明
后产生氧气,说明 与水反应的过程中还生成了
与水反应的过程中还生成了(4)用该方法制备的
 中含有碳酸钠。生成白色沉淀的离子方程式是
中含有碳酸钠。生成白色沉淀的离子方程式是(5)若bg
 样品可消耗
样品可消耗 的
的 溶液amL,则该样品的纯度为
溶液amL,则该样品的纯度为Ⅱ.工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如下;
,能溶于水)的工艺流程如下;
(6)反应Ⅱ的化学方程式是
(7)关于上述流程,下列说法不正确的是_______(填字母)。
A.氨气溶于水使溶液呈碱性的原因是: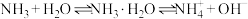 |
| B.反应Ⅰ是置换反应 |
C.该流程中, 可以循环使用 可以循环使用 |
| D.溶液乙的结晶产物是硫酸铜晶体 |
 、
、 和离子X。检验离子X的方法是
和离子X。检验离子X的方法是(9)反应Ⅲ包含多步反应:
第一步:……
第二步:
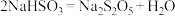
为了减少产品
 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为(10)已知
 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为(11)灼烧的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
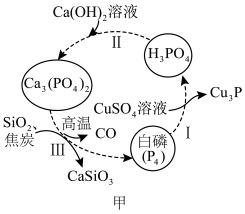
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为___________ ,过程Ⅲ的化学方程式为___________ 。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:
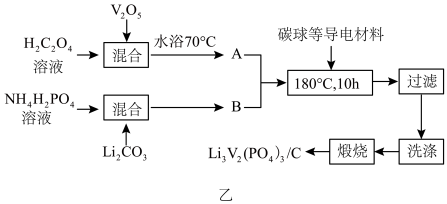
①向复合材料中加入碳单质的作用是___________ 。
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为___________ 。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,___________ ,得到LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤、洗涤、干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用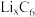 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为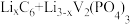 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为___________ 。
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:

①向复合材料中加入碳单质的作用是
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用
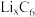 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为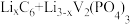 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
您最近一年使用:0次
2022-02-22更新
|
829次组卷
|
6卷引用:二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)河北省衡水中学2021-2022学年高三上学期五调考试化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题河北省新乐市第一中学2023-2024学年上学期高三第一次月考化学试题
名校
解题方法
8 . Cu2(OH)2CO3是用途广泛的化工原料。可用电解废渣[含Cu(NO3)2、AgNO3]和纯碱为原料制备。
(1)制备CuSO4溶液

①过程Ⅰ中,分解产生的气体除NO2外,一定还含有_______ 。
②过程Ⅱ中,分离所采用的试剂是_______ 。
(2)制备Cu2(OH)2CO3
ⅰ.取Na2CO3溶液于锥形瓶中,水浴加热至适当温度。
ⅱ.将CuSO4 溶液逐滴加入到Na2CO3溶液中,产生沉淀,静置。
ⅲ.待沉淀完全沉降后,减压过滤、洗涤、干燥。
①步骤ⅰ中加热Na2CO3溶液的目的是_______ 。
②步骤ⅱ中生成Cu2(OH)2CO3的化学方程式为_______ 。
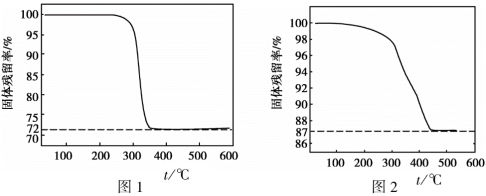
(3)设n(Na2CO3):n(CuSO4)=m,m不同时,所得产物纯度不同。通过测定固体样品的热重分析曲线(样品质量随温度变化曲线),获得固体残留率可检测样品纯度。(已知:固体残留率= ×100%)。
×100%)。
①写出Cu2(OH)2CO3分解的化学方程式_______ 。
②图1、图2分别是m = 1.2和m = 0.8时所得固体的热重分析曲线,依据下列曲线判断制备Cu2(OH)2CO3适宜的m =_______ (填“1.2”或“0.8”)。通过定量分析说明理由:_______ 。
(1)制备CuSO4溶液

①过程Ⅰ中,分解产生的气体除NO2外,一定还含有
②过程Ⅱ中,分离所采用的试剂是
(2)制备Cu2(OH)2CO3
ⅰ.取Na2CO3溶液于锥形瓶中,水浴加热至适当温度。
ⅱ.将CuSO4 溶液逐滴加入到Na2CO3溶液中,产生沉淀,静置。
ⅲ.待沉淀完全沉降后,减压过滤、洗涤、干燥。
①步骤ⅰ中加热Na2CO3溶液的目的是
②步骤ⅱ中生成Cu2(OH)2CO3的化学方程式为
(3)设n(Na2CO3):n(CuSO4)=m,m不同时,所得产物纯度不同。通过测定固体样品的热重分析曲线(样品质量随温度变化曲线),获得固体残留率可检测样品纯度。(已知:固体残留率=
 ×100%)。
×100%)。①写出Cu2(OH)2CO3分解的化学方程式
②图1、图2分别是m = 1.2和m = 0.8时所得固体的热重分析曲线,依据下列曲线判断制备Cu2(OH)2CO3适宜的m =

您最近一年使用:0次
2021-04-05更新
|
393次组卷
|
3卷引用:北京市朝阳区2021届高三一模化学试题
9 . 某课外小组探究硫化钠晶体( Na2S·9H2O)在空气中放置后的氧化产物。取少量在空气中放置一段时间的硫化钠晶体样品,溶于水得到溶液A,测得溶液A的pH为13。
查阅资料:
i.硫化钠晶体在空气中放置后,可能会有Na2Sx、Na2SO3、Na2S2O3等物质生成。
ii.S2-、S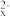 、S2O
、S2O 都不能使品红褪色,SO
都不能使品红褪色,SO 或高浓度OH- 能使品红褪色。
或高浓度OH- 能使品红褪色。
ii. Na2Sx能与H+反应生成H2S(臭鸡蛋气味气体)和S; Na2Sx能与Cu2+反应生成CuS (黑色固体)和S; Na2S2O3可与Cu2+形成可溶性络合物,该络合物对稀盐酸稳定,受热易分解生成棕黑色沉淀。
(1)取未在空气中放置的硫化钠晶体,溶于水后测得溶液显碱性,用离子方程式解释其原因为__________ 。
(2)进行实验一。
①实验一证明氧化产物中有Na2SO3, 其中编号2实验的目的是________________ 。
②某同学由实验结果进一步推测硫化钠晶体的氧化产物中可能还含有Na2SO4,这是因为Na2SO3有____ 性。
(3)进行实验二。
取溶液A于试管中,加入足量的稀盐酸,立即出现淡黄色浑浊,同时产生大量臭鸡蛋气味的气体,离心沉降(固液分离),得到无色溶液B和淡黄色固体。
①取无色溶液B______ (填操作和现象), 证明溶液A中存在SO 。
。
②该实验现象不能证明样品中存在Na2Sx,因为______________ 。
(4)进行实验三。

①证明氧化产物中存在Na2S2O3的证据是_______________ 。
②溶液A中加入CuCl2溶液生成黑色沉淀,可能发生的反应是______ (用离子方程式表示)。
结论:硫化钠晶体在空气中放置后的氧化产物有Na2SO3、Na24SO4、Na2Sx和Na2S2O3。
查阅资料:
i.硫化钠晶体在空气中放置后,可能会有Na2Sx、Na2SO3、Na2S2O3等物质生成。
ii.S2-、S
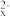 、S2O
、S2O 都不能使品红褪色,SO
都不能使品红褪色,SO 或高浓度OH- 能使品红褪色。
或高浓度OH- 能使品红褪色。ii. Na2Sx能与H+反应生成H2S(臭鸡蛋气味气体)和S; Na2Sx能与Cu2+反应生成CuS (黑色固体)和S; Na2S2O3可与Cu2+形成可溶性络合物,该络合物对稀盐酸稳定,受热易分解生成棕黑色沉淀。
(1)取未在空气中放置的硫化钠晶体,溶于水后测得溶液显碱性,用离子方程式解释其原因为
(2)进行实验一。
 | 编号 | 试剂 | 现象 |
| 1 | 溶液A | 立即褪色 | |
| 2 | pH=13的NaOH溶液 | 无明显变化 |
②某同学由实验结果进一步推测硫化钠晶体的氧化产物中可能还含有Na2SO4,这是因为Na2SO3有
(3)进行实验二。
取溶液A于试管中,加入足量的稀盐酸,立即出现淡黄色浑浊,同时产生大量臭鸡蛋气味的气体,离心沉降(固液分离),得到无色溶液B和淡黄色固体。
①取无色溶液B
 。
。②该实验现象不能证明样品中存在Na2Sx,因为
(4)进行实验三。

①证明氧化产物中存在Na2S2O3的证据是
②溶液A中加入CuCl2溶液生成黑色沉淀,可能发生的反应是
结论:硫化钠晶体在空气中放置后的氧化产物有Na2SO3、Na24SO4、Na2Sx和Na2S2O3。
您最近一年使用:0次
2020-11-06更新
|
233次组卷
|
2卷引用:北京市海淀区2021届高三上学期期中考试化学试题
名校
解题方法
10 . 近年来,FePO4作为制备锂离子电池正极材料LiFePO4的重要原料而成为研究热点。一种以FeCl3、H3PO4、氨水为主要原料制备FePO4的流程如下图。

已知:H3PO4是弱电解质
(1)将FeCl3溶液与H3PO4溶液按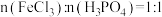 混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
①操作a为______ 。
②生成FePO4·2H2O的离子方程式是______ 。
③控制氨水用量,避免因pH偏高而产生______ 杂质。
(2)测定产物样品中铁元素的质量分数,主要步骤如下:
i.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2(还原剂)至溶液呈浅黄色;
ii.加入TiCl3,恰好将i中残余的少量Fe3+还原为Fe2+;
iii.用c mol·L–1 K2Cr2O7标准溶液滴定Fe2+,消耗v mLK2Cr2O7标准溶液。
①将步骤iii的离子方程式补充完整:
____  +
+____ Fe2++___ =____ Cr3++____ Fe3++____ ;
②产物中铁元素的质量分数为_____ 。

已知:H3PO4是弱电解质
(1)将FeCl3溶液与H3PO4溶液按
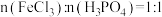 混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。①操作a为
②生成FePO4·2H2O的离子方程式是
③控制氨水用量,避免因pH偏高而产生
(2)测定产物样品中铁元素的质量分数,主要步骤如下:
i.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2(还原剂)至溶液呈浅黄色;
ii.加入TiCl3,恰好将i中残余的少量Fe3+还原为Fe2+;
iii.用c mol·L–1 K2Cr2O7标准溶液滴定Fe2+,消耗v mLK2Cr2O7标准溶液。
①将步骤iii的离子方程式补充完整:
 +
+②产物中铁元素的质量分数为
您最近一年使用:0次
2020-06-13更新
|
350次组卷
|
4卷引用:北京市朝阳区2020届高三第二次学业水平等级性考试化学试题



