名校
解题方法
1 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,请回答下列问题:
I.某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
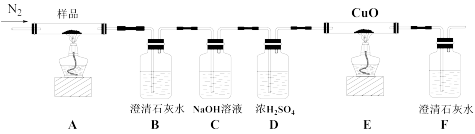
(1)通入氮气的目的是_____ 。
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 和_____ 。
(3)为防止倒吸,停止实验时应进行的操作是____ 。
(4)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:_ 。
II.测定三草酸合铁酸钾中铁的含量。
(5)称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol∙L−1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液(装液)的前一步,应进行的操作为____ 。滴定终点的现象是___ 。
(6)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol∙L−1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为___ 。若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则测定结果____ (填“偏高”或“偏低”)。
(7)过滤、洗涤实验操作过程需要的玻璃仪器有____ 。
I.某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

(1)通入氮气的目的是
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
(3)为防止倒吸,停止实验时应进行的操作是
(4)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
II.测定三草酸合铁酸钾中铁的含量。
(5)称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol∙L−1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液(装液)的前一步,应进行的操作为
(6)向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol∙L−1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该晶体中铁的质量分数的表达式为
(7)过滤、洗涤实验操作过程需要的玻璃仪器有
您最近一年使用:0次
2021-09-07更新
|
261次组卷
|
2卷引用:甘肃省嘉峪关市第一中学2021届高三上学期一模考试化学试卷
名校
2 . 某小组探究三草酸合铁酸钾(K3[Fe(C2O4)3]·3H2O)的热分解产物,按图所示装置进行实验。
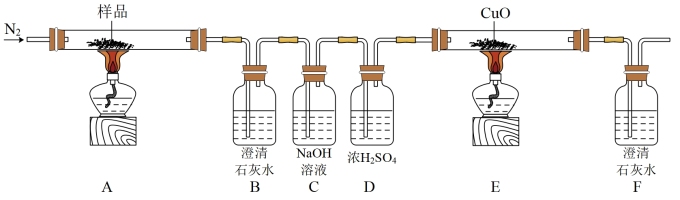
(1)通入N2的目的是___________ 。
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有___________ ,___________ 。
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式___________ 。
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2 =2I-+
=2I-+ )。
)。
①加热除去过量H2O2的目的是___________ 。
②加入KI溶液发生的离子方程式___________ 。
③溶液中铁元素的总含量为___________ g·L-1

(1)通入N2的目的是
(2)实验中观察到装置B变浑浊、E中固体变为红色、F变浑浊,由此可判断分解产物一定有
(3)样品完全分解后,装置A中的残留固体有FeO,Fe2O3和K2O,且FeO与Fe2O3的物质的量之比为2:1.再结合以上信息,写出三草酸合铁酸钾完全分解的化学方程式
(4)为测定Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应,再用0.1000mol∙L-1硫代硫酸钠标准液滴定至终点,消耗标准液20.00mL(已知I2+2
 =2I-+
=2I-+ )。
)。①加热除去过量H2O2的目的是
②加入KI溶液发生的离子方程式
③溶液中铁元素的总含量为
您最近一年使用:0次
2021-10-01更新
|
361次组卷
|
3卷引用:甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题
甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题宁夏银川一中2022届高三第二次月考理科综合化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
解题方法
3 . I.铝和铝合金是一类重要的金属材料。回答下列问题:
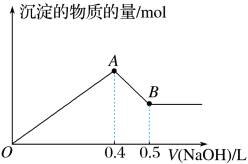
(1)现有 AlCl3和MgSO4混合溶液,向其中不断加入NaOH 溶液,得到沉淀的物质的量与加入NaOH 溶液的体积之间的关系如图所示。原溶液中Cl-与SO 的物质的量之比为
的物质的量之比为______ 。
(2)某同学在实验室用铝土矿(含有Al2O3和SiO2,不考虑其他杂质)制取金属铝的流程如下:
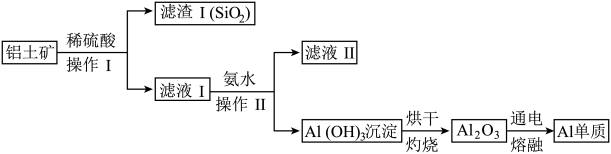
电解熔融的 Al2O3除得到金属铝之外,还可得到的气体产物是_______ (填化学式)。工业上在电解熔融的 Al2O3时,还加入了冰晶石(Na3AlF6)作助熔剂,其作用是降低 Al2O3的熔点。冰晶石在物质的分类中属于________ (填字母)。
a.酸 b.碱 c.盐 d.氧化物
II.镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,已知A可发生如下的一系列变化:
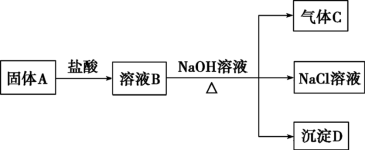
写出下列变化的化学方程式:固体A+盐酸:____________ ;
III.无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备AlCl3,流程如下:
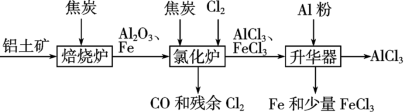
已知:AlCl3、FeCl3分别在183℃、315℃时升华。
(1)实验室配制氯化铝溶液时加入盐酸的目的是__________________ 。
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为_________________ ;
(3)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去):
mg样品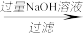 NaAlO2溶液
NaAlO2溶液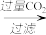 Al(OH)3
Al(OH)3 ngAl2O3
ngAl2O3
计算该样品中AlCl3的质量分数为__________ (结果用m、n表示,不必化简)。
(1)现有 AlCl3和MgSO4混合溶液,向其中不断加入NaOH 溶液,得到沉淀的物质的量与加入NaOH 溶液的体积之间的关系如图所示。原溶液中Cl-与SO
 的物质的量之比为
的物质的量之比为
(2)某同学在实验室用铝土矿(含有Al2O3和SiO2,不考虑其他杂质)制取金属铝的流程如下:

电解熔融的 Al2O3除得到金属铝之外,还可得到的气体产物是
a.酸 b.碱 c.盐 d.氧化物
II.镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在这样的高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,已知A可发生如下的一系列变化:

写出下列变化的化学方程式:固体A+盐酸:
III.无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备AlCl3,流程如下:

已知:AlCl3、FeCl3分别在183℃、315℃时升华。
(1)实验室配制氯化铝溶液时加入盐酸的目的是
(2)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为
(3)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去):
mg样品
 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 ngAl2O3
ngAl2O3计算该样品中AlCl3的质量分数为
您最近一年使用:0次
名校
4 . 次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)在印染、医药以及原子能工业中应用广泛。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
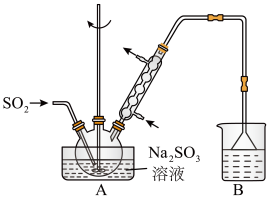
步骤1:在如图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是___ 。
(2)步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:___ 。
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是___ 。
(3)冷凝管中回流的主要物质除H2O外,还有___ (填化学式)。
(4)步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是___ 。
(5)步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,___ ,900℃煅烧。(已知:Zn与铝类似,能与NaOH溶液反应;Zn2+开始沉淀的pH为5.9,沉淀完全的pH为8.9,pH>11时,Zn(OH)2能生成ZnO22-。实验中须使用的试剂有1.0mol•L-1NaOH溶液、1.0mol•L-1HCl溶液、水)
(6)产物组成测定实验:
准确称取1.5400g样品,溶于水配成l00mL溶液;取25.00mL样品溶液经AHMT分光光度法测得溶液吸光度A=0.4000(如图);另取25.00mL样品溶液,加入过量碘水后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到BaSO4固体0.5825g。

①样品溶液HCHO浓度为___ mol•L-1。
②通过计算确定aNaHSO2·bHCHO•cH2O的化学式为___ 。

步骤1:在如图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B的烧杯中应加入的溶液是
(2)步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是
(3)冷凝管中回流的主要物质除H2O外,还有
(4)步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是
(5)步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,
(6)产物组成测定实验:
准确称取1.5400g样品,溶于水配成l00mL溶液;取25.00mL样品溶液经AHMT分光光度法测得溶液吸光度A=0.4000(如图);另取25.00mL样品溶液,加入过量碘水后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到BaSO4固体0.5825g。

①样品溶液HCHO浓度为
②通过计算确定aNaHSO2·bHCHO•cH2O的化学式为
您最近一年使用:0次
2020-06-05更新
|
514次组卷
|
4卷引用:甘肃省兰州市第一中学2020届高三冲刺模拟考试(二)理科综合化学试题
甘肃省兰州市第一中学2020届高三冲刺模拟考试(二)理科综合化学试题福建省厦门市2020届高三毕业班五月质量检查理综化学试题福建省厦门市2020届高三高考化学模拟(5月份)理综化学试题(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编
名校
5 . 用含有少量SiO2、Fe2O3杂质的辉铜矿(主要成分Cu2S)和软锰矿(主要成分MnO2),制备碱式碳酸铜,可进一步制取有机合成中的催化剂氯化亚铜(CuCl),其主要工艺流程如图:

已知:①MnO2能氧化硫化物生成S;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示:
③CuCl是一种白色粉末,难溶于水,可溶于氯离子浓度较大的体系。
(1)浸出液中含有CuSO4和MnSO4等主要产物,写出生成该主要产物的化学方程式:___ 。
(2)实验室中用18.4mol/L的浓硫酸配制480 mL4.5mol/L的硫酸溶液需要使用的玻璃仪器有烧杯、玻璃棒、量筒、___ 、___ 。
(3)沉淀物的主要成分是___ 。
(4)CuCl2溶液中加入Na2SO3溶液的离子反应方程式为___ 。
(5)得到的CuCl晶体需用水洗涤,洗涤CuCl晶体的操作是___ 。
(6)热重分析法是程序控制温度下,测量物质的质量与温度关系的一种实验技术。现取2.50g胆矾样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
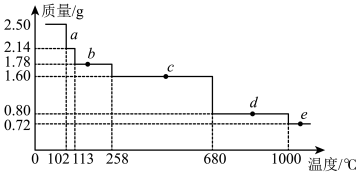
①a点时固体物质的化学式为___ 。
②1000℃时发生反应的化学方程式为___ 。

已知:①MnO2能氧化硫化物生成S;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示:
| 开始沉淀pH | 沉淀完全pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸出液中含有CuSO4和MnSO4等主要产物,写出生成该主要产物的化学方程式:
(2)实验室中用18.4mol/L的浓硫酸配制480 mL4.5mol/L的硫酸溶液需要使用的玻璃仪器有烧杯、玻璃棒、量筒、
(3)沉淀物的主要成分是
(4)CuCl2溶液中加入Na2SO3溶液的离子反应方程式为
(5)得到的CuCl晶体需用水洗涤,洗涤CuCl晶体的操作是
(6)热重分析法是程序控制温度下,测量物质的质量与温度关系的一种实验技术。现取2.50g胆矾样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。

①a点时固体物质的化学式为
②1000℃时发生反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷。三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。

(1)分解得到的气体产物用如下装置进行实验:检查装置气密性后先通一段时间的N2,其目的是_____________ ;为了实验安全,应先点燃___________________ (①或⑤)处的酒精灯;
(2)若③和⑤中分别盛放_____________ 、_______________ 就可检验生成的CO;
(3)分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
【甲】a g样品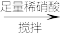 溶液
溶液
 得固体b g
得固体b g
【乙】a g样品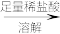 配制250 mL溶液
配制250 mL溶液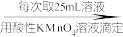 ,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
你认为以上________ (填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是__________ ,不可确定样品组成的方案的理由是____________ 。

(1)分解得到的气体产物用如下装置进行实验:检查装置气密性后先通一段时间的N2,其目的是
(2)若③和⑤中分别盛放
(3)分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
【甲】a g样品
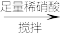 溶液
溶液
 得固体b g
得固体b g【乙】a g样品
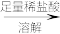 配制250 mL溶液
配制250 mL溶液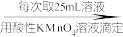 ,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.你认为以上
您最近一年使用:0次
名校
解题方法
7 . 某校实验小组的同学利用下图所示实验装置探究氨与氧化铜的反应(图中夹持、固定装置均略去)。
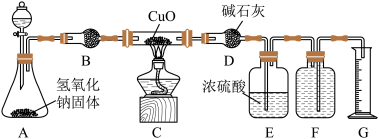
(1)按图设计组装好仪器,先__________________ ,再装入药品。
(2)A中分液漏斗内应装_________________ ,B中固体试剂为__________________ 。
(3)打开分液漏斗活塞,加入试剂,点燃C处的酒精灯,一段时间后,观察到C中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质。写出装置C中反应的化学方程式:______ 。
(4)E中浓硫酸的作用是__________________ 。
(5)用平衡移动原理解释A中产生气体的原因__________________________ 。(用相关的离子方程式和必要的文字描述)
(6)已知Cu2O也是红色的。下表为实验前后C装置的质量,通过计算可知反应后的产物中______ (填“有”、“无”或“无法确定”)Cu2O。

(1)按图设计组装好仪器,先
(2)A中分液漏斗内应装
(3)打开分液漏斗活塞,加入试剂,点燃C处的酒精灯,一段时间后,观察到C中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质。写出装置C中反应的化学方程式:
(4)E中浓硫酸的作用是
(5)用平衡移动原理解释A中产生气体的原因
(6)已知Cu2O也是红色的。下表为实验前后C装置的质量,通过计算可知反应后的产物中
| 空玻璃管 | 实验前(样品+玻璃管) | 实验后(样品+玻璃管) |
| 59.60 g | 65.60g | 64.64g |
您最近一年使用:0次
名校
解题方法
8 . 二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式_______________________________________ 。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O Se+2SO42-+4H+
Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_________________________ 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为__________ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1。写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓)
 2SO2↑+SeO2+2H2O
2SO2↑+SeO2+2H2O2SO2+SeO2+2H2O
 Se+2SO42-+4H+
Se+2SO42-+4H+SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3
 Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3
Se+I2+KNO3+H2O(未配平) ②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI实验中,准确称量SeO2样品0.1500g,消耗0.2000 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
您最近一年使用:0次
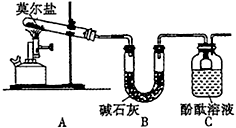
9 . 已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,其摩尔质量为392 g/mol,可溶于水,在100℃~ 110 ℃时分解。为探究其化学组成,甲乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有_____________ 。
(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:
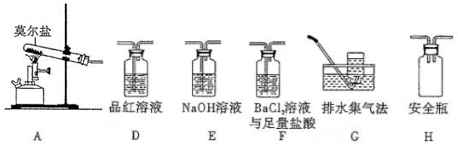
①乙组同学的实验中,装置依次连接的合理顺序为A→H→__________________________ →G
②证明含有SO3的实验现象是_______________ 。
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol•L-1的酸性K2Cr2O7溶液分三次进行滴定。
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。
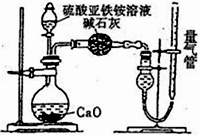
(1)滴定过程中,酸性K2Cr2O7溶液应装在_____________ 滴定管中。甲方案中的离子方程式为_________________________________ 。
(2)乙方案中量气管中最佳试剂是______ (填字母)。
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________________________ 。
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为___________ 。(用含V、m的式子表示)
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有

(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:

①乙组同学的实验中,装置依次连接的合理顺序为A→H→
②证明含有SO3的实验现象是
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol•L-1的酸性K2Cr2O7溶液分三次进行滴定。
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。

(1)滴定过程中,酸性K2Cr2O7溶液应装在
(2)乙方案中量气管中最佳试剂是
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为
您最近一年使用:0次
2018-06-06更新
|
866次组卷
|
3卷引用:甘肃省武威市民勤县第四中学2020-2021学年高二下学期第一次月考化学(实验班)试题
名校
10 . 某研究性学习小组对钠在CO2气体中燃烧进行了下列实验:
(1)若钠着火,可以选用的灭火物质是__________ 。
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(2)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是__________
(3)为确定该白色物质的成分,该小组进行了如下实验:
①通过对上述实验的分析,你认为上述三个假设中,__________ 成立。
②该白色物质的水溶液pH>7,用离子方程式表示其原因:___________________ 。
③钠在CO2中燃烧的化学方程式为______ ;每生成1mol氧化产物,转移的电子数目为_________ 。
| 操作过程 | 实验现象 |
| 将干燥纯净的CO2缓缓通过放有钠的干燥玻璃管(已排尽空气)中,加热 | 钠燃烧,火焰为黄色 |
| 反应后冷却 | 管壁附有黑色颗粒和白色物质 |
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(2)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是
(3)为确定该白色物质的成分,该小组进行了如下实验:
| 实验步骤 | 实验现象 |
| ①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
②该白色物质的水溶液pH>7,用离子方程式表示其原因:
③钠在CO2中燃烧的化学方程式为
您最近一年使用:0次



