1 . 下列实验方案中不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 探究温度对反应速率的影响 | 2支盛有5 mL相同浓度Na2S2O3溶液的试管分别放在不同温度的水槽中,分别向其中加入5mL相同浓度的稀硫酸溶液,观察现象 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后滴加KSCN溶液观察溶液是否变红 |
| C | 配制480mL0.2mol∙L-1CuSO4 | 将25.0 g CuSO4∙5H2O固体加入蒸馏水中配制成500mL溶液 |
| D | 探究碳酸钠溶液中存在水解平衡 | 向一定浓度的Na2CO3溶液滴入酚酞试液,溶液变红,然后滴加BaCl2溶液,可观察到溶液颜色逐渐变浅直至消失 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
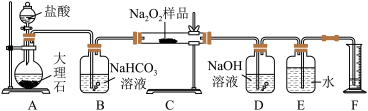
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
551次组卷
|
5卷引用:第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
名校
3 . 氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取
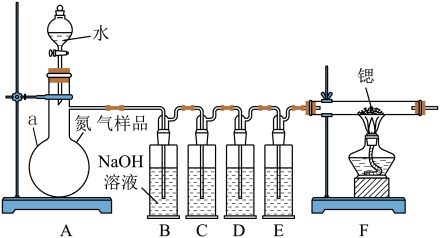
(1)仪器a的名称是__________________ 。
(2)装置C、D、E盛装的试剂分别是_______________ (填代号)。
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案____ 。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)
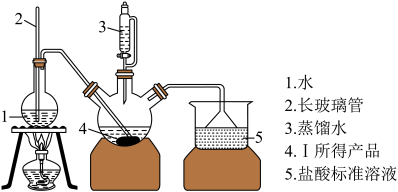
(4)三颈烧瓶中发生反应的化学方程式为_________________________________ 。
(5)装置中长玻璃管的作用原理是_________ 。
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为__________________ 。
(7)产品纯度为_____________ 。(保留三位有效数字)
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是____________ (填字母)。
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取

(1)仪器a的名称是
(2)装置C、D、E盛装的试剂分别是
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)

(4)三颈烧瓶中发生反应的化学方程式为
(5)装置中长玻璃管的作用原理是
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为
(7)产品纯度为
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
您最近一年使用:0次
2020-05-21更新
|
510次组卷
|
3卷引用:专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)重庆市第一中学2020届高三下学期5月月考(全国2)理综化学试题湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题
名校
解题方法
4 . 化学兴趣小组设定以下实验方案,测定某已部分变质为Na2CO3的小苏打样品中NaHCO3的质量分数。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:______________________________
(2)实验中需加热至恒重的目的是:________________________________
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量BaCl2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_________________
(4)该实验过程中发生的离子方程式为_____________________________________
方案三:按如图装置进行实验:

(5)B装置内所盛试剂是______________ ;D装置的作用是_________________ ;分液漏斗中________ (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(6)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为_________________ 。(用百分数表示,保留小数点后一位)
(7)根据此实验测得的数据,与方案一、二测定结果相比明显偏小,因为实验装置还存在一个明显缺陷是:_______________________________________ 。
方案一:称取一定质量样品,置于坩埚中加热至恒重,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:
(2)实验中需加热至恒重的目的是:
方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量BaCl2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为
(4)该实验过程中发生的离子方程式为
方案三:按如图装置进行实验:

(5)B装置内所盛试剂是
(6)实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为
(7)根据此实验测得的数据,与方案一、二测定结果相比明显偏小,因为实验装置还存在一个明显缺陷是:
您最近一年使用:0次
5 . 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
I.制备碳酸亚铁:装置如图所示。

(1)仪器B的名称是_________________________ 。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是:__________ ,然后关闭活塞1,接下来的操作是:______ 。C中发生反应的离子方程式为_____________ 。
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为______ 。为防止乳酸亚铁变质,在上述体系中还应加入____ 。反应结束后,从所得溶液中获得乳酸亚铁晶体的方法是:_________ ,冷却结晶,过滤,_________ ,干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)用K2Cr2O7滴定法测定样品中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液.取25.00mL用0.0167mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___ (以质量分数表示)。
I.制备碳酸亚铁:装置如图所示。

(1)仪器B的名称是
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是:
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)用K2Cr2O7滴定法测定样品中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液.取25.00mL用0.0167mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
6 . 吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
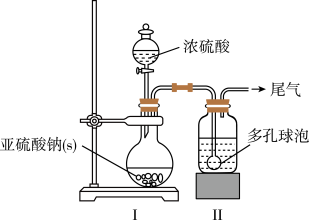
(1)装置Ⅰ中产生气体的化学反应方程式为__ ;Ⅱ中多孔球泡的作用是__ 。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__ 。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。
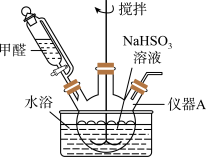
(3)仪器A的名称为___ ;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__ 。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__ 。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__ ;吊白块样品的纯度为__ %(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__ (填“偏高”、“偏低”或“无影响”)
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。

(1)装置Ⅰ中产生气体的化学反应方程式为
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为
(4)将仪器A中的反应温度恒定在80~90℃的目的是
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是
您最近一年使用:0次
2019-12-31更新
|
638次组卷
|
4卷引用:2020届高三《新题速递·化学》1月第02期(考点11-13)
解题方法
7 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2,某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度,回答下列问题:
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。___ ,装置B中除杂质所用试剂是___ 。
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为___ ,反应中KOH必须过量的原因是___ 。
(3)写出C中总反应的离子方程式___ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
(4)根据以上数据,样品中K2FeO4的质量分数为___ 。(K2FeO4摩尔质量为198g∙mol−1)若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___ 。(填“偏高”、“偏低”或“无影响”)。
第一步:制备K2FeO4,装置如图所示,夹持,加热等装置略。
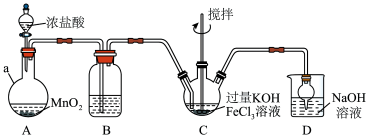
(2)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(3)写出C中总反应的离子方程式
第二步:K2FeO4产品纯度的测定:准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至终点(溶液浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。(4)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
解题方法
8 . 如图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃处为SO2气体发生装置,C处为SO2与O2反应的装置。
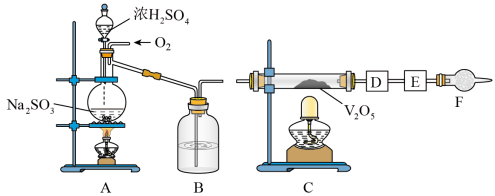
完成下列填空:
(1)A处的化学反应方程式为___ ,所用的硫酸一般为___ (此处填98%的硫酸溶液、70%的硫酸溶液或30%的硫酸溶液)。
(2)根据实验需要,应该在D、E处连接合适的装置。请从图中选择,将所选装置的序号填入相应的空格,D:___ ,E:____ 。
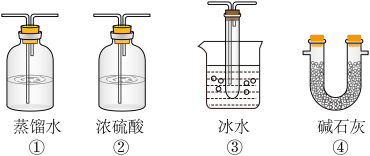
(3)用12.6gNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间 ,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为
,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为____ %。
(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是___ 。
(5)以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是___ 。
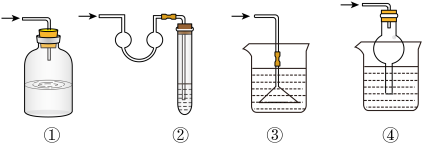

完成下列填空:
(1)A处的化学反应方程式为
(2)根据实验需要,应该在D、E处连接合适的装置。请从图中选择,将所选装置的序号填入相应的空格,D:

(3)用12.6gNa2SO3粉末与足量浓硫酸进行此实验,当A处反应结束时,再继续通入一段时间
 ,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为
,最后测得E处装置增重1.28gSO2,则此时SO2的转化率为(4)若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是
(5)以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是

您最近一年使用:0次
名校
9 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入__________ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用如图装置来测定过氧化钠的质量分数。

①装置中仪器a的名称是_________ ,装置D的作用是________________ ;
②将仪器连接好以后,必须进行的第一步操作是_____________________ ;
③写出装置C中发生主要反应的化学方程式_______________________ ;
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是________ (填序号);
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________ 。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用如图装置来测定过氧化钠的质量分数。

①装置中仪器a的名称是
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生主要反应的化学方程式
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低点相平时读取量筒中水的体积
⑤读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
2020-01-22更新
|
548次组卷
|
5卷引用:2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点21-22)
解题方法
10 . 氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。

Ⅰ.氮化锶的制取
(1)装置B仪器的名称是_____________ 。
(2)装置C、D、E盛装的试剂分别是_____________ (填代号)。
甲.连苯三酚碱性溶液 乙.浓硫酸 丙.醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案____________ 。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200mL1.00mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。(图中夹持装置略)

(4)三颈瓶中发生的化学反应方程式为____________________________ 。
(5)装置中2的作用为__________________________________________ 。
(6)用1.00mol/LNaOH标准溶液滴定过剩的HCl时所选指示剂为_________ (填字母)。
a.石蕊试液 b.酚酞试液 c.甲基橙
(7)产品纯度为____________________ 。
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏高的是_________ (填字母)。
a.滴定时未用NaOH标准溶液润洗滴定管
b.读数时,滴定前平视,滴定后俯视
c.摇动锥形瓶时有液体溅出
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。

Ⅰ.氮化锶的制取
(1)装置B仪器的名称是
(2)装置C、D、E盛装的试剂分别是
甲.连苯三酚碱性溶液 乙.浓硫酸 丙.醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200mL1.00mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00mLNaOH溶液。(图中夹持装置略)

(4)三颈瓶中发生的化学反应方程式为
(5)装置中2的作用为
(6)用1.00mol/LNaOH标准溶液滴定过剩的HCl时所选指示剂为
a.石蕊试液 b.酚酞试液 c.甲基橙
(7)产品纯度为
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏高的是
a.滴定时未用NaOH标准溶液润洗滴定管
b.读数时,滴定前平视,滴定后俯视
c.摇动锥形瓶时有液体溅出
您最近一年使用:0次



