解题方法
1 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| D | 分别向0.1 mol·L-1醋酸和饱和硼酸溶液中滴加0.1mol·L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2015-12-18更新
|
292次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——弱电解质的电离平衡
2 . 三氯化铬是化学合成中的常见物质,三氯化铭易升华,易水解,在高温下能被氧气氧化。制备过程发生的主要反应为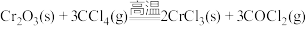 ,
,
已知: (俗称光气)有毒,遇水发生水解
(俗称光气)有毒,遇水发生水解 。
。
三氯化铬制备流程如下:
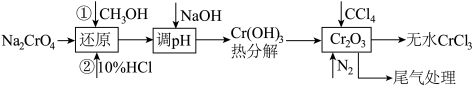
还原反应在图甲中进行,制备过程在图乙中进行。
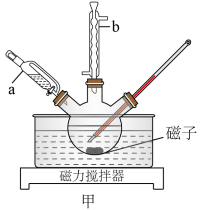

(1)图甲中仪器b的名称为_______ 。
(2)制备 时,向三颈烧瓶中通入
时,向三颈烧瓶中通入 的作用为①
的作用为①_______ ;②鼓气使反应物进入管式炉中进行反应。
(3)无水 的作用是
的作用是_______ 。
(4)装置E用来收集产物,实验过程中若D处出现堵塞,通过_______ (填操作),使实验能继续进行。
(5)G中会生成两种盐,化学式为_______ 。
(6)测定产品中 质量分数的实验步骤如下:
质量分数的实验步骤如下:
步骤I.取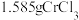 产品在强碱性条件下,加入过量的
产品在强碱性条件下,加入过量的 溶液,小火加热
溶液,小火加热 完全转化为
完全转化为 ,继续加热一段时间。
,继续加热一段时间。
步骤II.滴入适量的浓硫酸和浓磷酸,使 转化为
转化为 ,冷却后加适量的蒸馏水配成
,冷却后加适量的蒸馏水配成 溶液;
溶液;
步骤III.取 溶液,用
溶液,用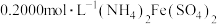 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。
①步骤II中 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
②选用图中_______ (填“甲”或“乙”)盛装标准溶液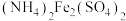 。
。
③产品中 的质量分数为
的质量分数为_______ 。
④若步骤Ⅲ中所用标准溶液已变质,将导致 质量分数测定值
质量分数测定值___ (填“偏高”、“偏低或“无影响”)。
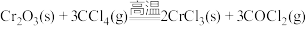 ,
,已知:
 (俗称光气)有毒,遇水发生水解
(俗称光气)有毒,遇水发生水解 。
。三氯化铬制备流程如下:

还原反应在图甲中进行,制备过程在图乙中进行。


(1)图甲中仪器b的名称为
(2)制备
 时,向三颈烧瓶中通入
时,向三颈烧瓶中通入 的作用为①
的作用为①(3)无水
 的作用是
的作用是(4)装置E用来收集产物,实验过程中若D处出现堵塞,通过
(5)G中会生成两种盐,化学式为
(6)测定产品中
 质量分数的实验步骤如下:
质量分数的实验步骤如下:步骤I.取
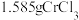 产品在强碱性条件下,加入过量的
产品在强碱性条件下,加入过量的 溶液,小火加热
溶液,小火加热 完全转化为
完全转化为 ,继续加热一段时间。
,继续加热一段时间。步骤II.滴入适量的浓硫酸和浓磷酸,使
 转化为
转化为 ,冷却后加适量的蒸馏水配成
,冷却后加适量的蒸馏水配成 溶液;
溶液;步骤III.取
 溶液,用
溶液,用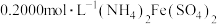 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液 (已知
(已知 被
被 还原为
还原为 )。
)。
①步骤II中
 转化为
转化为 的离子方程式为
的离子方程式为②选用图中
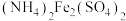 。
。③产品中
 的质量分数为
的质量分数为④若步骤Ⅲ中所用标准溶液已变质,将导致
 质量分数测定值
质量分数测定值
您最近一年使用:0次
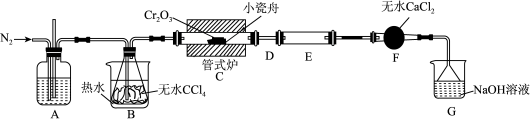
3 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室利用反应Cr2O3(s)+3CCl4 2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。
2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。

已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2将Cr3+氧化为CrO ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+。
还原为Cr3+。
回答下列问题:
(1)A中的试剂为___________ ;无水CaCl2的作用是___________ ;反应结束后继续通入一段时间氮气,主要目的是___________ 。
(2)装置E用来收集产物,实验过程中若D处出现堵塞,可通过___________ (填操作),使实验能继续进行。
(3)装置G中发生反应的离子方程式为___________ 。
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO ,继续加热一段时间;
,继续加热一段时间;
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使CrO 转化为Cr2O
转化为Cr2O ;
;
Ⅲ.用新配制的cmol·L−1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
①产品中CrCl3的质量分数表达式为___________ (写出含m、c、V的表达式)。
②下列操作将导致产品中CrCl3质量分数测定值偏低的是___________ (填标号)。
a.步骤Ⅰ中未继续加热一段时间
b.步骤II用盐酸替代硫酸
c.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
d.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。
2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2将Cr3+氧化为CrO
 ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+。
还原为Cr3+。回答下列问题:
(1)A中的试剂为
(2)装置E用来收集产物,实验过程中若D处出现堵塞,可通过
(3)装置G中发生反应的离子方程式为
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;Ⅱ.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使CrO
 转化为Cr2O
转化为Cr2O ;
;Ⅲ.用新配制的cmol·L−1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。①产品中CrCl3的质量分数表达式为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
a.步骤Ⅰ中未继续加热一段时间
b.步骤II用盐酸替代硫酸
c.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
d.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
名校
解题方法
4 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g) 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为 ;酸性条件下,H2O2将
;酸性条件下,H2O2将 还原为Cr3+。
还原为Cr3+。
请回答下列问题:
(1)A中的试剂为_______ ;无水CaCl2的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)装置G中发生反应的离子方程式为_______ 。
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为 ,继续加热一段时间;
,继续加热一段时间;
II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使 转化为
转化为 ;
;
III.用新配制的cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
①产品中CrCl3质量分数表达式为_______ %。
②下列操作将导致产品中CrCl3质量分数测定值偏低的是_______ (填字母标号)。
A.步骤I中未继续加热一段时间
B.步骤III中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为
 ;酸性条件下,H2O2将
;酸性条件下,H2O2将 还原为Cr3+。
还原为Cr3+。请回答下列问题:
(1)A中的试剂为
(2)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是
(3)装置G中发生反应的离子方程式为
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为
 ,继续加热一段时间;
,继续加热一段时间;II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使
 转化为
转化为 ;
;III.用新配制的cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。①产品中CrCl3质量分数表达式为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
A.步骤I中未继续加热一段时间
B.步骤III中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
2021-06-05更新
|
1281次组卷
|
11卷引用:重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)
(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-测试山东省临沂市2021届高三第一次模拟考试化学试题山东省济南市平阴县第一中学2021届高三下学期3月月考化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅱ卷)(02)(含考试版、答题卡、参考答案、全解全析)山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题四川省成都市第七中学高2022届高三10月阶段考试理综测试化学试题山东省菏泽市单县第二中学2023届高三第一次模拟考试化学试题
5 . 实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。回答下列相关问题:

Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为___ ,消膜泡的作用是__ 。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__ 。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__ 。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I- I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___ 、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为____ (写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值____ (填“偏大”或“偏小”)。为减少实验误差,滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I3-吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为___ 。

Ⅰ.SO2还原CuO的探究
(1)装置B中宜放入的试剂为
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-
 I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值
您最近一年使用:0次
2020-05-27更新
|
635次组卷
|
7卷引用:专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编
(已下线)专题16 化学实验综合题-2020年高考真题和模拟题化学分项汇编(已下线)专题10 化学实验基础——备战2021年高考化学纠错笔记广东省执信中学2020届高三2月月考理科综合化学试题安徽省合肥市2020届高三下学期“停课不停学”线上考试化学试题四川省成都市树德中学2021届高三上学期10月阶段性测理综化学试题四川省眉山市仁寿第二中学2021届高三上学期第四次诊断化学试题河北省武邑中学2021届高三二模化学试题
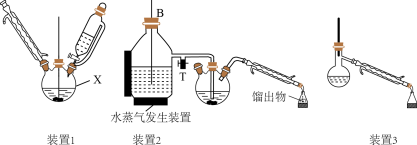
6 . 苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4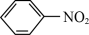 +9Fe+4H2O
+9Fe+4H2O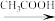 4
4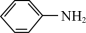 +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__ 。
(2)仪器X的名称是__ ;加入硝基苯时,“逐滴加入”的目的是__ 。
(3)分离提纯过程中加入NaCl固体的作用是__ 。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__ ;装置2中长导管B的作用是__ 。
(5)萃取分液操作过程中要远离明火和热源,原因是__ 。
(6)温度T的范围为__ ,实验结束得到6.0mL产物,则苯胺的产率为__ (保留三位有效数字)。
4
 +9Fe+4H2O
+9Fe+4H2O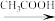 4
4 +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
| 名称 | 密度(g•mL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
| 硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
| 苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
| 乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为
(2)仪器X的名称是
(3)分离提纯过程中加入NaCl固体的作用是
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是
(5)萃取分液操作过程中要远离明火和热源,原因是
(6)温度T的范围为
您最近一年使用:0次
2020-02-03更新
|
571次组卷
|
2卷引用:2020届高考化学二轮复习大题精准训练 ——有机物制备综合实验
7 . 化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
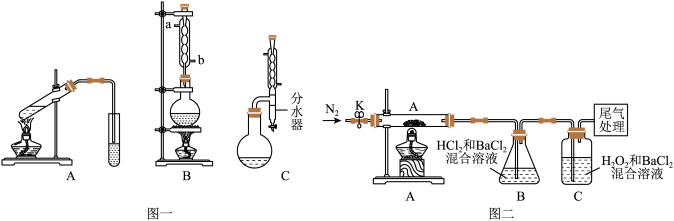
I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______ 口进入;乙同学认为图一中C装置效果更好,理由是_______ 。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________ 不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________ 溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______ (填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________ 。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________ 。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______ 。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______ 。(填序号)

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是
您最近一年使用:0次
2019-09-29更新
|
186次组卷
|
7卷引用:2020届高考化学二轮复习大题精准训练——定量分析实验的探究
8 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
434次组卷
|
7卷引用:专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题作业(十八) 铁盐和亚铁盐河南省南阳市六校2023-2024学年高一上学期12月月考化学试题
2023高三·全国·专题练习
9 . 含硫化合物在生产、生活中应用广泛。
Ⅰ. 可用于染料、医药行业。工业上常用芒硝和煤粉为原料生产
可用于染料、医药行业。工业上常用芒硝和煤粉为原料生产 ,所得粗品中常含有一定量煤灰和重金属硫化物等杂质。已知:
,所得粗品中常含有一定量煤灰和重金属硫化物等杂质。已知: 易溶于热乙醇,重金属硫化物难溶于乙醇;晶粒大小与结晶条件有关,溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶粒就越小,反之可得到较大的晶粒。
易溶于热乙醇,重金属硫化物难溶于乙醇;晶粒大小与结晶条件有关,溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶粒就越小,反之可得到较大的晶粒。
(1)硫元素的原子结构示意图是_______ ,从结构可以知道硫元素在周期表的位置为_______ 。
(2)硫元素在自然界中也有以化合态形式存在的,如许多金属矿石是含硫化合物,如芒硝_______ 。(填化学式)
(3)原料在高温下反应,同时生成CO气体。写出该反应的化学方程式:_______ 。
(4)实验室用乙醇重结晶纯化 粗品,装置如图所示。
粗品,装置如图所示。

①回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是_______ 。
②回流结束后,需进行的操作是先停止加热,_______ ,最后移去水浴。
(5)95℃下回流30min后,立即趁热过滤,使用_______ 接收滤液。
①不用烧杯接收滤液的原因是_______ 。
②滤液经_______ (填字母),过滤后,用95%乙醇洗涤,干燥,得到较高产量颗粒较大的Na2S晶体。
A.蒸发结晶 B.65℃保温结晶 C. 冰水浴冷却结晶
Ⅱ. 可用作还原剂、防腐剂等。研究性学习小组为了准确检测市售银耳中添加剂
可用作还原剂、防腐剂等。研究性学习小组为了准确检测市售银耳中添加剂 的含量,设计如图所示装置进行实验。请补全下面的实验方案:
的含量,设计如图所示装置进行实验。请补全下面的实验方案:
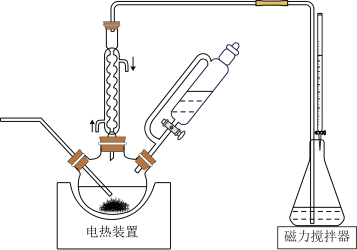
(6)①向三颈烧瓶中加入10.00g银耳样品和400mL水,向锥形瓶中加入125mL水、0.30mL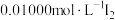 溶液和
溶液和_______ ,向滴液漏斗和滴定管中分别装入_______ 和_______ 。
②接通冷凝水,打开电热装置和磁力搅拌器,_______ 。
③用适量 替代银耳样品,重复上述步骤,测得
替代银耳样品,重复上述步骤,测得 的平均回收率为95%。(可供选择的试剂:
的平均回收率为95%。(可供选择的试剂: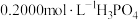 溶液、淀粉溶液、
溶液、淀粉溶液、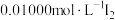 溶液、
溶液、 )
)
Ⅲ.实验小组对部分含硫化合物进行探究。回答下列问题:
(7)小组同学设计了两种制备 的方案。
的方案。
a.70% 溶液与
溶液与 粉末反应;b.Cu粉与浓
粉末反应;b.Cu粉与浓 在加热条件下反应。
在加热条件下反应。
①方案a所涉及的化学方程式为_______ 。
②两种方案相比,方案b的优点为_______ 。
(8)小组同学用如图所示装置检验上述方案b中所有气体产物。

①A中仪器m的名称为_______ ,装置B中盛放的试剂为_______ 。
②按气流方向,上述装置合理的连接顺序为a→_______ →d(填仪器接口的小写字母)。
③装置C中仪器n的作用为_______ 。
④装置D中有什么现象_______ 。
⑤若将制得的 通入
通入 溶液后充分振荡,意外发现有少量白色沉淀产生且溶液的酸性增强,请写出反应的离子方程式:
溶液后充分振荡,意外发现有少量白色沉淀产生且溶液的酸性增强,请写出反应的离子方程式:_______ 。
(9)工业生产过程中产生的尾气需要测定 的含量,符合标准才能排放。已知有
的含量,符合标准才能排放。已知有 (已换算成标准状况)尾气,通入足量
(已换算成标准状况)尾气,通入足量 溶液吸收再加入足量
溶液吸收再加入足量 溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥,称量得到
溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥,称量得到 沉淀。
沉淀。 溶液的作用是
溶液的作用是_______ ;尾气中 含量(体积分数)的计算式是
含量(体积分数)的计算式是_______ (用含V、b的代数式表示)。
(10)小组同学探究 溶液的pH对
溶液的pH对 与
与 反应产物的影响,进行如下实验。
反应产物的影响,进行如下实验。
查阅资料: 为白色难溶于水的固体,能溶于
为白色难溶于水的固体,能溶于 溶液;AgOH为白色难溶于水的固体,易分解,难溶于
溶液;AgOH为白色难溶于水的固体,易分解,难溶于 溶液;
溶液; 为白色固体,微溶于水,不易分解。
为白色固体,微溶于水,不易分解。
步骤一:将一定质量的 配成250mL溶液,并测得溶液的
配成250mL溶液,并测得溶液的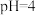 ;将一定质量
;将一定质量 配成250mL溶液,并分成两份,一份用
配成250mL溶液,并分成两份,一份用 将pH调至8,另一份用NaOH溶液将pH调至11;
将pH调至8,另一份用NaOH溶液将pH调至11;
步骤二:将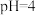 的
的 溶液滴入足量的
溶液滴入足量的 的
的 溶液中,开始产生白色沉淀,后沉淀变为棕黑色。
溶液中,开始产生白色沉淀,后沉淀变为棕黑色。
步骤三:将 的
的 溶液滴入
溶液滴入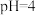 的
的 溶液中,产生白色沉淀。
溶液中,产生白色沉淀。
①步骤一中配置溶液所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要_______ 。
②步骤二中产生的棕黑色沉淀为 ,则该步骤产生的白色沉淀为
,则该步骤产生的白色沉淀为_______ (填化学式)。
③对步骤三中白色沉淀的组成提出假设:i.可能含有 ;ii.可能含有
;ii.可能含有 ;iii.可能含有AgOH。提出假设ⅱ的依据为
;iii.可能含有AgOH。提出假设ⅱ的依据为_______ ;请设计实验方案验证假设ⅰ是否正确:_______ 。
Ⅰ.
 可用于染料、医药行业。工业上常用芒硝和煤粉为原料生产
可用于染料、医药行业。工业上常用芒硝和煤粉为原料生产 ,所得粗品中常含有一定量煤灰和重金属硫化物等杂质。已知:
,所得粗品中常含有一定量煤灰和重金属硫化物等杂质。已知: 易溶于热乙醇,重金属硫化物难溶于乙醇;晶粒大小与结晶条件有关,溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶粒就越小,反之可得到较大的晶粒。
易溶于热乙醇,重金属硫化物难溶于乙醇;晶粒大小与结晶条件有关,溶液的浓度越大,或溶剂的蒸发速度越快,或溶液冷却得越快,析出的晶粒就越小,反之可得到较大的晶粒。(1)硫元素的原子结构示意图是
(2)硫元素在自然界中也有以化合态形式存在的,如许多金属矿石是含硫化合物,如芒硝
(3)原料在高温下反应,同时生成CO气体。写出该反应的化学方程式:
(4)实验室用乙醇重结晶纯化
 粗品,装置如图所示。
粗品,装置如图所示。
①回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是
②回流结束后,需进行的操作是先停止加热,
(5)95℃下回流30min后,立即趁热过滤,使用
①不用烧杯接收滤液的原因是
②滤液经
A.蒸发结晶 B.65℃保温结晶 C. 冰水浴冷却结晶
Ⅱ.
 可用作还原剂、防腐剂等。研究性学习小组为了准确检测市售银耳中添加剂
可用作还原剂、防腐剂等。研究性学习小组为了准确检测市售银耳中添加剂 的含量,设计如图所示装置进行实验。请补全下面的实验方案:
的含量,设计如图所示装置进行实验。请补全下面的实验方案:
(6)①向三颈烧瓶中加入10.00g银耳样品和400mL水,向锥形瓶中加入125mL水、0.30mL
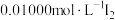 溶液和
溶液和②接通冷凝水,打开电热装置和磁力搅拌器,
③用适量
 替代银耳样品,重复上述步骤,测得
替代银耳样品,重复上述步骤,测得 的平均回收率为95%。(可供选择的试剂:
的平均回收率为95%。(可供选择的试剂: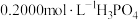 溶液、淀粉溶液、
溶液、淀粉溶液、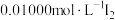 溶液、
溶液、 )
)Ⅲ.实验小组对部分含硫化合物进行探究。回答下列问题:
(7)小组同学设计了两种制备
 的方案。
的方案。a.70%
 溶液与
溶液与 粉末反应;b.Cu粉与浓
粉末反应;b.Cu粉与浓 在加热条件下反应。
在加热条件下反应。①方案a所涉及的化学方程式为
②两种方案相比,方案b的优点为
(8)小组同学用如图所示装置检验上述方案b中所有气体产物。

①A中仪器m的名称为
②按气流方向,上述装置合理的连接顺序为a→
③装置C中仪器n的作用为
④装置D中有什么现象
⑤若将制得的
 通入
通入 溶液后充分振荡,意外发现有少量白色沉淀产生且溶液的酸性增强,请写出反应的离子方程式:
溶液后充分振荡,意外发现有少量白色沉淀产生且溶液的酸性增强,请写出反应的离子方程式:(9)工业生产过程中产生的尾气需要测定
 的含量,符合标准才能排放。已知有
的含量,符合标准才能排放。已知有 (已换算成标准状况)尾气,通入足量
(已换算成标准状况)尾气,通入足量 溶液吸收再加入足量
溶液吸收再加入足量 溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥,称量得到
溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥,称量得到 沉淀。
沉淀。 溶液的作用是
溶液的作用是 含量(体积分数)的计算式是
含量(体积分数)的计算式是(10)小组同学探究
 溶液的pH对
溶液的pH对 与
与 反应产物的影响,进行如下实验。
反应产物的影响,进行如下实验。查阅资料:
 为白色难溶于水的固体,能溶于
为白色难溶于水的固体,能溶于 溶液;AgOH为白色难溶于水的固体,易分解,难溶于
溶液;AgOH为白色难溶于水的固体,易分解,难溶于 溶液;
溶液; 为白色固体,微溶于水,不易分解。
为白色固体,微溶于水,不易分解。步骤一:将一定质量的
 配成250mL溶液,并测得溶液的
配成250mL溶液,并测得溶液的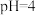 ;将一定质量
;将一定质量 配成250mL溶液,并分成两份,一份用
配成250mL溶液,并分成两份,一份用 将pH调至8,另一份用NaOH溶液将pH调至11;
将pH调至8,另一份用NaOH溶液将pH调至11;步骤二:将
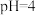 的
的 溶液滴入足量的
溶液滴入足量的 的
的 溶液中,开始产生白色沉淀,后沉淀变为棕黑色。
溶液中,开始产生白色沉淀,后沉淀变为棕黑色。步骤三:将
 的
的 溶液滴入
溶液滴入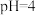 的
的 溶液中,产生白色沉淀。
溶液中,产生白色沉淀。①步骤一中配置溶液所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要
②步骤二中产生的棕黑色沉淀为
 ,则该步骤产生的白色沉淀为
,则该步骤产生的白色沉淀为③对步骤三中白色沉淀的组成提出假设:i.可能含有
 ;ii.可能含有
;ii.可能含有 ;iii.可能含有AgOH。提出假设ⅱ的依据为
;iii.可能含有AgOH。提出假设ⅱ的依据为
您最近一年使用:0次
10 . 实验室中以活性炭为催化剂制备 并测定钴元素的含量。
并测定钴元素的含量。
已知: 是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生
是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生 、
、 ;
; 不易被氧化,
不易被氧化, 有较强还原性。
有较强还原性。
Ⅰ.制备晶体(装置如图1,55℃水浴加热)
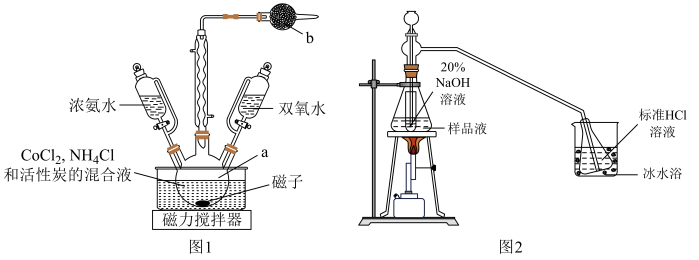
Ⅱ.测定产品 中钴元素的含量(装置如图2)
中钴元素的含量(装置如图2)
称取 样品于锥形瓶中,加水溶解。在另一锥形瓶中加入
样品于锥形瓶中,加水溶解。在另一锥形瓶中加入 标准
标准 溶液并置于冰水浴中,向漏斗中加入足量
溶液并置于冰水浴中,向漏斗中加入足量 的
的 溶液,加热,保持微沸状态一段时间后,取出插入标准
溶液,加热,保持微沸状态一段时间后,取出插入标准 溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准
溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准 溶液的锥形瓶中。取出锥形瓶,加入指示剂,用
溶液的锥形瓶中。取出锥形瓶,加入指示剂,用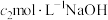 标准溶液滴定剩余的
标准溶液滴定剩余的 ,滴定终点时消耗
,滴定终点时消耗 标准溶液
标准溶液 。
。
回答下列问题:
(1) 制备
制备 的化学方程式为
的化学方程式为___________ 。
(2)仪器a的名称是___________ ;b中的试剂是___________ 。
(3)向 、
、 和活性炭混合液中先加浓氨水目的是
和活性炭混合液中先加浓氨水目的是___________ 。
(4)样品中钴元素的质量分数为___________ (用含 、
、 、
、 、
、 、
、 的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果
的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
(5)① 的空间结构为正八面体,若
的空间结构为正八面体,若 中2个
中2个 被2个
被2个 取代,能得到
取代,能得到___________ 种产物。
②钴(Ⅱ)与氯化钴和氨水以及 反应中若不加活性炭催化剂,可能有
反应中若不加活性炭催化剂,可能有 、
、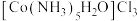 生成。现有
生成。现有 浓度为
浓度为 的
的 或
或 溶液,用
溶液,用 的
的 溶液进行滴定,消耗
溶液进行滴定,消耗 溶液
溶液 ,则该溶液中的溶质为
,则该溶液中的溶质为___________ (填化学式)。
 并测定钴元素的含量。
并测定钴元素的含量。已知:
 是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生
是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生 、
、 ;
; 不易被氧化,
不易被氧化, 有较强还原性。
有较强还原性。Ⅰ.制备晶体(装置如图1,55℃水浴加热)

Ⅱ.测定产品
 中钴元素的含量(装置如图2)
中钴元素的含量(装置如图2)称取
 样品于锥形瓶中,加水溶解。在另一锥形瓶中加入
样品于锥形瓶中,加水溶解。在另一锥形瓶中加入 标准
标准 溶液并置于冰水浴中,向漏斗中加入足量
溶液并置于冰水浴中,向漏斗中加入足量 的
的 溶液,加热,保持微沸状态一段时间后,取出插入标准
溶液,加热,保持微沸状态一段时间后,取出插入标准 溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准
溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准 溶液的锥形瓶中。取出锥形瓶,加入指示剂,用
溶液的锥形瓶中。取出锥形瓶,加入指示剂,用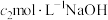 标准溶液滴定剩余的
标准溶液滴定剩余的 ,滴定终点时消耗
,滴定终点时消耗 标准溶液
标准溶液 。
。回答下列问题:
(1)
 制备
制备 的化学方程式为
的化学方程式为(2)仪器a的名称是
(3)向
 、
、 和活性炭混合液中先加浓氨水目的是
和活性炭混合液中先加浓氨水目的是(4)样品中钴元素的质量分数为
 、
、 、
、 、
、 、
、 的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果
的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果(5)①
 的空间结构为正八面体,若
的空间结构为正八面体,若 中2个
中2个 被2个
被2个 取代,能得到
取代,能得到②钴(Ⅱ)与氯化钴和氨水以及
 反应中若不加活性炭催化剂,可能有
反应中若不加活性炭催化剂,可能有 、
、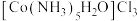 生成。现有
生成。现有 浓度为
浓度为 的
的 或
或 溶液,用
溶液,用 的
的 溶液进行滴定,消耗
溶液进行滴定,消耗 溶液
溶液 ,则该溶液中的溶质为
,则该溶液中的溶质为
您最近一年使用:0次



