1 . 在众多的新能源中,氢能将会成为21世纪最理想的能源。
Ⅰ. 已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
(1)H2燃烧的热化学方程式是_____________________ 。
(2)H2可以代替原煤和汽油作为新能源的依据是_____________________ 。
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是_____________ 。
Ⅱ. 如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。
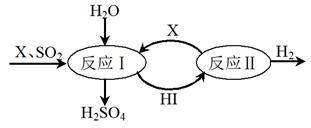
请回答:
(1)该过程可循环利用的物质是_______________ (写化学式)。
(2)该过程总反应的化学方程式是_____________________ 。
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):
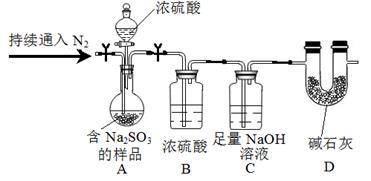
① 装置B的作用是____________ 。
② 测定样品中Na2SO3的质量分数所需的数据是_____________ 。
Ⅰ. 已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(1)H2燃烧的热化学方程式是
(2)H2可以代替原煤和汽油作为新能源的依据是
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是
Ⅱ. 如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。

请回答:
(1)该过程可循环利用的物质是
(2)该过程总反应的化学方程式是
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):

① 装置B的作用是
② 测定样品中Na2SO3的质量分数所需的数据是
您最近一年使用:0次
名校
2 . 下列实验设计能达到实验目的的是
| 选项 | 实验设计 | 实验目的 |
| A | 向NaOH样品中加水后滴加足量稀盐酸,观察是否有气泡冒出 | 检验NaOH样品是否完全变质 |
| B | 将混合气体依次通过足量的无水硫酸铜、浓硫酸、石灰水、氢氧化钠溶液 | 验证并除去氧气中的水蒸气和二氧化碳 |
| C | 将锌片与某金属X粉末分别加入稀硫酸,X与稀硫酸反应产生气泡快 | 证明X的活动性比锌强 |
| D | 先加足量水溶解,再加适量稀盐酸,最后蒸发结晶 | 除去NaCl固体中的少量 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 过氧化钠常作漂白剂、杀菌剂、消毒剂,保存不当容易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,若充分振荡后有白色沉淀,则证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。___________ (填“是”或“否”);请写出 中发生的化学反应方程式
中发生的化学反应方程式___________ 。
②实验结束时,读取实验中生成气体的体积时,不合理的是___________ (填字母)。
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得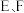 中液面高度相同
中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
③读出量筒内水的体积后,折算成氧气的质量为 ,则样品中过氧化钠的质量分数为
,则样品中过氧化钠的质量分数为___________ (用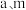 表示)。
表示)。
④实验完成后,E到F之间导管内残留水会使测量结果___________ (填“偏大”“偏小”或“不影响”)。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。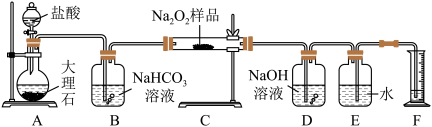
 中发生的化学反应方程式
中发生的化学反应方程式②实验结束时,读取实验中生成气体的体积时,不合理的是
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得
 中液面高度相同
中液面高度相同C.视线与凹液面的最低点相平读取量筒中水的体积
③读出量筒内水的体积后,折算成氧气的质量为
 ,则样品中过氧化钠的质量分数为
,则样品中过氧化钠的质量分数为 表示)。
表示)。④实验完成后,E到F之间导管内残留水会使测量结果
您最近一年使用:0次
解题方法
4 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
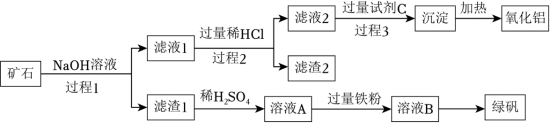
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是___________ 。(答一条)
(2)滤渣1的主要成分是___________ ,举例说明滤渣2的用途___________ 。
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:___________ 。
(4)写出由滤液1生成滤液2的离子方程式___________ 。
(5)用来配制试剂C的物质的电子式为:___________ 。
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为___________ 。
 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是
(2)滤渣1的主要成分是
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:
(4)写出由滤液1生成滤液2的离子方程式
(5)用来配制试剂C的物质的电子式为:
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为
您最近一年使用:0次
名校
5 . 定性分析和定量分析是研究物质的两种重要方法。绿矾( )在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。
)在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。
Ⅰ.定性分析
(1)设计实验检验绿矾样品是否变质:取绿矾晶体样品溶于水配成溶液,取少量溶液于试管中,滴加___________ 溶液(填化学式),溶液变红,说明溶液中有 。另取少量溶液于试管中,滴加几滴酸性
。另取少量溶液于试管中,滴加几滴酸性 溶液,溶液的紫红色褪去,说明溶液中有
溶液,溶液的紫红色褪去,说明溶液中有___________ (填离子符号),以上实验说明绿矾部分变质。
(2)若要使部分变质的 溶液复原,最佳试剂为
溶液复原,最佳试剂为___________ (填化学式)。
Ⅱ.定量分析
(3)为测定绿矾样品中 晶体的质量分数,进行如下实验:
晶体的质量分数,进行如下实验:
步骤ⅱ:准确称取绿矾样品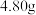 溶于水,配成
溶于水,配成 溶液。
溶液。
步骤ⅱ:取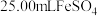 溶液,向其中滴加
溶液,向其中滴加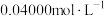 酸性
酸性 溶液至恰好反应,消耗酸性
溶液至恰好反应,消耗酸性 溶液
溶液 。
。
已知杂质不参加反应,实验过程中发生的反应为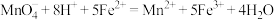 。
。
①实验室由绿矾晶体配制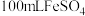 溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、
溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、___________ 。
②步骤ⅰ中,若用含氧气的蒸馏水配制溶液,导致测定的硫酸亚铁晶体的质量分数___________ (填“偏大”或“偏小”)。
③该样品中 晶体的质量分数为
晶体的质量分数为___________ %(结果保留小数点后一位)。
 )在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。
)在空气中易被氧化变质,某兴趣小组从定性、定量角度分析某绿矾样品的变质程度,进行如下实验,回答下列问题。Ⅰ.定性分析
(1)设计实验检验绿矾样品是否变质:取绿矾晶体样品溶于水配成溶液,取少量溶液于试管中,滴加
 。另取少量溶液于试管中,滴加几滴酸性
。另取少量溶液于试管中,滴加几滴酸性 溶液,溶液的紫红色褪去,说明溶液中有
溶液,溶液的紫红色褪去,说明溶液中有(2)若要使部分变质的
 溶液复原,最佳试剂为
溶液复原,最佳试剂为Ⅱ.定量分析
(3)为测定绿矾样品中
 晶体的质量分数,进行如下实验:
晶体的质量分数,进行如下实验:步骤ⅱ:准确称取绿矾样品
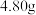 溶于水,配成
溶于水,配成 溶液。
溶液。步骤ⅱ:取
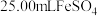 溶液,向其中滴加
溶液,向其中滴加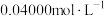 酸性
酸性 溶液至恰好反应,消耗酸性
溶液至恰好反应,消耗酸性 溶液
溶液 。
。已知杂质不参加反应,实验过程中发生的反应为
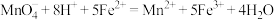 。
。①实验室由绿矾晶体配制
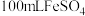 溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、
溶液所需的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、②步骤ⅰ中,若用含氧气的蒸馏水配制溶液,导致测定的硫酸亚铁晶体的质量分数
③该样品中
 晶体的质量分数为
晶体的质量分数为
您最近一年使用:0次
解题方法
6 . 钠的化合物是化工生产与科学研究的重要组成部分。
(1)将Na、 、
、 、NaOH长时间露置在空气中,最终都会变为
、NaOH长时间露置在空气中,最终都会变为______ (填化学式)。
(2)探究某 样品是否已经变质:取少量
样品是否已经变质:取少量 样品,将其溶于水,加入
样品,将其溶于水,加入 溶液,充分振荡后,观察到
溶液,充分振荡后,观察到_______ (填实验现象),则说明 样品已经与空气中的
样品已经与空气中的 发生反应变质。
发生反应变质。
(3)“神舟号”载人航天器的返回舱内,为防止 浓度过大引起宇航员困乏,可用
浓度过大引起宇航员困乏,可用 降低
降低 的浓度,有关反应的化学方程式为
的浓度,有关反应的化学方程式为_______ ;用 (超氧化钾)代替
(超氧化钾)代替 也能达到同样的目的,反应产物也很相似,试计算用
也能达到同样的目的,反应产物也很相似,试计算用 和
和 分别与
分别与 反应,产生等质量的
反应,产生等质量的 ,所需
,所需 和
和 的质量比为
的质量比为_____ (填最简整数比)。
(4)食品工业经常把 和
和 用作膨松剂,室温下向含某膨松剂试样(
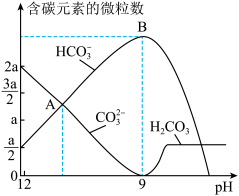
用作膨松剂,室温下向含某膨松剂试样(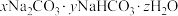 )的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知:
)的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知: 因有逸出未画出;
因有逸出未画出; 与少量盐酸发生下列反应:
与少量盐酸发生下列反应: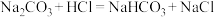 )。
)。
①x:y=____ 。
②图中B点溶液溶质的主要成分为_______ (填化学式),B点后发生反应的离子方程式为______ 。
(1)将Na、
 、
、 、NaOH长时间露置在空气中,最终都会变为
、NaOH长时间露置在空气中,最终都会变为(2)探究某
 样品是否已经变质:取少量
样品是否已经变质:取少量 样品,将其溶于水,加入
样品,将其溶于水,加入 溶液,充分振荡后,观察到
溶液,充分振荡后,观察到 样品已经与空气中的
样品已经与空气中的 发生反应变质。
发生反应变质。(3)“神舟号”载人航天器的返回舱内,为防止
 浓度过大引起宇航员困乏,可用
浓度过大引起宇航员困乏,可用 降低
降低 的浓度,有关反应的化学方程式为
的浓度,有关反应的化学方程式为 (超氧化钾)代替
(超氧化钾)代替 也能达到同样的目的,反应产物也很相似,试计算用
也能达到同样的目的,反应产物也很相似,试计算用 和
和 分别与
分别与 反应,产生等质量的
反应,产生等质量的 ,所需
,所需 和
和 的质量比为
的质量比为(4)食品工业经常把
 和
和 用作膨松剂,室温下向含某膨松剂试样(
用作膨松剂,室温下向含某膨松剂试样(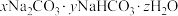 )的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知:
)的溶液中逐滴加入稀盐酸,反应过程中含碳元素的微粒数随pH变化的图像如图所示。(已知: 因有逸出未画出;
因有逸出未画出; 与少量盐酸发生下列反应:
与少量盐酸发生下列反应: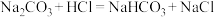 )。
)。①x:y=
②图中B点溶液溶质的主要成分为

您最近一年使用:0次
7 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为___________ 。
②将仪器连接好以后,必须进行的第一步操作是___________ 。
③写出装置C中发生的所有反应的化学方程式___________ 、___________ 。
④D中NaOH溶液的作用___________ 。
⑤实验结束时,读取实验中生成气体的体积时,不合理的是___________ 。
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________ 。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生的所有反应的化学方程式
④D中NaOH溶液的作用
⑤实验结束时,读取实验中生成气体的体积时,不合理的是
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
8 . 合金已成为飞机制造、化工生产等行业的重要材料。某研究性学习小组的同学,为测定某含镁40%~60%的铝镁合金(不含其他元素) 中铝的质量分数,设计下列两种不同的实验方案进行探究。回答下列问题。
方案一:
(1)研究小组同学准备用 NaOH 固体配制240mL1.0 的NaOH溶液。
的NaOH溶液。
①本实验必须用到的玻璃仪器有:量筒、胶头滴管、烧杯、___________ 。
②要配制出此溶液,研究小组同学应用托盘天平称出___________ gNaOH。
③在配制过程中,小组同学的其他操作都是正确的,但下列操作中会引起所配制溶液浓度偏高的是___________ (填字母)。
A. NaOH固体在称量前已部分变质
B. 有少量NaOH溶液残留在烧杯里
C. 定容时,俯视容量瓶的刻度线
D. 定容摇匀后,发现溶液凹液面最低处低于刻度线,用胶头滴管补水至刻度线
(2)称取8.1g 铝镁合金粉末样品,溶于VmL1.0 的NaOH溶液中,充分反应,过滤、洗涤、干燥、称量固体,该步骤中若未洗涤固体,测得铝的质量分数将
的NaOH溶液中,充分反应,过滤、洗涤、干燥、称量固体,该步骤中若未洗涤固体,测得铝的质量分数将___________ (选填“偏高” “偏低”或“不受影响”)。
方案二:
将5.1g 铝镁合金与足量稀硫酸反应,测定生成气体的体积。
(3)同学们拟选用下图实验装置完成实验:
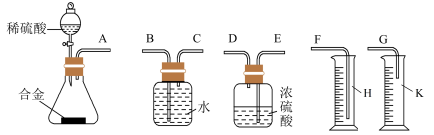
①你认为最简易的装置的连接顺序是:A接______,_______接______,______接______(填接口字母,可不填满)。___________
②实验结束时,在测量实验中生成氢气的体积时,你认为合理的是___________ (填字母)。
A.待实验装置冷却后再读数
B.上下移动量筒H,使其中液面与广口瓶中液面相平
C.视线与凹液面的最低点水平相切,读取量筒中水的体积
D.上下移动量筒K,使其中液面与广口瓶中液面相平
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:
①稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;
②实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小,于是他们设计了如图所示的实验装置:
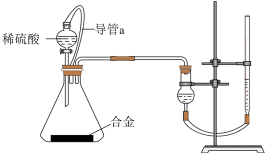
①装置中导管a的作用是___________
②实验后测得生成的氢气在标准状况下的体积为5.6 L,则铝的质量分数为___________ (请保留1位小数) 。
方案一:
(1)研究小组同学准备用 NaOH 固体配制240mL1.0
 的NaOH溶液。
的NaOH溶液。①本实验必须用到的玻璃仪器有:量筒、胶头滴管、烧杯、
②要配制出此溶液,研究小组同学应用托盘天平称出
③在配制过程中,小组同学的其他操作都是正确的,但下列操作中会引起所配制溶液浓度偏高的是
A. NaOH固体在称量前已部分变质
B. 有少量NaOH溶液残留在烧杯里
C. 定容时,俯视容量瓶的刻度线
D. 定容摇匀后,发现溶液凹液面最低处低于刻度线,用胶头滴管补水至刻度线
(2)称取8.1g 铝镁合金粉末样品,溶于VmL1.0
 的NaOH溶液中,充分反应,过滤、洗涤、干燥、称量固体,该步骤中若未洗涤固体,测得铝的质量分数将
的NaOH溶液中,充分反应,过滤、洗涤、干燥、称量固体,该步骤中若未洗涤固体,测得铝的质量分数将方案二:
将5.1g 铝镁合金与足量稀硫酸反应,测定生成气体的体积。
(3)同学们拟选用下图实验装置完成实验:

①你认为最简易的装置的连接顺序是:A接______,_______接______,______接______(填接口字母,可不填满)。
②实验结束时,在测量实验中生成氢气的体积时,你认为合理的是
A.待实验装置冷却后再读数
B.上下移动量筒H,使其中液面与广口瓶中液面相平
C.视线与凹液面的最低点水平相切,读取量筒中水的体积
D.上下移动量筒K,使其中液面与广口瓶中液面相平
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:
①稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;
②实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小,于是他们设计了如图所示的实验装置:

①装置中导管a的作用是
②实验后测得生成的氢气在标准状况下的体积为5.6 L,则铝的质量分数为
您最近一年使用:0次
名校
9 . 下列方案设计、现象和结论都正确的是
目的 | 方案设计 | 现象和结论 | |
A | 探究食品脱氧剂中还原铁粉是否变质 | 取少量样品溶于盐酸,滴加 溶液 溶液 | 溶液未变红,说明铁粉未变质 |
B | 证明乙烯的氧化反应 | 将乙烯通入盛有溴水的试管中 | 溴水褪色,说明乙烯被溴水氧化 |
C | 检验某气体是否为 | 将该气体通入到品红溶液中 | 品红溶液褪色,说明该气体是 |
D | 比较 、 、 的 的 大小 大小 | 向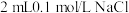 溶液中滴加2滴同浓度 溶液中滴加2滴同浓度 溶液,振荡后再加入4滴同浓度 溶液,振荡后再加入4滴同浓度 溶液 溶液 | 先产生白色沉淀,后产生黄色沉淀,说明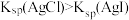 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 某磁铁矿石A的主要成分是磁性氧化铁(Fe3O4),还含少量的Al2O3、CuO。某工厂利用此矿石回收单质铜和绿矾(FeSO4·7H2O)。工艺流程如图,根据流程回答下列问题:
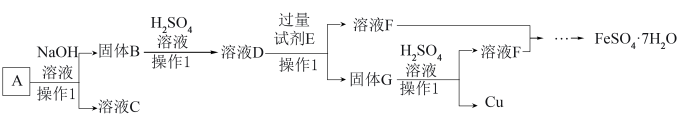
(1)操作1的名称是______ 。
(2)溶液C的溶质主要是______ 。
(3)检验溶液D中含Fe3+的方法是______ ,溶液D与过量试剂E反应的离子方程式Fe+Cu2+=Fe2++Cu、______ 。
(4)FeSO4·7H2O可处理工业废水中有毒的 ,反应的离子方程式为Fe2++
,反应的离子方程式为Fe2++ +H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为
+H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为______ 。
(5)FeSO4·7H2O由于保存不当容易被空气中氧气氧化而变质,可用酸性KMnO4溶液测定其纯度,测定原理为5Fe2++ +8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为
+8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为______ (用含有a、c、V的式子表示)。

(1)操作1的名称是
(2)溶液C的溶质主要是
(3)检验溶液D中含Fe3+的方法是
(4)FeSO4·7H2O可处理工业废水中有毒的
 ,反应的离子方程式为Fe2++
,反应的离子方程式为Fe2++ +H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为
+H+→Fe3++Cr3++H2O(未配平),该反应中,氧化剂与还原剂的物质的量之比为(5)FeSO4·7H2O由于保存不当容易被空气中氧气氧化而变质,可用酸性KMnO4溶液测定其纯度,测定原理为5Fe2++
 +8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为
+8H+=5Fe3++Mn2++4H2O。现有一瓶绿矾样品,取出ag于试管中,往其中加入Vmlcmol/L酸性KMnO4溶液恰好完全反应,则绿矾样品的纯度为
您最近一年使用:0次



