1 . 下列操作能达到实验目的是( )
A.将 样品溶于稀硫酸后,滴加 样品溶于稀硫酸后,滴加 溶液变红,说明样品变质 溶液变红,说明样品变质 |
B.只用 溶液来鉴别 溶液来鉴别 溶液、 溶液、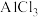 溶液和稀硫酸 溶液和稀硫酸 |
| C.为检验某品牌实验中是否加碘,将样品溶解后加淀粉溶液 |
D.向某溶液中滴加少量稀硝酸,产生白色沉淀,证明其中含有 |
您最近一年使用:0次
19-20高一·浙江·阶段练习
解题方法
2 . 为测定已部分变质为Na2CO3的过氧化钠样品的纯度,设计了如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中。
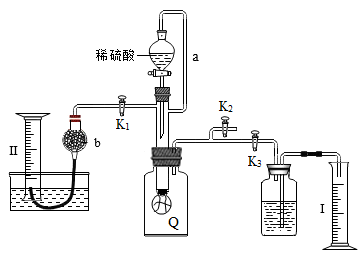
请填空:
(1)Q内发生反应生成_______________ 种气体。
(2)为测出反应时生成气体的总体积,滴稀硫酸前必须关闭_________ (填“K1”“K2”或“K3”,下空同),打开____________ 。
(3)当上述反应停止时,使K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是________________ 。
(4)b中装的固体试剂是_______________ ,缓缓打开K1的理由是__________ 。

请填空:
(1)Q内发生反应生成
(2)为测出反应时生成气体的总体积,滴稀硫酸前必须关闭
(3)当上述反应停止时,使K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是
(4)b中装的固体试剂是
您最近一年使用:0次
解题方法
3 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验,请回答以下问题:
(1)纯净的Na2O2是________ 色固体,其中氧元素的化合价为_________ 价。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了20.0 g样品,并设计用如图装置通过排水法测定E中收集到的O2的体积,来测定过氧化钠的质量分数。
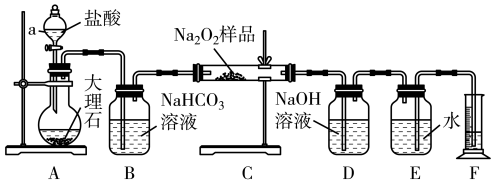
①将仪器连接好以后、加药品之前必须进行的一步操作_____ ,A中主要反应的离子方程式:_____ ;
②装置B的作用是除去二氧化碳气体中的______ 气体,写出相应的化学方程式_____ 。读出量筒内水的体积后,将其折算成标准状况下氧气的体积为2.24L,则样品中过氧化钠的质量分数为_____ 。
(1)纯净的Na2O2是
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了20.0 g样品,并设计用如图装置通过排水法测定E中收集到的O2的体积,来测定过氧化钠的质量分数。

①将仪器连接好以后、加药品之前必须进行的一步操作
②装置B的作用是除去二氧化碳气体中的
您最近一年使用:0次
12-13高三上·上海浦东新·期中
名校
4 . 有一Na2SO3固体因部分被氧化而变质。为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
【甲同学】称取m g样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1 g。
(1)BaCl2溶液必须过量的原因是_________________________________ 。
(2)洗涤残留固体的方法是_________________________________________ 。
(3)判断残留固体质量m1 g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是__________________________________ 。
【乙同学】称取m g样品溶于水,配成溶液,用滴定管取V mL于锥形瓶中,用浓度为c mol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO32- + MnO4- SO42- + Mn2+(未配平)
(4)配制样品溶液时,不一定需要的实验仪器是_________ (错选扣分)。
A.容量瓶 B.玻璃棒 C.滴定管 D.烧杯
(5)滴定终点的判断依据是____________________________________ 。
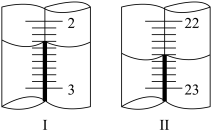
(6)滴定管液面变化如图所示,图Ⅰ显示初读数为___________ mL,根据图Ⅱ所示末读数,可得样品纯度计算式为___________________ 。(缺少的数据用A代替,数量级与本题一致)
【甲同学】称取m g样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1 g。
(1)BaCl2溶液必须过量的原因是
(2)洗涤残留固体的方法是
(3)判断残留固体质量m1 g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是
【乙同学】称取m g样品溶于水,配成溶液,用滴定管取V mL于锥形瓶中,用浓度为c mol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO32- + MnO4- SO42- + Mn2+(未配平)
(4)配制样品溶液时,不一定需要的实验仪器是
A.容量瓶 B.玻璃棒 C.滴定管 D.烧杯
(5)滴定终点的判断依据是

(6)滴定管液面变化如图所示,图Ⅰ显示初读数为
您最近一年使用:0次
名校
5 . 乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的补铁剂易溶于水,吸收效果比无机铁好。乳酸亚铁可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁(FeCO3)
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。某兴趣小组设计如下方案制备FeCO3,实验装置如图:
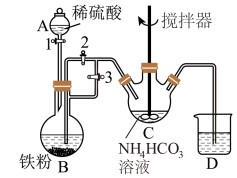
(1)仪器B的名称是__ 。
(2)利用如图所示装置进行实验,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现C中有白色沉淀和气体生成。
①第一步骤的目的是__ 。
②C中反应生成白色沉淀的离子方程式是:__ 。
③仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀。实验室中进行过滤后沉淀洗涤的操作是:__ 。
④装置D中可盛装适量的水,该装置作用是__ 。
II.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。现需要设计实验检测产品在制备过程是否因氧化而发生变质,可选用的试剂__ 。
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀硫酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴__ (试剂名称)作指示剂,用0.l0mol/L的硫代硫酸钠溶液滴定(I2+2S2O32-=S4O62-+2I-),重复实验3次,滴定终点时平均消耗硫代硫酸钠25.00mL,则样品纯度为__ 。
I.制备碳酸亚铁(FeCO3)
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。某兴趣小组设计如下方案制备FeCO3,实验装置如图:

(1)仪器B的名称是
(2)利用如图所示装置进行实验,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现C中有白色沉淀和气体生成。
①第一步骤的目的是
②C中反应生成白色沉淀的离子方程式是:
③仪器C中的混合物经过滤,洗涤后得到FeCO3沉淀。实验室中进行过滤后沉淀洗涤的操作是:
④装置D中可盛装适量的水,该装置作用是
II.制备乳酸亚铁晶体和定量测量
(1)制备乳酸亚铁晶体。将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在70℃下搅拌使反应充分进行,一段时间后,经过分离提纯操作,从所得溶液中得到乳酸亚铁晶体。现需要设计实验检测产品在制备过程是否因氧化而发生变质,可选用的试剂
(2)用碘量法测定晶体样品中铁元素的含量并计算样品的纯度。称取3.00g晶体样品,在足量空气中灼烧成灰,加足量稀硫酸溶解,将所有可溶物配成l00mL溶液。取25.00mL该溶液加入过量的KI反应,加入几滴
您最近一年使用:0次
19-20高二·浙江·阶段练习
解题方法
6 . 化学是一门以实验为基础的学科。通过分析下列实验现象,得出的结论中正确的是
| 选项 | 实验操作 | 结论 |
| A | 将Fe (NO3) 2样品溶于稀H2SO4,滴加KSCN溶液,观察到溶液变红 | Fe(NO3)2样品已氧化变质 |
| B | 将铁片投入浓硫酸中,无明显变化 | 常温下铁不与浓硫酸反应 |
| C | 向某溶液中加入Na2O2粉末,产生红褐色沉淀和无色气体 | 溶液中存在Fe3+ |
| D | 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 |  结合氢离子的能力比 结合氢离子的能力比 强 强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 亚硫酸钠固体久置变质,部分生成硫酸钠。取a g亚硫酸钠样品,依照如图装置实验,分析样品纯度(质量分数)。
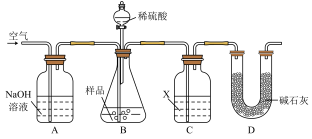
(1)在C瓶试剂X的选择上,甲同学认为使用足量的Ba(OH)2溶液比足量的Ca(OH)2溶液更合适,理由是______________________ 。
(2)实验操作步骤如下:(X采用甲同学意见)。
①先在A、B中通一段时间空气,再接上C、D;
②加稀硫酸反应;
③反应结束,通空气足够时间。该操作的目的是________________ ;
④将C中物质过滤、洗涤、干燥、称重,得b g固体。以此计算,亚硫酸钠样品纯度为_____________ 。
(3)乙同学指出,上述操作实验结果偏大,原因是(用化学反应方程式表示)_____ ;改进的措施是__________________ 。
(4)依据乙同学意见改进方案后,乙同学又提出也可以通过称量C装置前后的质量差来分析结果。丙同学指出如此操作,实验结果将偏小,原因是_______________ 。
(5)丙同学认为若以称重前后差量来分析,可称量D装置,并从以下3方面调整:
①将C瓶试剂X换为______________ 。
②在D装置后可以接________ (填选项编号)。
a. 装有无水氯化钙的干燥管 b. 装有碱石灰的干燥管
c. 装有浓硫酸的洗气瓶 d. 装有氢氧化钠溶液的洗气瓶
③先在C之前(含C)的装置中通一段时间气体,再接上D及之后的装置。

(1)在C瓶试剂X的选择上,甲同学认为使用足量的Ba(OH)2溶液比足量的Ca(OH)2溶液更合适,理由是
(2)实验操作步骤如下:(X采用甲同学意见)。
①先在A、B中通一段时间空气,再接上C、D;
②加稀硫酸反应;
③反应结束,通空气足够时间。该操作的目的是
④将C中物质过滤、洗涤、干燥、称重,得b g固体。以此计算,亚硫酸钠样品纯度为
(3)乙同学指出,上述操作实验结果偏大,原因是(用化学反应方程式表示)
(4)依据乙同学意见改进方案后,乙同学又提出也可以通过称量C装置前后的质量差来分析结果。丙同学指出如此操作,实验结果将偏小,原因是
(5)丙同学认为若以称重前后差量来分析,可称量D装置,并从以下3方面调整:
①将C瓶试剂X换为
②在D装置后可以接
a. 装有无水氯化钙的干燥管 b. 装有碱石灰的干燥管
c. 装有浓硫酸的洗气瓶 d. 装有氢氧化钠溶液的洗气瓶
③先在C之前(含C)的装置中通一段时间气体,再接上D及之后的装置。
您最近一年使用:0次
名校
8 . 下列各项中操作或现象能达到预期实验目的的是
| 实验目的 | 操作或现象 | |
| A | 分离Fe2O3、Al2O3 | 将混合物置于足量NaOH溶液中,然后依次进行过滤、洗涤、蒸发、灼烧四项操作 |
| B | 验证FeCl3与KI的反应是可逆反应 | 向1ml 0.1mol/L FeCl3溶液中滴加5mL0.1 mol/L KI溶液,充分反应后,取少许混合液滴加KSCN溶液 |
| C | 确定FeCl2是否完全变质 | 取少量的FeCl2样品于试管中,逐滴加入酸性高锰酸钾溶液 |
| D | 除去Fe粉中的I2 | 加热使I2升华 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-02更新
|
560次组卷
|
4卷引用:吉林省吉林市2021届高三上学期第一次调研考试化学试题
吉林省吉林市2021届高三上学期第一次调研考试化学试题(已下线)第15单元 实验设计与评价(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷吉林省白城市洮南一中2021届高三上学期第三次月考化学试题吉林省长春外国语学校2021届高三上学期期末考试化学试题
名校
9 . H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为___ 。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用___ 。
a.普通漏斗和滤纸
b.布氏漏斗和滤纸
c.不需滤纸的微孔玻璃漏斗
(3)在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__ 。
(4)KMnO4标准液滴定H2O2的离子方程式为___ ;当滴定到____ 可以认为已达到滴定终点。
(5)该医生消毒剂中H2O2的物质的量浓度为___ mol·L-1。
(6)②中若用盐酸代替H2SO4测定结果将__ (填“偏高”“偏低”或“无影响”)。
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用
a.普通漏斗和滤纸
b.布氏漏斗和滤纸
c.不需滤纸的微孔玻璃漏斗
(3)在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是
(4)KMnO4标准液滴定H2O2的离子方程式为
(5)该医生消毒剂中H2O2的物质的量浓度为
(6)②中若用盐酸代替H2SO4测定结果将
您最近一年使用:0次
解题方法
10 . 某校实验室过氧化钠因保存不当变质,课外活动小组称取a g样品,设计用如图装置来测定过氧化钠质量分数。
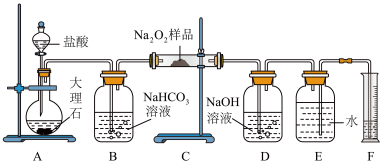
(1)将仪器连接好后,进行的第一步操作是_________ 。
(2)B装置出来的气体是否需要干燥_____________ (填“是”或“否”)。
(3)写出装置C中发生的主要反应化学方程式__________ 。
(4)D中NaOH溶液的作用________ 。
(5)实验结束时,读取实验中生成气体的体积时,不合理的是__________ 。
a.直接读取气体体积,不需冷却到室温。
b.上下移动量筒,使得E、F中液面高度相同。
c.视线与凹液面的最低点相平读取量筒中水的体积。
(6)读出量筒内水的体积后,折算成标准状况下氧气的体积为V L,则样品中过氧化钠的质量分数为_____________ 。(用含a和V的代数式表示)
(7)实验完成后E到F之间导管内残留水的体积会使测量结果________ (填“偏大”“偏小”“不影响”)。

(1)将仪器连接好后,进行的第一步操作是
(2)B装置出来的气体是否需要干燥
(3)写出装置C中发生的主要反应化学方程式
(4)D中NaOH溶液的作用
(5)实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温。
b.上下移动量筒,使得E、F中液面高度相同。
c.视线与凹液面的最低点相平读取量筒中水的体积。
(6)读出量筒内水的体积后,折算成标准状况下氧气的体积为V L,则样品中过氧化钠的质量分数为
(7)实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次



