1 . 亚硫酸钠(Na2SO3)是印染工业中常用的脱氧剂和漂白剂。回答下列问题:
(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:___________
(2)SO2可以与H2S反应,请写出其化学方程式:___________ 。
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(4)(Ga)与A1同主族,化学性质相似,是制造半导体材料氮化镓的重要原料,其中电解NaGaO2是获得Ga单质的重要方法,如图所示,则阴极的电极反应为:___________ 。若电解获得1molGa,则阳极产生的气体在标准状况下的体积至少为 ___________ L。

(1)实验室用H2SO4和NaHSO3制取SO2的化学方程式为:
(2)SO2可以与H2S反应,请写出其化学方程式:
(3)亚硫酸钠易被氧化而变质为Na2SO4,选用下列试剂设计实验方案,检验亚硫酸钠样品氧化变质的程度。仅供选择的试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解,得到无色溶液 | / |
| II | 取实验I的溶液, | 样品存在氧化变质 | |
| III | 另取实验I的溶液, | 样品并未完全氧化变质 |

您最近一年使用:0次
名校
2 . SO2和焦亚硫酸钠(Na2S2O5)可用作食品添加剂。回答下列问题:
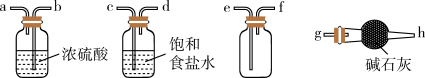
(1)实验室可用稀H2SO4和NaHSO3固体制取SO2,该反应的化学方程式为_______ ,欲净化与收集SO2,选择必要装置,按气流方向连接顺序为_______ (填仪器接口的字母编号)。
(2)焦亚硫酸钠Na2S2O5)易被氧化而变质,选用下列试剂检验Na2S2O5样品氧化变质的程度,设计并完成实验。请填写下面表格中①~④,完成实验报告:
已知:焦亚硫酸钠溶于水存在平衡:Na2S2O5+H2O⇌2NaHSO3
可选试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
(3)利用下列装置测定空气样本中SO2的含量。
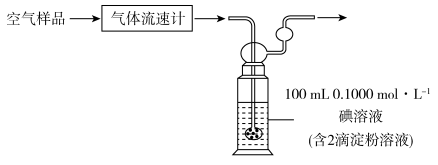
使用上述碘(I2)溶液吸收SO2发生反应的化学方程式为_______ 。若空气流速为am3·min-1,当观察到_______ 时,结束计时,测定耗时tmin。假定样品中的SO2可被溶液完全吸收,该空气样品中SO2的含量是_______ mg·m-3(用含a、t的代数式表示)
(1)实验室可用稀H2SO4和NaHSO3固体制取SO2,该反应的化学方程式为

(2)焦亚硫酸钠Na2S2O5)易被氧化而变质,选用下列试剂检验Na2S2O5样品氧化变质的程度,设计并完成实验。请填写下面表格中①~④,完成实验报告:
已知:焦亚硫酸钠溶于水存在平衡:Na2S2O5+H2O⇌2NaHSO3
可选试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
| 实验编号 | 实验步骤 | 实验现象 | 结论 |
| I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
| II | 取实验I的溶液,① | ② | 样品已氧化变质 |
| III | 另取实验I的溶液,③ | ④ | 样品未完全氧化变质 |

使用上述碘(I2)溶液吸收SO2发生反应的化学方程式为
您最近一年使用:0次
名校
3 . 下列实验操作或方案不正确的是
A.用稀硫酸与锌粒制取 时,加几滴 时,加几滴 溶液以加快反应速率 溶液以加快反应速率 |
B.滴入 溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液一定含有 溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液一定含有 |
C.检验 晶体是否已经氧化变质:将 晶体是否已经氧化变质:将 样品溶于稀 样品溶于稀 后,滴加 后,滴加 溶液,观察溶液是否变红 溶液,观察溶液是否变红 |
D.探究催化剂对 分解速率的影响:在相同条件下,向一支试管中加入 分解速率的影响:在相同条件下,向一支试管中加入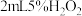 和 和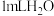 ,向另一支试管中加入 ,向另一支试管中加入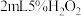 和 和 溶液,比较实验现象 溶液,比较实验现象 |
您最近一年使用:0次
2022-05-02更新
|
973次组卷
|
5卷引用:云南省昆明市云南师范大学附属中学2021-2022学年高一下学期期中考试化学试题
4 . 下列实验目的对应的方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究金属钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2~3mL蒸馏水 | 若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2 |
| B | 探究FeSO4固体样品是否变质 | 取少量待测样品溶 于蒸馏水,滴加KSCN溶液 | 若溶液变为红色,说明样品已经变质;若溶液不变色,说明样品没有变质 |
| C | 比较Cl2、Br2、I2的氧化性 | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置 | 溶液分层,下层呈紫红色,证明氧化性:Cl2>Br2>I2 |
| D | 比较H2CO3与CH3COOH的酸性 | 用pH计测定pH: ①NaHCO3 溶液 ②CH3COONa溶液 | pH①>②,证明H2CO3酸性弱于CH3COOH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如图实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入_______ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了mg样品,并利用如图装置来测定过氧化钠的质量分数。
①装置中仪器a的名称是_______ ,装置D的作用是_______ 。
②将仪器连接好以后,必须进行的第一步操作是_______ 。
③写出装置C中发生主要反应的化学方程式:_______ 。
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是_______ (填字母序号)。
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低处相平时读取量筒中水的体积

(1)探究一包Na2O2样品是否已经变质:取少量样品,将其溶解,加入
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了mg样品,并利用如图装置来测定过氧化钠的质量分数。
①装置中仪器a的名称是
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生主要反应的化学方程式:
④反应结束后,在读取实验中生成气体的体积时,你认为合理的是
a.读取气体体积前,需冷却到室温
b.调整量筒使E、F内液面高度相同
c.视线与凹液面的最低处相平时读取量筒中水的体积
您最近一年使用:0次
2022-03-07更新
|
176次组卷
|
3卷引用:河南省鹤壁市浚县第一中学2022-2023学年高一上学期10月考试化学试题
解题方法
6 . 过氧化锶(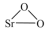 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→____ (选择必要的仪器,可重复选择)。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式____ 。
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
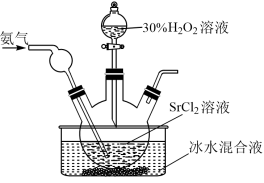
①盛装H2O2溶液的仪器名称为____ 。
②写出该方法制备SrO2·8H2O的离子方程式____ ,NH3的作用是___ 。
③冰水浴的原因是___ 。
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至____ (写出实验现象),记下此时消耗标准溶液的体积,重复实验3~4次,得如表数据:
SrO2·8H2O样品的纯度为____ (已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:

①盛装H2O2溶液的仪器名称为
②写出该方法制备SrO2·8H2O的离子方程式
③冰水浴的原因是
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至
| 平行实验 | 1 | 2 | 3 | 4 |
| 消耗标准溶液体积(mL) | 19.98 | 19.50 | 20.00 | 20.02 |
 =2I-+S4O
=2I-+S4O )
)
您最近一年使用:0次
名校
解题方法
7 . 为了测定某氯化钙样品中钙元素的含量,进行如下实验(实验步骤已打乱):
①将沉淀全部放入锥形瓶中,加入足量的10% H2SO4和适量的蒸馏水,使沉淀完全溶解,溶液呈酸性,加热至75℃,趁热用0.0500mol/L KMnO4溶液进行滴定,记录所用KMnO4溶液的体积。
②过滤并洗涤沉淀。
③准确称取氯化钙样品0.2400g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35.00mL 0.2500mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀。经检验,Ca2+已沉淀完全。
④再重复以上操作3次并进行数据处理,得出平均所用KMnO4溶液的体积为16.00mL
完成下列各题:
(1)上面的实验步骤合理的顺序是_______ 。(填序号)
(2)写出步骤①中加入KMnO4溶液后发生反应的离子方程式_______ 。
(3)滴定终点判断的依据是_______ 。
(4)某次实验滴定结束时滴定管内的液面见图,则此时液面读数为_______ mL。

(5)根据数据计算,样品中钙元素的质量分数为_______ %。(保留两位小数)
(6)同学乙重复实验,计算出的钙元素质量分数偏大,可能有的原因有_______。
①将沉淀全部放入锥形瓶中,加入足量的10% H2SO4和适量的蒸馏水,使沉淀完全溶解,溶液呈酸性,加热至75℃,趁热用0.0500mol/L KMnO4溶液进行滴定,记录所用KMnO4溶液的体积。
②过滤并洗涤沉淀。
③准确称取氯化钙样品0.2400g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35.00mL 0.2500mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀。经检验,Ca2+已沉淀完全。
④再重复以上操作3次并进行数据处理,得出平均所用KMnO4溶液的体积为16.00mL
完成下列各题:
(1)上面的实验步骤合理的顺序是
(2)写出步骤①中加入KMnO4溶液后发生反应的离子方程式
(3)滴定终点判断的依据是
(4)某次实验滴定结束时滴定管内的液面见图,则此时液面读数为

(5)根据数据计算,样品中钙元素的质量分数为
(6)同学乙重复实验,计算出的钙元素质量分数偏大,可能有的原因有_______。
| A.酸性高锰酸钾溶液已部分变质 |
| B.滴定过程中,用蒸馏水冲洗锥形瓶内壁上的KMnO4溶液 |
| C.滴定时有部分高锰酸钾溶液滴在了实验台上 |
| D.酸式滴定管用蒸馏水洗过后又用所要盛装的溶液润洗 |
您最近一年使用:0次
2022-04-11更新
|
332次组卷
|
3卷引用:重庆市万州第二高级中学2021-2022学高二下学期入学考试化学试题
名校
8 . 某FeSO4在空气中久置发生了部分变质,为测定该样品的纯度,进行如下分析:
(1)准确移取25.00 mL 0.05000 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的离子方程式_______ ;达到滴定终点的现象是_______ ;计算KMnO4溶液的浓度为_______ (保留2位有效数字)
(2)准确称取mg样品,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用上述KMnO4溶液滴定,消耗12.75 mL。则该样品中FeSO4的质量分数为_______ (用含m的式子表示)。
(3)测定样品纯度的过程中,下列操作会引起所测FeSO4的质量分数偏低的是_______ 。
A.称取mg样品放入锥形瓶中,加入25 mL蒸馏水溶解时搅拌时间过长
B.上述(2)步骤中,用KMnO4溶液滴定达终点读数时俯视
C.上述(2)步骤中,所用的锥形瓶不干燥
(1)准确移取25.00 mL 0.05000 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的离子方程式
(2)准确称取mg样品,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用上述KMnO4溶液滴定,消耗12.75 mL。则该样品中FeSO4的质量分数为
(3)测定样品纯度的过程中,下列操作会引起所测FeSO4的质量分数偏低的是
A.称取mg样品放入锥形瓶中,加入25 mL蒸馏水溶解时搅拌时间过长
B.上述(2)步骤中,用KMnO4溶液滴定达终点读数时俯视
C.上述(2)步骤中,所用的锥形瓶不干燥
您最近一年使用:0次
名校
9 . 亚铁氰化钾晶体,化学式为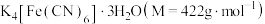 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
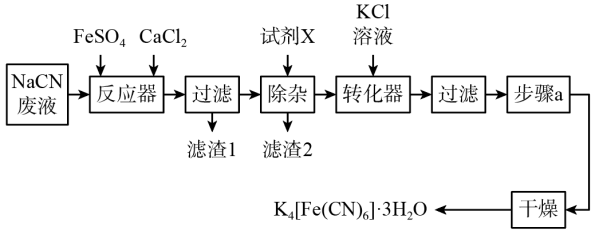
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为___________ 。
(2)反应器中发生的主要反应的化学方程式为___________ 。
(3)在“除杂”步骤中,向体系中加入适量的试剂X为___________ (填字母)。
a.NaCl b. c.
c.
(4)转化器中发生反应的离子方程式___________ 。
(5)实验室进行步骤a的操作为___________ 。
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下:
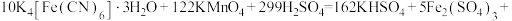
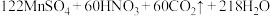
①通过计算确定该样品的纯度是___________ (保留3位有效数字)。
②下列操作会使测定结果偏高的是___________ (填字母)。
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
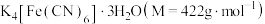 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为
(2)反应器中发生的主要反应的化学方程式为
(3)在“除杂”步骤中,向体系中加入适量的试剂X为
a.NaCl b.
 c.
c.
(4)转化器中发生反应的离子方程式
(5)实验室进行步骤a的操作为
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用
 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下: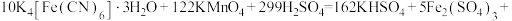
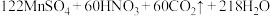
①通过计算确定该样品的纯度是
②下列操作会使测定结果偏高的是
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
您最近一年使用:0次
2022-03-18更新
|
860次组卷
|
4卷引用:山东省泰安市2021-2022学年高三下学期3月一模考试化学试题
山东省泰安市2021-2022学年高三下学期3月一模考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)河北省衡水中学2022-2023学年高三上学期四调考试化学试题陕西省西安中学2023-2024学年高三上学期期末考试理综试题-高中化学
名校
解题方法
10 . 比亚迪推出了基于磷酸亚铁锂技术的“刀片电池”,该电池能量密度大,安全性高。生产“刀片电池”需要用到FeSO4,某工业废料中主要含Fe2O3、Al2O3、SiO2 (其他成分与酸碱都不反应),某同学设计如下工艺流程从工业废料中回收绿矾

请回答:
(1)“碱浸”过程中,将工业废料粉碎的目的是___________ (写出一种)。
(2)“碱浸”时发生的离子方程式为___________ 。
(3)“提纯操作1”制取绿矾晶体需先加入少量稀硫酸,再经过___________ 、冷却结晶、过滤、洗涤、干燥。
(4)某同学为了验证某久置的FeSO4溶液是否变质,取少量待测液于试管中,加入2滴___________ 溶液,若观察到___________ ,则证明该溶液已经变质。
(5)称取1.390 0 g新制绿矾样品,以稀硫酸酸化,用0.040 0 mol·L-1的KMnO4标准液滴定至终点,消耗KMnO4标准液24.00 mL。该滴定反应的离子方程式为___________ ,取样样品的纯度为___________ (已知FeSO4·7H2O的摩尔质量为278 g·mol-1)。

请回答:
(1)“碱浸”过程中,将工业废料粉碎的目的是
(2)“碱浸”时发生的离子方程式为
(3)“提纯操作1”制取绿矾晶体需先加入少量稀硫酸,再经过
(4)某同学为了验证某久置的FeSO4溶液是否变质,取少量待测液于试管中,加入2滴
(5)称取1.390 0 g新制绿矾样品,以稀硫酸酸化,用0.040 0 mol·L-1的KMnO4标准液滴定至终点,消耗KMnO4标准液24.00 mL。该滴定反应的离子方程式为
您最近一年使用:0次
2022-03-08更新
|
233次组卷
|
4卷引用:湖北省新高考联考协作体2021-2022学年高一下学期3月考试化学试题



